丹参注射液对脑梗死大鼠SVZ干细胞增殖作用的研究
2014-05-28杨万章
林 惠,杨万章
丹参注射液是丹参的水溶性复合物,也是丹参活血化瘀的主要成分,在预防和治疗脑血管疾病中显示了重要性。丹参注射液能上调脑梗死大鼠脑组织中血管内皮生长因子(VEGF)及外周血脑源性神经生长因子(BDNF)的表达[1,2],对血管新生和神经重塑有积极作用。本文在前期研究的基础上观察不同时间点丹参注射液对急性脑梗死大鼠神经功能和室管膜下区(SVZ)溴脱氧尿嘧啶核苷(BrdU)+/巢蛋白(nestin)细胞表达的影响,旨在探讨丹参注射液治疗脑梗死的分子机制。
1 材料与方法
1.1 实验动物 SPF 级健康雄性Sprague-Dawley(SD)大鼠60只,体重(250~300)g,周龄(8~10)周,由广东省动物实验中心提供,生产许可证:SCXK(粤)2008-0002。
1.2 局灶性脑梗死模型建立 采用经改良颈总动脉线栓法[3]制备大鼠左侧大脑中动脉闭塞(MCAO)致局灶性永久性脑缺血梗死模型。大鼠手术后12h根据ZealLonga的5分制评分标准进行神经功能学评分[4],丹参注射液组及生理盐水组均选取1分~3分者为实验对象,假手术组只剪开颈部中央,暴露颈总动脉和颈内动脉,但不予大脑中动脉阻断。
1.3 实验分组 剔除因麻醉和手术意外死亡及未达模型标准的大鼠后,将符合模型标准的MCAO 大鼠24只随机分为丹参注射液组和生理盐水组,每组12只,两组大鼠再随机分为治疗7d、14d,每个亚组6只。另外随机取12只大鼠作假手术组,随机分为7d、14d,每个亚组6只。
1.4 治疗方法 丹参注射液组大鼠入选术后12h开始连续使用注射丹参注射液(杭州正大青春宝药业公司,生产批号:1208181),腹腔注射,每次2mL,1次/日,治疗7d、14d。生理盐水组大鼠入选后12h开始连续使用与丹参注射液等剂量的生理盐水,连用7d、14d。假手术组不给任何治疗。
1.5 神经功能缺损评定 改良神经功能损伤评分(mNSS)[5]:分别在丹参注射液及生理盐水治疗前、治疗7d、14d时进行神经功能缺损评定。该量表包括运动、感觉、反射和平衡功能的综合性评分指标。通过运动试验、感觉试验、平衡木试验反射丧失和不正常运动,综合评价神经系统损伤的严重程度,4个项目的总和为最终评分。严重损伤评分为18分~13分;重度损伤评分为12分~7分;轻度损伤评分为6分~1分。
1.6 TTC染色 动物治疗疗程结束时,断头取脑,置于-20℃冰箱中速冻20min;避光配制2%的TTC溶液。取出成功染色的脑片,放置于扫描机上扫描图片。
1.7 BrdU 注射及冰冻切片制作 治疗后分别于7d、14d处死大鼠。处死前3d开始腹腔注射BrdU 每天2次,每次间隔8h。取脑标本时予大鼠腹腔注射10%水合氯醛麻醉,快速从左心室灌注磷酸缓冲液(PBS,1M)100 mL,再灌注4%多聚甲醛100 mL后取脑。冰冻切片用包埋组织剂包埋。将收集的SVZ脑片置于含叠氮化钠的PBS溶液中放置4°冰箱保存。
1.8 免疫荧光染色及检测BrdU+/nestin+、GFAP+/nestin+细胞 选择大脑切片放于24孔板中,PBS漂洗。封闭液封闭非特异抗原1h,吸干封闭液,分别加入BrdU 稀释液,GFAP稀释液后放置4°冰箱孵育24h;冰箱取出后PBS漂洗,加入对应的荧光 二抗,驴抗绵羊(1∶200,Dylight488,Abcam公司),驴抗兔(1∶200,AF488,Abcam 公司生产)稀释液,室温避光孵育2h;双染时,PBS漂洗,分别加入nestin(小鼠多抗,1∶400,Abcam公司),室温中避光孵育3h后PBS漂洗,加入对应的二抗,驴抗小鼠(1∶200,AF594,Abcam 公司)室温中孵育1.5h,PBS 漂洗,含DAPI防荧光淬灭液封片,通过激光共聚焦显微镜(Leica SP5)拍片统计双标阳性细胞数量,用计算机图像分析软件,统计双侧SVZ的BrdU+/nestin+、GFAP+/nestin+细胞数。参照Kuhn等[6,7]方法,计算双标阳性细胞数。
1.9 统计学处理 采用统计软件SPSS16.0进行处理。数据以均数±标准差)表示。满足正态性和方差齐性后,采用配对t检验;不满足正态性和方差齐性时,采用秩和检验;SVZ区阳性细胞数进行单因素方差分析。确定方差齐性后,组间比较采用LSD法,若方差不齐,组间比较采用Dunnetts’C法。P<0.05为差异有统计学意义。
2 结 果
2.1 行为学评定 假手术组大鼠麻醉苏醒后活动正常,mNSS评分为0分。治疗前丹参注射液组和生理盐水组mNSS评分无统计学意义(P>0.05)。治疗后丹参注射液组与生理盐水组mNSS评分均降低,大鼠神经功能均趋于好转;在7d、14d,丹参注射液组mNSS评分显著低于生理盐水组(P<0.05),丹参注射液能明显改善脑梗死后大鼠的功能障碍。详见表1。
表1 两组大鼠不同时间点神经功能总评分比较分

表1 两组大鼠不同时间点神经功能总评分比较分
与本组治疗前比较,1)P<0.05;与丹参注射液组同时间点比较,2)P<0.05
组别 n 治疗前 治疗后第7天 治疗后第14天丹参注射液组 12 10.08±0.79 4.50±0.551) 2.83±0.411)生理盐水组 12 10.41±1.08 6.83±0.411)2)5.83±0.751)2)
2.2 脑梗死大鼠双侧SVZ的BrdU 表达 TTC染色验证模型成功,梗死灶在左侧大脑皮层。梗死后同时间点双侧SVZ 的BruU+细胞数没有差异。假手术组各时间点无明显差异;在治疗后7d、14d丹参注射液组BrdU+细胞均显著高于生理盐水组和假手术组(P<0.05)。治疗后第14天与7天比较BrdU+细胞有所下降,但丹参注射液组仍高于同期内的生理盐水组和假手术组(P<0.05)。详见表2。
2.3 丹参注射液对SVZ的NSCs增殖的影响 3组大鼠各时间点双侧SVZ的BrdU+/nestin+细胞占BrdU+细胞的比率(阳性率)无统计学意义;假手术组大鼠各时间点SVZ的BrdU+、BrdU+/nestin+细胞数差异无统计学意义。治疗第7天、第14天丹参注射液组BrdU+、BrdU+/nestin+细胞数与生理盐水组,假手术组比较差异有统计学意义(P<0.05);3组脑梗死大鼠各时间点双侧SVZ 均未发现GFAP+/nestin+细胞。详见表2。
表2 各组不同时间点BrdU+及BrdU+/nestin+细胞数及阳性率比较个
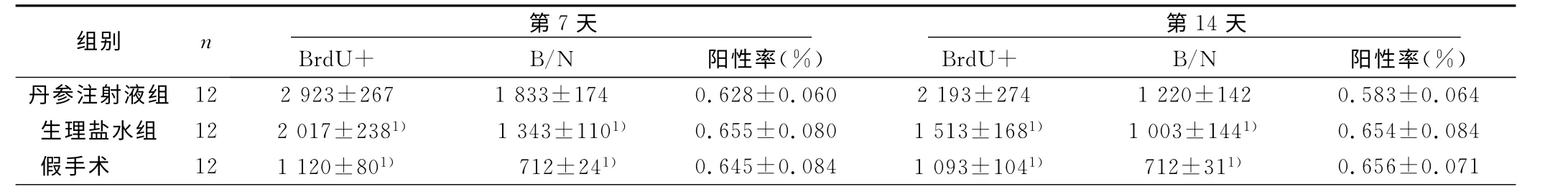
表2 各组不同时间点BrdU+及BrdU+/nestin+细胞数及阳性率比较个
与丹参注射液组同时间点比较,1)P<0.05
组别 n Br dU + B第/7N天 阳性率(%)BrdU+第B/1N4 天 阳性率(%)丹参注射液组 12 2 923±267 1 833±174 0.628±0.060 2 193±2741 220±142 0.583±0.064生理盐水组 12 2 017±2381) 1 343±1101) 0.655±0.080 1 513±1681) 1 003±1441) 0.654±0.084假手术 12 1 120±801) 712±241) 0.645±0.084 1 093±1041) 712±311) 0.656±0.071
3 讨 论
丹参为唇形科多年生草本植物的根,具有活血化瘀、养血安神、凉血消痈、排脓生肌等作用,丹参注射液是丹参的水溶性复合物,其主要成分是丹酚酸B 和丹参素,目前临床已广泛应用于治疗和预防脑血管疾病[8,9]。叶瑞印等[10]在丹参注射液对脑梗死患者内皮祖细胞(EPCs)数量及活性的研究中对患者的静脉血行EPCs培养发现,丹参注射液能提高脑梗死患者外周血EPCs数量,并增强EPCs增殖、迁移和黏附功能。邓英光等[11]在丹参注射液联合骨髓干细胞(MSCs)移植治疗脑梗死肢体瘫痪的临床研究中,发现其显著缓解瘫痪肢体症状,丹参注射液联合MSCs治疗急性脑梗死安全可行。
本研究显示,在急性脑缺血损伤后,SVZ的细胞发生增殖,增殖细胞在缺血后7d达到高峰,治疗14d后仍可以看到细胞增殖,丹参注射液能改善大鼠的神经功能,增强nestin的表达。Nestin是1985年发现的一种由胚胎大鼠脊神经管神经干细胞表达的一种蛋白质[12]。实验还发现,缺血性脑损伤后,SVZ 的GFAP表达增多,GFAP是星形细胞的标志蛋白,在星形细胞中有丰富的、唯一的表达,在缺血损伤时,刺激成熟星形细胞合成GFAP,GFAP主要用于标记损伤后胶质活动[13]。星形胶质细胞在脑梗死中具有重要的作用,其代谢特性表现为可在脑梗死早期吞噬细胞外的有害神经介质,以维持脑内微环境的稳定。丹参注射液对于促进创伤修复再生、减轻组织损伤等方面发挥作用;丹参注射液中酚酸类单体丹酚酸B 具有抗氧化,清除自由基的作用[14],可以改善干细胞的自我更新、增殖和分化所依赖的周围特殊微环境;且丹参注射液促进SVZ 的NSCs增殖,同时增殖的细胞产生和释放细胞因子有助于改善脑损伤后微环境,促进干细胞的存活[15]。
(附:本实验从动物采购到完成均在中国科学院深圳先进技术研究院实验室进行)。
[1] 赵宁,陆琳,杨万章,等.丹参注射液对急性脑梗死大鼠脑组织VEGF表达的影响[J].中西医结合心脑血管病杂志,2013,11(5):584-586.
[2] 赵宁,杨万章,李娇,等.丹参注射液对脑梗死患者自体外周血干细胞旁分泌BDNF的影响[J].中西医结合心脑血管病杂志,2013,11(1):49-51.
[3] 李浩,贾建平.大鼠大脑中动脉线栓法的改良与评价[J].中风与神经病杂志,2006,23(6):666-668.
[4] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[5] Chen J,Sanberg PR,Li Y,et al.Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J].Stroke,2001,32(11):2682-2688.
[6] Kuhn HG,Dickinson-Anson H,Gage FH.Neurogenesis in the dentate gyrus of the adult rat:Age-related decrease of neuronal progenitor proliferation[J].J Neurosci,1996,16(6):2027-2033.
[7] Costa SR,Ketty BR,Bardgett RD,et al.Exploitation of immunofluorescence for the quantification and characterization of small numbers of Pasteuria endospores[J].FEMS Microbiol Ecol,2006,58(3):593-600.
[8] 李勤芝.丹参治疗急性脑梗死50例疗效观察[J].现代诊断与治疗,2013,24(1):69.
[9] 杨凤芹.丹参注射液对急性脑梗死患者神经功能和血液流变学的影响[J].中国药物评价,2012,29(4):284-285.
[10] 叶瑞印,陈建胜.丹参注射液对脑梗死患者内皮祖细胞数量级活性的影响[J].浙江中医杂志,2011,46(2):153.
[11] 邓英光,张紫萍,余卫,等.丹参注射液联合骨髓干细胞移植治疗脑梗死肢体瘫痪的临床研究[J].实用心脑肺血管病杂志,2012,20(3):424-425.
[12] Hockfield S,McKay RD.Identification of major cell classes in the developing mammalian nervous system[J].J Neurosci,1985,5(12):3310-3328.
[13] Day JR,Laping NJ,Lampert-Etchells M,et al.Gonadal steroids regulate the expression of glial fibrillary acidic protein in the adult male rat hippocampus[J].Neuroscience,1993,55(2):435-443.
[14] Wang Y,Jiang YE,Huang QF,et al.Neuroprotective effects of salvianolic acid B against oxygen-glucose deprivation/reperfusion damage in primary rat cortical neurons[J].Chin Med J,2010,123(24):3612-3619.
[15] Okano H,Sawamoto K.Neural stem cells:Involvement in adult neurogenesis and CNS repair[J].Philos Trans RSoc Lond B Biol Sci,2008,363(1500):2111-2122.
