复合反胶束后萃花生蛋白提取条件优化
2014-05-25陈复生李润洁
郭 珍 陈复生 李润洁
(河南工业大学,郑州 450001)
花生是我国主要的油料资源,同时富含24%~36%的蛋白质。花生蛋白含有多种必需氨基酸,不含胆固醇[1]。与大豆蛋白相比,抗营养因子较少,可消化性强。目前我国利用花生制油过程造成了花生蛋白的损失与变性,因此,探寻一种新型制备花生蛋白技术有着重要的意义。
反胶束萃取技术是一种新型的可用于提取具有生物活性物质的技术[2]。已有研究显示,反胶束萃取技术可以实现大豆中蛋白质和油脂同时分离,并减少蛋白质的变性,且大多数采用的都是AOT单一反胶束体系,而研究发现,把不同类型表面活性剂混合起来制备可以形成具有良好性质的混合反胶束体系,增加增溶水量[3-4],因此本试验将阴离子表面活性剂AOT与SDS混合配制复合反胶束进行研究。
本试验采用AOT-SDS/异辛烷-正辛醇复合反胶束对花生蛋白进行提取,考察pH、时间、KCl、温度对后萃率的影响,采用二次通用旋转组合设计,以后萃率为指标获取较佳工艺条件,为反胶束在花生蛋白提取过程中的应用获得数据指导。
1 材料与仪器
1.1 试验原料
全脂花生粉:河南帝鑫食品有限公司。
1.2 主要试剂
丁二酸二异辛酯磺酸钠(AOT):上海海曲化工厂;十二烷基硫酸钠(SDS):天津市科密欧化学试剂有限公司;异辛烷、正辛醇,磷酸二氢钾、磷酸氢二钾,氯化钾均为分析纯。
1.3 试验仪器
BS210S型电子天平:德国Sartorius公司;GL–20L型高速冷冻离心机、ZSD–2J型自动水分滴定仪:上海安亭电子仪器厂;pH 211型酸度计:意大利HANNA公司;Nichipet EXII型移液枪:日本Nichiryo公司;UV-1901型紫外分光光度计:北京普析通用仪器有限责任公司;KQ-250B型超声波清洗器:昆山市超声仪器有限公司。
2 试验方法
2.1 蛋白质标准曲线制作[5]
以牛血清蛋白为标准,紫外分光光度计测定不同浓度标准蛋白液在280 nm处吸光值,以蛋白质浓度为横坐标,对应吸光值为纵坐标绘制标准曲线,见图1。
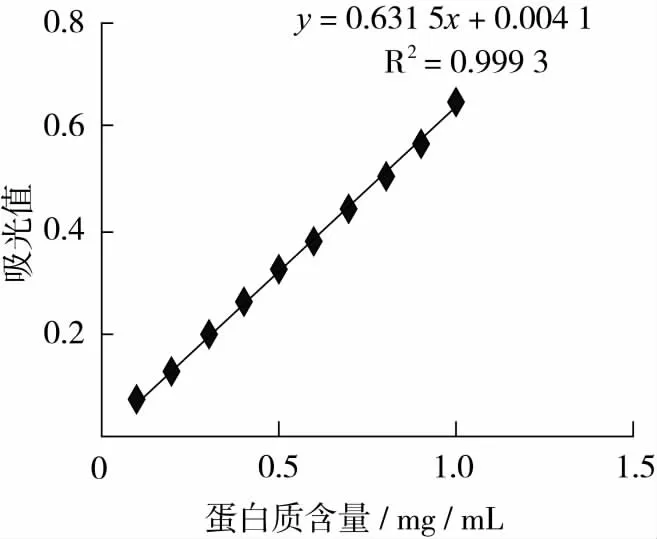
图1 280 nm处牛血清白蛋白浓度与吸光值的关系
2.2 AOT/SDS 反胶束溶液配制[6]
称取1.6 g AOT与1.2 g SDS表面活性剂置于100 mL锥形缓冲溶液瓶中,同时加入32 mL异辛烷,3 mL正辛醇和适量pH为8的KH2PO4-K2HPO4缓冲溶液,磁力搅拌使之混合均匀,再超声处理一定时间至溶液透明。
2.3 蛋白质前萃液的配制
按0.01 g/mL将全脂花生粉加入配制好的反胶束溶液中,在35℃条件下超声15 min,超声功率为210 W,然后以3 000 r/min的速度离心15 min,取上清液(即前萃液),采用紫外分光光度法在280 nm处测其吸光值。
2.4 蛋白质后萃液的配制及后萃率的计算
取一定体积的前萃液与等体积的一定浓度一定pH的KCl的KH2PO4-K2HPO4缓冲液混合,超声处理一定时间后在4 000 r/min条件下离心15 min,取下层水相(后萃液)在280nm处测其吸光值。
蛋白质后萃率=后萃液中蛋白质量(g)/前萃液中蛋白质量(g)×100%
2.5 二次通用旋转试验设计
选取pH、时间、KCl、温度4个因素进行优化试验。主要以蛋白质后萃率作为评价指标,采用二次通用旋转组合设计的方法优化花生蛋白的提取工艺参数,结合DPS v7.05软件进行分析,试验因素、水平及编码见表1。
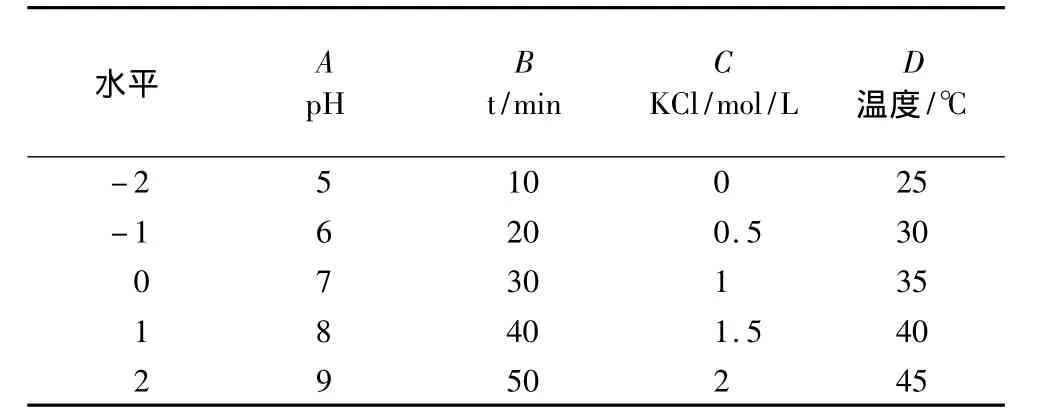
表1 二次通用旋转组合设计因素水平编码表
3 结果与讨论
3.1 四因素二次通用旋转设计的试验结果
采用四因素二次通用旋转设计试验,研究pH、温度、时间、KCl浓度对后萃率的影响。试验结果如表2。

表2 二次通用旋转组合试验方案设计试验结果

表2(续)
3.2 模型的建立及其显著性检验
利用DPS软件对表2试验数据进行回归方差分析,分析结果见表3,得到的二次回归模型为:Y=73.039 49+10.472 14A+0.791 24B+6.589 34C+0.716 203D -1.693 95A2-0.666 15B2-3.064 35C2-0.568 26D2-0.893 21AB -8.171 01AC -0.193 32AD -2.410 43BC -2.655 15BD+1.617 56CD,在 α =0.10显著水平剔除不显著项后,简化后的回归方程:Y=73.039 49+10.472 14A+6.589 34C -3.064 35C2-8.171 01AC。
由表3可知,回归方程失拟检验 F1=1.323<F0.05(10,6)=4.06,说明未控制因素对试验影响很小,可进一步对回归模型进行拟合检验;拟合检验F2=4.984 > F0.05(14,16)=2.35,说明回归模型达到显著水平,方程与实际情况拟合良好,能够较好的反映pH、时间、KCl浓度、温度与后萃率的关系。单因素中,pH(A)以及KCl浓度(C)对萃取率的影响极显著,交互项AC(温度和KCl浓度)达到了极显著水平。由残差分析图2也可以看出,实际观测值与回归拟合值之差落在-3~3范围内,说明回归模型良好。
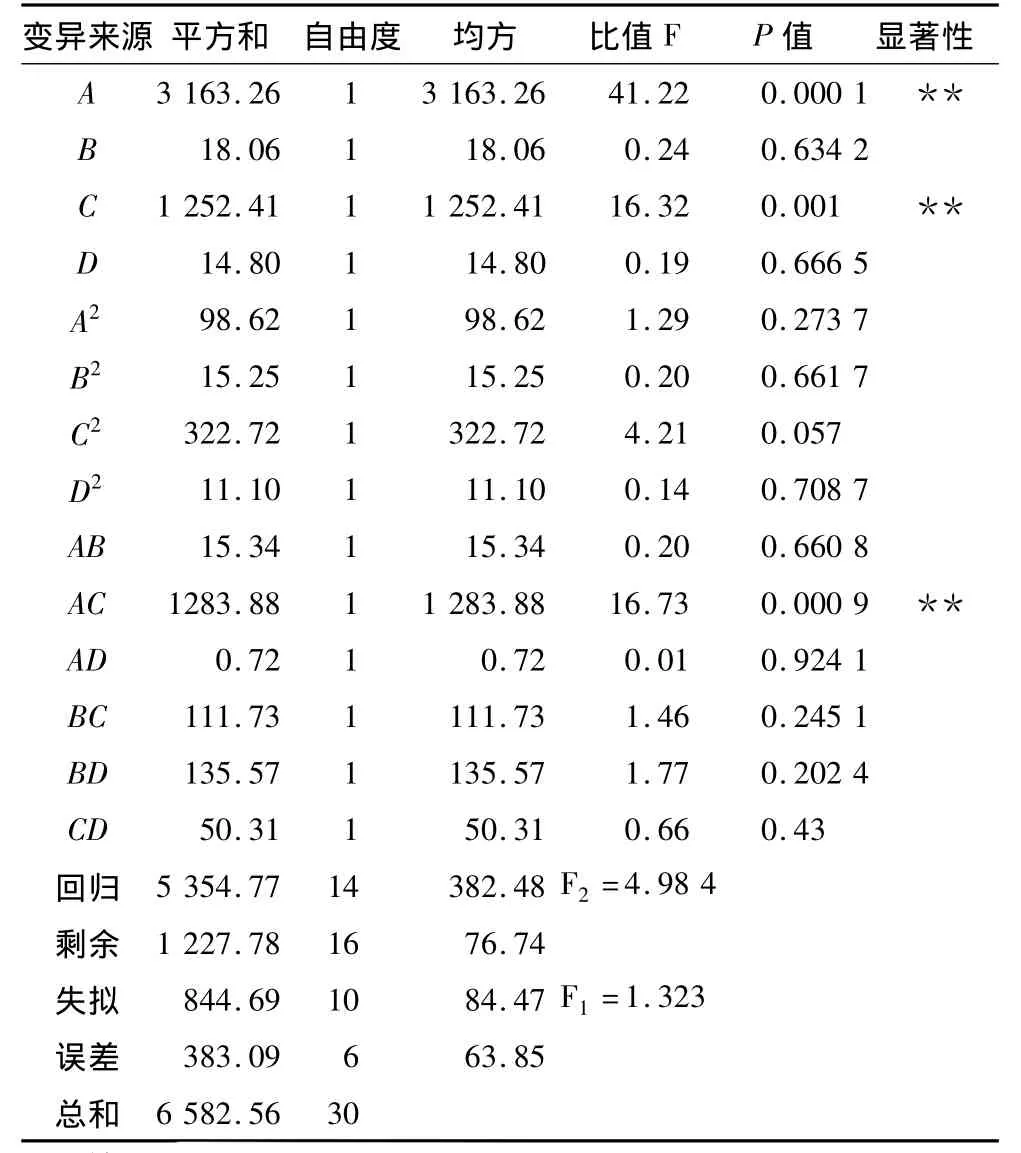
表3 试验结果方差分析表

图2 残差分析图
3.3 主因子效应分析
从所建立的回归方程的偏回归系数绝对值的大小可判明因子的重要程度,系数的正负表示因子效应作用的方向[7]。因此,各因素在试验取值范围内对蛋白质后萃率作用大小依次为:pH(A)>KCl浓度(C)>温度(B)>时间(D),对试验结果的影响都是正效应。
3.4 单因素效应分析
将4个因素中3个因素固定在零水平,对数学模型进行分析,得到以另一个因素为决策变量的偏回归模型,分析结果见表4及图2。
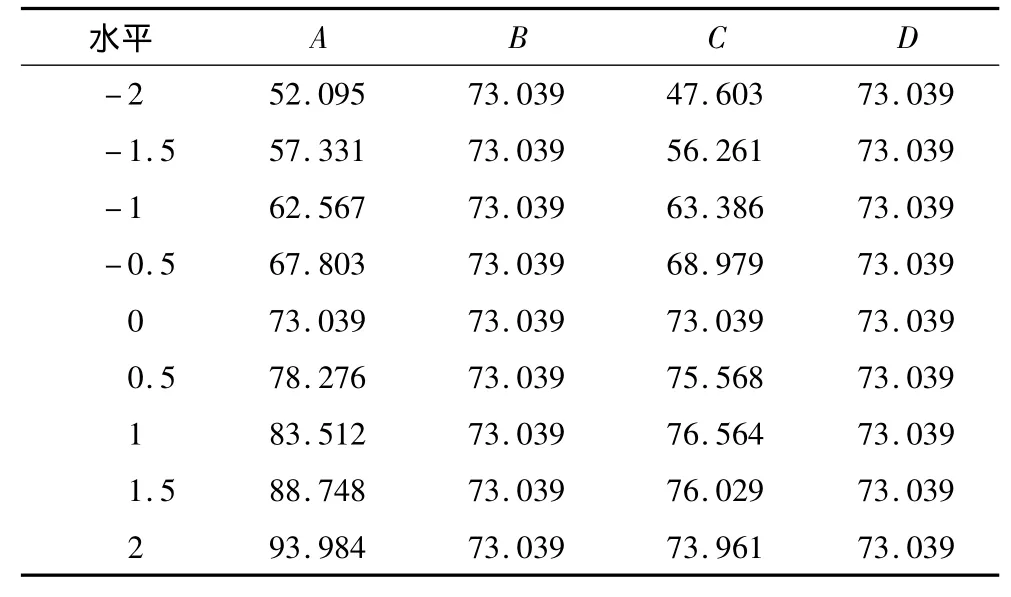
表4 单因素效应分析

图3 单因素与后萃率的关系
由表4及图3可以看出,随着时间(B)以及温度(D)的升高,蛋白质的后萃率几乎没有变化,即时间与温度对试验结果影响不显著,而pH(A)以及KCl浓度(C)的变化会引起后萃率显著的变化。
在pH为5~9范围内(试验水平为-2~2),随着pH的升高,后萃率逐渐上升。后萃过程相当于水萃取过程,与蛋白质在水中的溶解度有关。AOT与SDS都是阴离子表面活性剂,极性头朝内使反胶束内层带负电荷,随着pH逐渐升高,蛋白质分子带负电荷的密度逐渐增加,与反胶束之间的静电斥力逐渐增大,使溶进“水池”中的蛋白质逐渐反向萃取到水相中,后萃率逐渐增大。
在离子浓度为0~2 mol/L范围内(试验水平为-2~2),随着离子浓度的升高,后萃率先升高后降低。当离子浓度升高时,反胶束内表面的双电子层变薄,一方面减弱了表面活性剂极性头之间的排斥作用,使反胶束尺寸变小,迫使蛋白质溶出,另一方面又使静电引力减小,蛋白质在“水池”中的溶解度下降,但当离子浓度过高,会导致蛋白质发生盐析作用,有可能引起蛋白质的变性从而与表面活性剂发生聚集,使得后萃率降低。离子浓度过高也给后续蛋白质的精制带来困难[8]。
3.5 试验因子间交互效应分析
根据表3中对数学模型的方差分析可知,交互项偏回归系数AC项达到了极显著的水平,其余均未达到显著水平,因此只对温度和KCl浓度之间的交互作用进行讨论。对其作图见图4。
由图4可以看出,当pH处于较低水平时,随着KCl浓度的升高后萃率逐渐升高,当pH处于零水平时,随着KCl浓度的升高后萃率先升高后降低,当pH处于较高水平时,随着KCl浓度的升高后萃率逐渐下降,pH与KCl浓度同时取较高或同时取较低都会产生一个较低的后萃率。

图4 KCl浓度与pH对后萃率影响的响应面图
3.6 工艺优化及验证
由于试验过程中,不仅单因素对试验结果有影响,而且还存在着交互作用,因此很难找出最优条件,同时由于四元二次方程不存在极值问题,因此也无法从回归模型中得到最佳配比。考虑到不同因素对花生蛋白的影响作用,采用频率分析的方法对回归模型进行分析,后萃率大于68.40%的375个方案中,各变量取值的频率分布见表5。

表5 各变量取值的频率分布表
由表5可知,在95%的置信区间优化方案为:pH为 7.263 ~7.537,时间为 28.57 ~31.43 min,KCl浓度1.101 ~1.232 5 mol/L,温度34.285 ~35.715 ℃。考虑到实际可操作性,将方案调整为:pH 7.5,时间30 min,KCl浓度 1.1 mol/L,温度35 ℃。对此方案进行试验验证,平行试验3次,得到后萃率平均值为79.03%,与优化试验的理论值78.65%比较接近。
4 结论
4.1 采用AOT-SDS/异辛烷-正辛醇复合反胶束体系实现了对花生蛋白的后萃,采用二次通用旋转组合设计实现了工艺的优化,得到二次回归模型:Y=73.039 49+10.472 14A+6.589 34C -3.064 35C2-8.171 01AC。对回归模型分析可知,pH和KCl以及二者的交互作用对结果影响显著,时间以及温度影响不显著。
4.2 通过频率分析以及统计寻优得到在95%置信区间后萃率大于67.5%的优化方案为pH为7.263~7.537,时间 28.57 ~ 31.43 min,KCl浓度 1.101 ~1.233 mol/L,温度34.285 ~35.715 ℃。为贴近实际操作将方案调整为 pH 7.5,时间 30 min,KCl浓度1.1 mol/L,温度35 ℃,后萃率达79.03%,与理论值78.65%比较接近。
[1]刘传富,张兆静.花生蛋白及其在食品中的应用[J].中国食物与营养,2005(1):24-25
[2]Dong Wei Li,Zu De Qi,Xin Liang Ding,et al.Photophysics of three delocalized lipophilic cations in reverse micelles:A fluorescence spectroscopy study[J].Journal of Luminescence,2013,134:830 -836
[3]Bidyut K P,Rajib K M.Water solubilization capacity of mixed reverse micelles:effect of surfactant component,the nature of the oil and electrolyte concentration[J].Journal of Colloid and Interface Science,2005,288(1):261 -279
[4]Mitra R K,Paul B K.Investigation on percolation in conductance of mixed reverse micelles[J].Journal of Colloids and Surfaces,2005,252(2 -3):243 -259
[5]刘海远,布冠好,陈复生,等.超声波辅助CTAB反胶束萃取大豆蛋白的研究[J]农业机械,2011(14):68-71
[6]郭珍,陈复生,方志锋.复合反胶束萃取花生蛋白的工艺优化[J].食品与机械,2013,29(2):1 -7
[7]唐启义,冯明光.实用统计分析及其数据处理系统[M].北京:科学出版社,2002:159-163
[8]任海伟,陈晓沛,邢超红,等.反胶束法提取红芸豆蛋白后萃工艺的优化[J].农业机械,2012(30):65-68.
