NO/cGMP信号通路在鞘内吗啡预处理减轻大鼠心肌缺血/再灌注损伤中的作用
2014-05-21蒋玲玲何淑芳
胡 军,张 野,陆 姚,蒋玲玲,何淑芳
(安徽医科大学1.第二附属医院麻醉科,安徽合肥 230601;2.第三附属医院麻醉科,安徽合肥 230061)
心肌缺血/再灌注损伤是临床心脏病学的重要难题,缺血的心肌在循环开放后发生比闭塞时更为严重的急性损伤;而鞘内吗啡处理可以对大鼠在体心肌缺血/再灌注损伤发挥保护作用[1-2],因此鞘内吗啡处理可作为心肌保护的一种策略,具有实践性意义。但鞘内吗啡预处理是如何介导心肌保护作用的机制尚未明确。有报道[3]证实中枢脑室内给予吗啡的抗缺血/再灌注损伤的心肌保护作用可能与其镇痛作用和介导降钙素基因相关肽(calcitonin gene-related peptide,CGRP)的释放有关。同时一氧化氮(nitric oxide,NO)作为中枢内重要的神经递质,在中枢内参与疼痛、炎症等多种伤害性刺激信号的调制[4]。心肌缺血/再灌注作为伤害性刺激,可引起中枢内伤害性感觉神经元兴奋并介导神经递质的释放[5],实验证明吗啡等阿片受体激动剂在中枢可通过NO/cGMP信号通路发挥抗伤害性刺激作用[6]。因而本研究的目的在于探讨NO/cGMP信号通路及其下游的蛋白激酶G(protein kinase G,PKG)是否参与鞘内吗啡预处理抗心肌缺血/再灌注损伤的保护作用。
1 材料与方法
1.1 药品和试剂 盐酸吗啡注射液1 ml:10 mg(东北制药集团沈阳第一制药有限公司,批号:121206-2)。Nω-Nitro-L-arginine methyl ester hydrochloride(非选择性的NO合成酶阻断剂,L-NAME)、1H-[1,2,4]Oxadiazolo[4,3-a]quinoxalin-1-one(鸟苷酸环化酶阻断剂,ODQ)、KT5823(PKG阻断剂)、以上3种阻断剂均购自Sigma公司。氯化三苯基四氮唑(TTC,Sigma公司,浓度为 100 mmol·L-1,磷酸盐缓冲液pH 7.4溶解)。
1.2 动物模型
1.2.1 鞘内置管动物模型的建立[1]本研究所用动物及实验方法经安徽医科大学伦理委员会批准。健康成年♂SD大鼠,清洁级,体质量(300±50)g,由安徽医科大学实验动物中心提供,合格证号:SCXK(皖)2011-002。3% 戊巴比妥钠60 mg·kg-1,ip。参照文献[1]方法,沿脊柱在颈背部切开皮肤2 cm左右,游离肌肉组织,使寰枕膜显露,用12G注射器针头将寰枕膜轻刺小孔,见脑脊液从小孔流出,将PE-10导管从刺孔向尾端缓慢置入蛛网膜下腔4 cm,缝合伤口,固定导管。术后肌注青霉素10万单位,单独饲养3 d,常规饮食。有感觉或运动障碍的大鼠弃用。
1.2.2 心脏缺血/再灌注损伤模型的建立[1]鞘内置管成功的大鼠,30%戊巴比妥钠60 mg·kg-1,ip。麻醉后行气管切开、插管后接动物呼吸机(ALCV9型,上海奥尔科特生物科技有限公司)以室内空气通气,潮气量20~30 ml·kg-1,频率70~80次/分。右侧股动脉切开置管,接压力传感器和生物机能系统(BL-420S型,成都泰盟生物科技有限公司),记录心电图(electrocardiogram,ECG)、平均动脉压(mean arterial blood pressure,MAP)、心率(heart rate,HR);右侧股静脉切开置管补液。在左侧胸廓4-5肋间沿锁骨中线切开皮肤约2 cm,并置开胸器打开胸腔,游离心包腔,轻压胸廓右侧,轻推出心脏;用6-0 Prolene线(强生公司,美国)在肺动脉圆锥与左心耳之间结扎左冠状动脉后把心脏放回胸腔;再用Prolene线作一线结,收紧线结即可造成左冠状动脉阻塞。心脏原位经15 min稳定,收紧线结以扎闭左冠状动脉可使心肌缺血,缺血心肌表现为:冠状动脉支配的区域发绀,血压下降,ECG呈心肌缺血改变并可出现心律失常;松开线结后心肌实现再灌注,ECG在再灌注即刻可出现心律失常。
1.3 实验方法 成功建立鞘内置管模型的54只大鼠,随机分为9组,每组6只:假手术组(SHAM组),大鼠在开胸后行冠状动脉左前降支下穿线,但不结扎,也不给予其他处理;对照组(CON组),在缺血/再灌注前30 min内,经鞘内导管微量泵恒速泵入生理盐水10μl 5 min,间断5 min,重复3次;鞘内吗啡预处理(ITMP组),在缺血/再灌注前30 min内,经鞘内导管微量泵恒速泵入吗啡(3μg·kg-1)[1]10μl 5 min,间断5 min,重复3次;L-NAME+ITMP组、ODQ+ITMP组、KT5823+ITMP组分别在鞘内吗啡预处理前10 min鞘内注射3种信号蛋白阻断剂L-NAME(30 nmol)[7]、ODQ(11 nmol)、KT5823(20 pmol)[8]10μl;L-NAME组、ODQ组、KT5823组分别在缺血/再灌注前40 min鞘内注射3种信号蛋白阻断剂作为阻断剂自身对照组。随后除SHAM组,其余各组所有大鼠均经历30 min缺血,120 min再灌注(Fig 1)。
1.4 观察指标
1.4.1 血流动力学指标测定 观察各组手术完成心脏稳定15 min后(基础值)、预处理完成后即刻、缺血末和再灌注末平均动脉压(MAP)和心率(HR),计算平均动脉压和心率乘积(rate pressure product,RPP)。

Fig 1 Experiment protocol
1.4.2 心肌梗死面积测定 再灌注120 min后,取出心脏,剔除非心脏组织,置Langendorff K-H液灌注5 min(37℃),冲洗出心肌内残留血液,重新结扎左冠状动脉,并从主动脉注入0.25%Evan蓝溶液,后置-80℃冰箱速冻。将冰冻的心脏放入心肌切槽,由心尖到结扎冠脉的线结处平切2 mm厚的心肌5~6片。置1%TTC溶液中,37℃(pH 7.4)温孵15 min,取出置10%福尔马林室温固定12 h。染色后缺血危险区呈红色,梗死区为白色,用图像分析软件(Sigma Scan program 4)计算左心室体积(left ventricle,LV)、右心室体积(right ventricle,RV)、缺血危险区体积(area at risk,AAR)和梗死区体积(infarct size,IS),再算出 LV+RV,用 IS/AAR表示心肌梗死面积(Fig 2)。

Fig 2 Myocardial morphometric mapmorphometric map by TTC stainning.AAR:area of risk,IS:Infarct size
1.5 统计学处理 采用SPSS 10.0统计学软件进行分析。计量资料以¯x±s表示,对于血流动力学数据采用重复测量资料的方差分析;其他计量资料采用单因素方差分析,两两比较采用SNK分析。
2 结果
Tab 1 Hemodynamic parameters(±s,n=6)
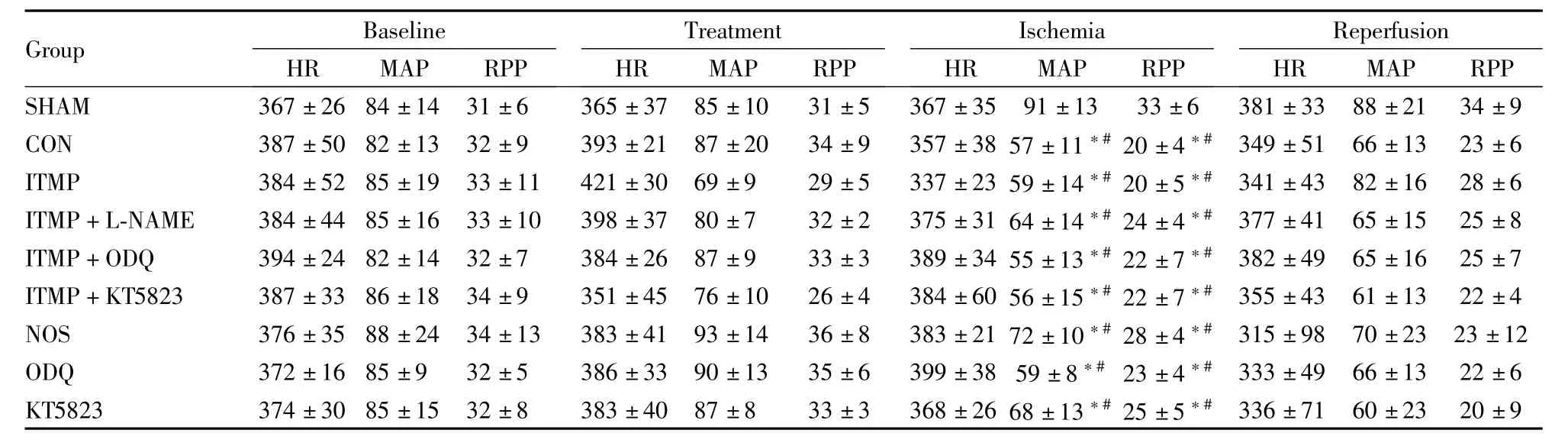
Tab 1 Hemodynamic parameters(±s,n=6)
HR:heart rate(bpm);MAP:mean arterial blood pressure(mmHg);RPP:rate pressure product(mmHg/min/1000).*P<0.05 vs SHAM group;#P<0.05 vs Baseline;1 mmHg=0.133 kPa
Group Baseline Treatment Ischemia Reperfusion HR MAP RPP SHAM 367±26 84±14 31±6 365±37 85±10 31±5 367±3 HR MAP RPP HR MAP RPP HR MAP RPP 336±71 60±23 20±9 5 91±13 33±6 381±33 88±21 34±9 CON 387±50 82±13 32±9 393±21 87±20 34±9 357±38 57±11*#20±4*#349±51 66±13 23±6 ITMP 384±52 85±19 33±11 421±30 69±9 29±5 337±23 59±14*#20±5*#341±43 82±16 28±6 ITMP+L-NAME 384±44 85±16 33±10 398±37 80±7 32±2 375±31 64±14*#24±4*#377±41 65±15 25±8 ITMP+ODQ 394±24 82±14 32±7 384±26 87±9 33±3 389±34 55±13*#22±7*#382±49 65±16 25±7 ITMP+KT5823 387±33 86±18 34±9 351±45 76±10 26±4 384±60 56±15*#22±7*#355±43 61±13 22±4 NOS 376±35 88±24 34±13 383±41 93±14 36±8 383±21 72±10*#28±4*#315±98 70±23 23±12 ODQ 372±16 85±9 32±5 386±33 90±13 35±6 399±38 59±8*#23±4*#333±49 66±13 22±6 KT5823 374±30 85±15 32±8 383±40 87±8 33±3 368±26 68±13*#25±5*#
2.1 血流动力学指标 与SHAM组比较各组MAP和RPP在缺血末有降低 (P<0.05),与基础值比较,除SHAM组外,其余各组MAP和RPP在缺血末有降低(P<0.05)(Tab 1)。
2.2 心脏病理指标改变 各组左心室体积(LV)与右心室体积(RV)之和、AAR体积差异无显著性(P>0.05)。与CON组相比,ITMP组的IS体积和IS/AAR均明显降低 (P<0.01);与 ITMP组比较,LNAME+ITMP组、ODQ+ITMP组、KT5823+ITMP组的IS体积和IS/AAR均明显升高(P<0.01),表明NO/cGMP信号通路以及PKG的阻断剂可消除鞘内吗啡预处理对心肌缺血/再灌注损伤的保护作用(Tab 2)。
Tab 2 Myocardial morphometric analysis±s,n=6)
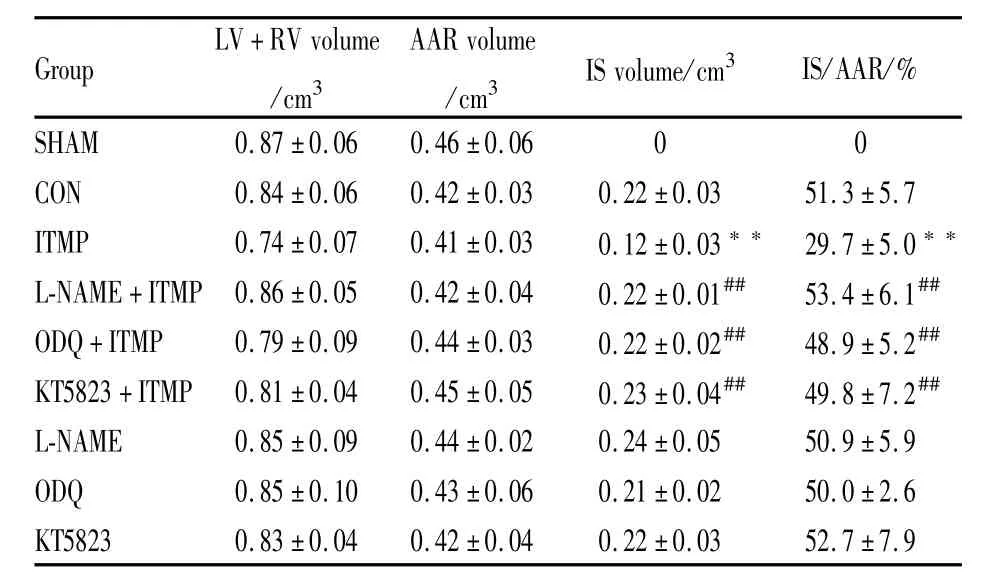
Tab 2 Myocardial morphometric analysis±s,n=6)
LV:left ventricle;RV:right ventricle;AAR:area at risk;IS:infarct size.**P<0.01 vs CONgroup;##P<0.01 vs ITMPgroup
Group LV+RVvolume/cm3 AARvolume/cm3 ISvolume/cm3IS/AAR/%.9 SHAM 0.87±0.06 0.46±0.06 0 0 CON 0.84±0.06 0.42±0.03 0.22±0.03 51.3±5.7 ITMP 0.74±0.07 0.41±0.03 0.12±0.03**29.7±5.0**L-NAME+ITMP 0.86±0.05 0.42±0.04 0.22±0.01## 53.4±6.1##ODQ+ITMP 0.79±0.09 0.44±0.03 0.22±0.02## 48.9±5.2##KT5823+ITMP 0.81±0.04 0.45±0.05 0.23±0.04## 49.8±7.2##L-NAME 0.85±0.09 0.44±0.02 0.24±0.05 50.9±5.9 ODQ 0.85±0.10 0.43±0.06 0.21±0.02 50.0±2.6 KT5823 0.83±0.04 0.42±0.04 0.22±0.03 52.7±7
3 讨论
本研究发现鞘内吗啡预处理可以减轻心肌缺血/再灌注损伤,并且脊髓内神经元的NO/cGMP信号通路,及其下游的PKG可能参与介导这种心肌保护作用。
脊髓内伤害性感觉神经元作为中枢神经系统的一部分,不但接受外周伤害性刺激的传入,还可以通过其末梢释放神经肽调节外周血管舒张[9]。在我们的前期研究中发现中枢脑室内吗啡预处理,就可以介导具有强烈血管舒张作用的神经肽-降钙素基因相关肽(CGRP)在外周释放[10]。缺血、疼痛以及炎症等作为伤害性刺激可以通过心脏感觉神经(Aδ和C纤维)引起脊髓内伤害性感觉元的兴奋,并导致脊髓内的P物质表达增加[5]。而NO作为中枢内重要的神经递质,对伤害性信号的感知有双重调节作用[4]。很多研究都证实NO作为阿片受体激动剂的重要中间介质在中枢和外周调节其抗伤害作用[7,11-12]。吗啡可以刺激3种类型的NO合酶在体内的合成,升高NO合酶mRNA和神经性NO合成酶 (neuronal nitric oxide synthase,nNOS)的表达[6]。NO通过作用于鸟苷酸环化酶(GC)诱导GTP的环化生成cGMP[4]。同时NO/cGMP也介导其他阿片受体激动剂的抗伤害镇痛作用[13];综合起来看,NO/cGMP可能是阿片药物发挥抗伤害镇痛作用的基础信号传导通路。在我们的研究里通过鞘内注射NO合成酶阻断剂L-NAME或者鸟苷酸环化酶抑制剂ODQ都可以阻断吗啡的心肌保护效应。
NO/cGMP的信号转导机制可能与激活蛋白激酶G(PKG)开放细胞膜ATP敏感性K+通道有关,PKG作为cGMP下游信号蛋白可以活化ATP敏感性K+通道[14]。此外也有研究显示出ATP敏感性K+通道的激活剂可以增强阿片药物的抗伤害镇痛作用[15]。据此我们推断吗啡可能是通过NO/cGMP信号通路,激活其下游PKG调节脊髓伤害性刺激感受神经元的ATP敏感性K+通道,形成K+外流,使细胞膜超极化,提高神经元兴奋阈值,增强其对缺血等伤害性刺激的耐受而减轻心肌缺血/再灌注损伤,诱导心肌保护效应。在实验中通过鞘内注射PKG的阻断剂KT5823,阻断鞘内吗啡预处理的心肌保护作用。同时也有研究证明NO可以通过胸段脊髓交感节前神经元对调节心血管活动[16],但是在我们的研究中,在各实验组中未能发现鞘内给予吗啡或NO/cGMP信号通路相关阻断剂对血流动力学参数有影响,这可能是其药物处理的方式与我们的研究不同而致。
我们的研究发现鞘内吗啡预处理对在体大鼠心肌缺血/再灌注损伤的保护作用可能与NO/cGMP信号通路以及其下游的PKG有关。
参考文献:
[1] 李 锐,张 野,张 健,等.中枢阿片受体介导鞘内注射吗啡对大鼠缺血后心肌的保护作用 [J].中国药理学通报,2008,24(5):676-80.
[1] Li R,Zhang Y,Zhang J,et al.Cardioprotective effect of intrathecal morphine on ischemia-reperfusion injury heart mediated by opioid receptors in central nervous system [J].Chin Pharmacol Bull,2008,24(5):676-80.
[2] 蒋玲玲,张 野,翁立军,等.中枢吗啡后处理对在体大鼠缺血后心肌的保护作用[J].中国药理学通报,2009,25(2):177-81.
[2] Jiang L L,Zhang Y,Weng L J,et al.Cardioprotective effects of intracerebroventricular morphine postconditioning against ischemiareperfusion injury in rat heart[J].Chin Pharmacol Bull,2009,25(2):177-81.
[3] Zhang Y,Irwin M G,Lu Y,et al.Intracerebroventricular administration of morphine confers remote cardioprotection-role of opioid receptors and calmodulin[J].Eur JPharmacol,2011,656(1-3):74-80.
[4] Cury Y,Picolo G,Gutierrez V P,et al.Pain and analgesia:The dual effect of nitric oxide in the nociceptive system[J].Nitric Oxide,2011,25(3):243-54.
[5] Steagall R J,Sipe A L,Williams CA,et al.Substance Prelease in response to cardiac ischemia from rat thoracic spinal dorsal horn is mediated by TRPV1[J].Neuroscience,2012,214:106-19.
[6] Toda N,Kishioka S,Hatano Y,et al.Modulation of opioid actions by nitric oxide signaling[J].Anesthesiology,2009,110(1):166-81.
[7] Brock SC,Tonussi C R.Intrathecally injected morphine inhibits inflammatory paw edema:the involvement of nitric oxide and cyclic-guanosine monophosphate[J].Anesth Analg,2008,106(3):965-71,table of contents.
[8] Morita K,Kitayama T,Morioka N,et al.Glycinergic mediation of tactile allodynia induced by platelet-activating factor(PAF)through glutamate-NO-cyclic GMPsignalling in spinal cord in mice[J].Pain,2008,138(3):525-36.
[9] Hollis M,Wang D H.Transient receptor potential vanilloid in blood pressure regulation[J].Curr Opin Nephrol Hypertens,2013,22(2):170-6.
[10]陆 姚,范礼斌,张 野,等.中枢吗啡预处理对心脏缺血后大鼠海马CaM、血浆CGRP以及下丘脑室旁核和心肌P物质表达的影响 [J].中国药理学通报,2009,25(8):1072-7.
[10]Lu Y,Fan L B,Zhang Y,et al.Effects of intracerebroventricular morphine preconditioning on expression of calmodulin in hippocampus,calcitonin gene related peptide in plasma,substance Pin hypothalamic paraventricular nucleus and myocardium in myocardial postischemia injury rats[J].Chin Pharmacol Bull,2009,25(8):1072-7.
[11]Cunha T M,Roman-Campos D,Lotufo CM,et al.Morphine peripheral analgesia depends on activation of the PI3Kgamma/AKT/nNOS/NO/KATP signaling pathway[J].Proc Natl Acad Sci USA,2010,107(9):4442-7
[12]Schmidtko A,Tegeder I,Geisslinger G.No NO,no pain?The role of nitric oxide and cGMP in spinal pain processing[J].Trends Neurosci,2009,32(6):339-46.
[13]Hervera A,Leanez S,Negrete R,et al.The peripheral administration of a nitric oxide donor potentiates the local antinociceptive effects of a DOR agonist during chronic inflammatory pain in mice[J].Naunyn Schmiedebergs Arch Pharmacol,2009,380(4):345-52.
[14]Kawano T,Zoga V,Kimura M,et al.Nitric oxide activates ATP-sensitive potassium channels in mammalian sensory neurons:action by direct S-nitrosylation[J].Mol Pain,2009,14(3):5-12.
[15]Alves D P,Soares A C,Francischi JN,et al.Additive antinociceptive effect of the combination of diazoxide,an activator of ATP-sensitive K+channels,and sodium nitroprusside and dibutyrylcGMP[J].Eur J Pharmacol,2004,489(1-2):59-65.
[16]Sabino JP,Bombarda G,da Silva CA,et al.Role of the spinal cord NO/cGMP pathway in the control of arterial pressure and heart rate[J].Pflugers Arch,2011,461(1):23-8.
