蛋白酶体抑制剂YSY01A不依赖NF-κB通路抑制乳腺癌细胞增殖及诱导凋亡研究
2014-05-19冉福香葛泽梅李润涛崔景荣
张 梅,袁 霞,徐 波,冉福香,吴 军,葛泽梅,李润涛,崔景荣
(北京大学药学院1.天然药物及仿生药物国家重点实验室、2.化学生物学系,北京 100191;3.新疆石河子大学药学院药理系,新疆石河子 832000)
PS341(硼替佐米,万珂)于2003年被美国FDA批准用于多发性骨髓瘤和淋巴瘤的治疗[1],该蛋白酶体抑制剂通过抑制蛋白酶体中的 CT-L(β5/β5i)、PGPH(β1/β1i)和 T-L(β2i)位点[2]引起细胞周期阻滞和细胞凋亡而产生抗肿瘤作用[3],但同时也引起神经疾病等不良反应和耐药性[4]。基于PS341结构的启发,李润涛教授课题组合成了一系列新的三肽硼酸类化合物,经过体内外药效学筛选发现 YSY01A[N-(2-Pyrazinecarbonyl)-L-leucine-L-(2-naphthyl)-alanine-L-leucine boronic acid](Fig 1)具有很强的杀伤肿瘤细胞及抗乳腺癌的作用。本文研究了YSY01A对乳腺癌增殖的影响,并以MCF-7细胞株为研究对象,探讨了YSY01A的抗癌机制和蛋白酶体靶向作用。
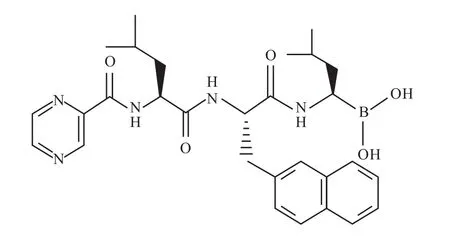
Fig 1 Structure of YSY01A
1 材料与方法
1.1 材料 YSY01A和PS341由北京大学药学院合成,纯度均在99%以上。溶于DMSO中,配制成1×10-2mol·L-1浓度,-20℃冻存。Suc-LLVYAMC、Boc-LRR-AMC、Z-LLE-AMC、Z-RR-AMC和Me4BodipyFL-Ahx3Leu3VS均为 Boston Biochem公司。多克隆抗 体 ubiquitin、NF-κB,IκBα,XIAP、Bax、puma、endonuclease G和单克隆抗体 PARP、BclxL、GAPDH为 CST公司。Phospho-IκBα(P-IκBα)为Santa Cruz公司。野生型p53(wt-p53)为Bioss公司。Annexin V-FITC凋亡检测试剂盒、JC-1线粒体膜电位检测试剂盒购自碧云天生物研究所。
1.2 细胞培养 人乳腺癌细胞 MCF-7、Bcap37、MDA-MB-435S细胞株购自中科院上海生命科学院细胞资源中心。MCF-7和MDA-MB-435S用含10%的血清和1%的双抗 DMEM培养液在37℃、5%CO2的培养箱中培养,而 Bcap37细胞则用 RPMI 1640培养液。
1.3 26S蛋白酶体提取 收集MCF-7细胞,PBS洗涤2次,用裂解液(50 mmol·L-1Tris-HCl,pH 7.5,1 mmol·L-1DTT,5 mmol·L-1MgCl2,250 mmol·L-1蔗糖,2 mmol·L-1ATP)冰上裂解细胞30 min,低温(4℃)10 000 r·min-1离心 15 min后,将上清4℃,15 000 r·min-1离心 1 h,去沉淀,用 Bradford法测定蛋白含量。
1.4 26S蛋白酶体的活性检测 蛋白酶体活性常用荧光底物法检测。Suc-LLVY-AMC、Boc-LRRAMC、Z-LLE-AMC分别为CT-L、T-L、PGPH的特异性荧光底物。体外活性检测时,从MCF-7细胞内提取26S蛋白酶体,不同浓度的YSY01A(或PS341)、26S蛋白酶体(12.5μg)和 50μmol·L-1的特异性荧光底物在缓冲液(50 mmol·L-1Tris-HCl,pH 7.5,5 mmol·L-1MgCl2,0.5 mmol·L-1ATP,1 mmol·L-1DTT,0.5 g·L-1BSA)中 37℃孵育 1 h。用多功能酶标仪检测 (λex=390 nm,λem =440 nm)。检测体内活性时,用 37.5 nmol·L-1的YSY01A处理细胞1、2、4 h后,提取26S蛋白酶体。按照上述检测蛋白酶活性的方法检测荧光强度。
1.5 蛋白酶体活性谱分析 按照文献[5-6]报道检测细胞内蛋白酶体活性谱。25 nmol·L-1的YSY01A作用于 MCF-7细胞1、2、4、8、12、24 h。PBS洗涤细胞2次,收集细胞后,按照“1.3”提取细胞内26S蛋白酶体并定量。在竞争试验中,将26S与Me4BodipyFL-Ahx3Leu3VS(选择性蛋白酶体荧光探针)(5μmol·L-1)在 37℃共孵育 1 h,蛋白变性后,用质量分数12.5%SDS-PAGE分离β催化亚基。在凝胶成像仪上观察胶内带荧光蛋白条带。
1.6 蛋白免疫印迹分析 MCF-7细胞接种于培养瓶内,用25 nmol·L-1的YSY01A分别处理细胞6、12、18、24、36 h,用 PBS洗涤细胞2次,收集细胞后,用全蛋白裂解液4℃裂解细胞,12 000 r·min-1离心,取上清,BCA法测定蛋白含量,加入双蒸水和loading buffer配制成相同浓度的蛋白样品,100℃煮沸5 min变性。-80℃储存。等量的蛋白样品进行质量分数为10%SDS-PAGE分离,将蛋白转移到NC膜上,封闭1 h,一抗(ubiquitin、PARP、NF-κB、IκBα、P-IκBα、Bax、Bcl-xL、XIAP、wt-p53、puma、endonuclease G、GAPDH)4℃孵育过夜。TBST漂洗,二抗(1∶10 000)孵育 1 h,TBST漂洗,用 ECL染膜 1 min,暗室中曝光于X胶片上。
1.7 细胞增殖测定 1×104个MCF-7细胞接种于96孔板小孔内,YSY01A和 PS341(12.5、25、50、75、100、200 nmol·L-1)分别处理细胞 48 h。另外接种相同数量的细胞于96孔板小孔内,用YSY01A(12.5、25、50、75、100、200 nmol·L-1)处理肿瘤细胞(MCF-7或MDA-MB-435S或Bcap37细胞)48 h。采用SRB法检测细胞存活。
1.8 细胞凋亡检测 1×106个MCF-7细胞接种于大培养瓶内,用150 nmol·L-1的YSY01A处理细胞8、12、24 h后,PBS洗涤细胞,收集细胞。用 Blocking buffer悬浮细胞,AnnexinV-FITC与细胞室温共孵育15 min,流式细胞仪检测前5 min加入PI,然后检测细胞状态。
1.9 线粒体膜电位(MMP)测定 1×106个MCF-7细胞接种于大培养瓶内,用 YSY01A(12.5、25、50、75、100、200 nmol·L-1)处理细胞8 h,用无血清培养基洗涤细胞,并收集细胞。10 mmol·L-1的JC-1(用无血清培养基作为稀释液)与细胞在37℃培养箱内孵育30 min,PBS漂洗后,流式细胞仪检测。1.10 数据分析 实验数据用¯x±s表示,用SAS软件处理数据,方差分析考察统计学意义。

Fig 2 Inhibitory effects of YSY01A on proteasome activity
2 结果
2.1 蛋白酶体抑制作用 细胞外蛋白酶体活性结果(Fig 2A)可看出YSY01A抑制CT-L、T-L和PGPH的活性,且对CT-L活性的抑制作用最强。实验测得的YSY01A对 CT-L、T-L和 PGPH的 IC50值分别为(138.77±7.28)、(1328.94±146.02)、(716.39±72.31)nmol·L-1,其中 YSY01A抑制 T-L的作用比PS341强4倍,而对另外两个催化位点的作用,YSY01A弱1~2倍。且YSY01A抑制MCF-7细胞内的蛋白酶体活性(Fig 2B),其抑制特点同细胞外结果一致。通过分析蛋白酶体活性谱(Fig 2C),发现 YSY01A能与 β5/β5i(CT-L活性)、β2/β2i(T-L活性)、β1/β1i(PGPH活性)结合,其结合能力和抑制作用一致。蛋白免疫印迹结果显示(Fig 2D),YSY01A能使细胞内泛素蛋白表达增加,表明该化合物抑制了蛋白酶体后使得泛素蛋白降解减少,从而出现堆积。这些结果都证实YSY01A是蛋白酶体抑制剂。
2.2 肿瘤细胞增殖抑制作用 虽然YSY01A是PS341同类物,但由于对蛋白酶体催化亚基选择性不同,所以该化合物的抗肿瘤活性被检测。12.5~200 nmol·L-1的 YSY01A和PS341均有明显抑制MCF-7细胞增殖作用(Fig 3A),而且它们抑制细胞的 IC50分别为(42.5±4.5)和(57.1±0.8)nmol·L-1。另外YSY01A也不同程度地抑制另外两种乳腺癌细胞增殖(Fig 3B),其对 MDA-MB-435S和Bcap37细胞的 IC50分别为(71.5±5.2)、(878.6±18.2)nmol·L-1。由结果可知,MCF-7细胞不仅对YSY01A最敏感,而且在小于100 nmol·L-1时比对PS341敏感性强。

Fig 3 Proliferative inhibitory effects of YSY01A on cancer cells
2.3 诱导细胞凋亡 YSY01A(150 nmol·L-1)作用MCF-7细胞8、12、24 h后,均出现细胞凋亡(Fig 4A)。结果显示,YSY01A能引起细胞早期和晚期凋亡,细胞凋亡率分别为14.83%±1.30%、18.49%±2.71%、27.59%±1.39%,与对照组比较,差异均有显著性(P<0.05)。50 nmol·L-1的 YSY01A作用细胞12 h时(Fig 4B),全长PARP蛋白表达减少,而断裂的PARP部分增加,表明细胞出现凋亡,且随时间延长,细胞凋亡明显增加。
2.4 NF-κB通路 大多数蛋白酶体抑制剂的抗肿瘤作用都与NF-κB通路有密切关系。YSY01A具有抑制蛋白酶体的活性,考察了YSY01A对NF-κB系统的影响,结果如图(Fig 4C),50 nmol·L-1的YSY01A作用细胞2~24 h,P-IκBα呈现明显的时间依赖性增加,而I-κBα则呈现时间依赖性减少,但细胞内NF-κB没有明显变化。

Fig 4 Effects of YSY01A on apoptosis and NF-κB pathway
2.5 线粒体膜电位降低 线粒体是细胞凋亡的核心部位,不管是外源性还是内源性的凋亡最终都经线粒体途径诱导细胞凋亡,因此YSY01A对线粒体膜电位的影响首先被检测(Fig 5A)。结果显示,12.5~200 nmol·L-1的 YSY01A能使 MCF-7细胞内JC-1单体增加,表明线粒体膜电位下降;与对照组相比,膜电位下降的细胞数增加了7.5% ~22.5%,而且呈浓度依赖性。检测了线粒体相关蛋白的表达(Fig 5B),结果显示,随着YSY01A浓度的升高,MCF-7细胞内的Bax蛋白表达增加,Bcl-xL蛋白表达减少,而两者的比值明显增大。凋亡抑制分子XIAP表达没有明显变化,但wt-p53和其调节的puma蛋白表达明显增加。

Fig 5 Effects of YSY01A on mitochondrial pathway
3 讨论
蛋白酶体抑制剂已经成为重要的抗肿瘤药。虽然PS341抗瘤谱广,抑制肿瘤生长作用强,但因其严重的不良反应使得该药物在肿瘤治疗方面受到限制。因此发现新蛋白酶体抑制剂成为抗肿瘤研究热点之一。
本研究选用3种乳腺癌细胞,通过考察YSY01A对细胞增殖抑制的作用,发现该化合物在纳摩水平就能明显抑制MCF-7细胞的增殖。因此本研究以MCF-7细胞为模型,研究了YSY01A的抗癌机制及对蛋白酶体活性的影响。研究结果表明YSY01A能抑制MCF-7细胞中蛋白酶体的3个催化亚基,而且对CT-L的抑制作用最强,其次是PGPH,虽然对T-L的作用较弱,但比PS341作用强4倍。通过蛋白酶体活性谱的研究,发现YSY01A能与β5、β5i、β1、β1i、β2和 β2i活性位点结合,而 PS341则阻碍 β5、β5i、β1、β1i和 β2i位点[2]。这些结果证明YSY01A对蛋白酶体的选择性与PS341不同。
蛋白酶体抑制剂的细胞毒性与抑制CT-L、T-L、PGPH活性有密切关系。一般蛋白酶体抑制剂抑制CT-L和T-L或PGPH就具有很强细胞毒作用,但如果3个活性位点都被抑制,使化合物的活性会进一步增加[7]。本实验结果也证明了这一点,YSY01A抑制MCF-7细胞增殖的作用比PS341的作用强;在MCF-7、Bcap37和 MDA-MB-435S 3种乳腺癌细胞中,YSY01A的抑制MCF-7细胞增殖作用最强。
细胞凋亡是细胞程序化死亡,主要包括外源性(死亡受体通路)和内源性凋亡途径(线粒体途径)。本研究证实YSY01A是通过线粒体途径诱导细胞凋亡。除了经典的凋亡途径外,还有其他一些细胞因子会调节细胞凋亡。Puma是被p53调节的线粒体膜蛋白,促进细胞色素C释放[8]。XIAP凋亡抑制蛋白是IAP家族中最强的凋亡抑制因子。当凋亡发生时,线粒体膜孔开放,Cytochrome C、Endonuclearse G和AIF从线粒体中释放到胞质内,Cytochrome C可以激活下游的Caspases蛋白,导致PARP断裂,损伤DNA诱导凋亡。Endonuclearse G则转入细胞核内促发DNA片段化[9]。本研究结果表明YSY01A能诱导细胞凋亡,通过抑制蛋白酶体活性,导致细胞内的wt-p53增加,并进一步激活线粒体膜上的puma蛋白,同时使Bcl-xL减少,而Bax增加,导致膜电位下降,膜孔开放,释放 Endonuclearse G,而且PARP被激活,最终引起凋亡。
细胞凋亡是一个非常复杂的过程,也受很多通路的调节。有研究证实PS341通过NF-κB诱导细胞凋亡,而且和自噬也有关系[10-12]。理论上讲,YSY01A抑制蛋白酶体活性,造成P-IκBα的表达增加,应该引起IκBα蛋白表达增加,但却使其表达下降,这可能跟 IκBα其他调节途径有关。然而YSY01A对乳腺癌细胞中NF-κB没有影响,该结果表明YSY01A可能不从NF-κB蛋白水平调节凋亡。另外,YSY01A是否激活死亡受体通路,是否引发自噬也需进一步研究探讨。
参考文献:
[1]Adams J.The development of proteasome inhibitors as anticancer drugs[J].Cancer Cell,2004,5:417-21.
[2]Britton M,Lucas M M,Downey SL,et al.Selective inhibitor of proteasome′s caspase-like sites sensitizes cells to specific inhibition of chymotrypsin-like sites[J].Chem Biol,2009,16:1278-89.
[3]Hutter G,Rieken M,Pastore A,et al.The proteasome inhibitor bortezomib targets cell cycle and apoptosis and acts synergistically in a sequence-dependent way with chemotherapeutic agents in mantle cell lymphoma[J].Ann Hematol,2012,91:847-56.
[4]Chen D,Frezza M,Schmitt S,et al.Bortezomib as the first proteasome inhibitor anticancer drug:current status and future perspectives[J].Current Cancer Drug Targets,2011,11:239-53.
[5]Clerc J,Li N,Krahn D,et al.The natural product hybrid of Syringolin A and Glidobactin A synergizes proteasome inhibition potency with subsite selectivity[J].Chem Commun(Camb),2011,47:385-7.
[6]Berkers CR,Verdoes M,Lichtman E,et al.Activity probe for in vivo profiling of the specificity of proteasome inhibitor bortezomib[J].Nature Methods,2005,2:357-62.
[7]Screen M,Britton M,Downey SL,et al.Nature of pharmacophore influences active site specificity of proteasome inhibitors[J].J Biol Chem,2010,285:40125-34.
[8]Bouillet P,Strasser A.BH3-only proteins-evolutionarily conserved proapoptotic Bcl-2 family members essential for initiating programmed cell death[J].J Cell Sci,2002,115:1567-74.
[9]Arnoult D,Gaume B,Karbowski M,et al.Mitochondrial release of AIF and EndoG requires caspase activation downstream of Bax/Bak-mediated permeabilization[J].The EMBO J,2003,22:4385-99.
[10]Yao F,Wang G,Wei W,et al.An autophagy inhibitor enhances the inhibition of cell proliferation induced by a proteasome inhibitor in MCF-7 cells[J].Mol Med Rep,2012,5:84-8.
[11]An J,Sun Y,Fisher M,et al.Maximal apoptosis of renal cell carcinoma by the proteasome inhibitor bortezomib is nuclear factorkappa B dependent[J].Mol Cancer Therap,2004,3:727-36.
[12]Gupta S V,Hertlein E,Lu Y,et al.The proteasome inhibitor carfilzomib functions independently of p53 to induce cytotoxicity and an atypical NF-kappa B response in chronic lymphocytic leukemia cells[J].Clin Cancer Res:an Official J Am Associat Cancer Res,2013,19:2406-19.
