穿膜肽引导核酸靶向性进入神经细胞的研究
2014-05-19高飞燕张苗苗徐兴然张恩齐付爱玲
高飞燕,张苗苗,徐兴然,吴 静,张恩齐,付爱玲
(西南大学药学院,重庆 400716)
血 -脑屏障(blood-brain barrier,BBB)能够阻挡几乎所有的大分子和超过98%的小分子药物的入脑转运,从而阻碍了中枢神经系统(central nervous system,CNS)疾病的治疗[1-2]。随着 CNS疾病发病率的不断增加,脑靶向给药系统正日益受到重视,寻找克服BBB或促进药物透过BBB并使之在脑内能达到有效浓度,已成为脑部疾病治疗的发展目标[3]。目前,基因治疗 CNS疾病具有广阔的研究、应用和开发前景。为了能够通透BBB,常规的基因治疗手段是通过立体定位手术将基因载体直接输送至脑内,这种手段存在较大弊端:扩散范围小、药物维持时间短、表达效率低,且不利于在人体上应用[4-5]。
基因治疗的关键在于所使用的载体。基因治疗的载体通常包括病毒[6]和非病毒载体,与病毒载体相比,非病毒载体具有明显优势。多肽作为一种非病毒载体,具有生物可降解性、生物相容性、低毒性、易于合成等优点,避免了使用病毒载体等传统方法的毒性和免疫原性,在治疗CNS疾病中展现出了良好的应用前景。目前已有文献报道利用一些富含精氨酸的多肽[7-9],如(RXRRBR)2XB和 PPTG,在体内成功介导了DNA、反义寡核苷酸或siRNA进入细胞并发挥作用。
我们实验组前期的研究表明,来源于狂犬病毒糖蛋白的一个新型衍生肽(RVG-derived peptide,RDP),可以携带外源蛋白质特异性的进入中枢神经细胞。我们通过基因工程技术制备出RDP-β-Gal融合蛋白,小鼠尾静脉注射该融合蛋白后,各组织切片结果显示,该融合蛋白分布于整个脑部,而在外周组织几乎没有分布[10]。由此,本研究对RDP作为载体介导DNA进入神经细胞的可行性进行探究。以增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)作为报告基因,用RDP包裹报告基因pEGFP,通过体外细胞转染实验以及体内动物实验来检测细胞、小鼠组织切片中报告基因产生的蛋白,探究RDP引导的DNA的靶向性及在体内、体外的表达情况。
1 材料与方法
1.1 试剂 RDP由上海强耀生物有限公司合成(纯度>99%)。pEGFP-N1质粒为本实验室保存。DMEM培养基、F-12培养基和胎牛血清均购自Hyclone公司。DNA转染试剂 Poly-Fecter购于北京唯尚立德生物有限公司。胰酶购于北京鼎国生物技术有限责任公司,神经母细胞瘤细胞(SH-SY5Y)为军事医学科学院毒物药物研究所馈赠;中国仓鼠卵巢细胞(Chinese hamster ovary,CHO)购于北京鼎国生物技术有限责任公司。其它试剂均为分析纯。
1.2 实验动物 SPF级的健康♂昆明种小鼠,体质量(20±2)g,由重庆医科大学动物中心提供。小鼠饲养以3~4只分笼,恒温恒湿,每天给予充足的水,自由饮食,12 h光照,12 h黑暗。
1.3 细胞培养 SH-SY5Y和CHO分别采用含10%胎牛血清的DMEM-H/F-12(1∶1)和DMEM-H培养液,在37℃,CO2体积分数为5%的培养箱中进行常规培养。
1.4 质粒p EGFP-N1制备及浓度测定 用去内毒素质粒提取盒提取质粒pEGFP,ddH2O稀释一定倍数后,紫外分光光度计分别测定DNA稀释液在260 nm及280 nm的吸收值。记录OD值,通过公式dsDNA=50×(OD260)×稀释倍数计算确定DNA浓度和纯度,以上浓度单位以mg·L-1表示。
1.5 多肽-DNA复合物的凝胶电泳阻滞测定 根据不同的质量比在室温下将pEGFP-N1和RDP混合,静置30 min,用0.8 mg·L-1琼脂糖凝胶电泳检测,探究包裹的最佳比例。DNA以 EB标记,电泳缓冲液为1×TAE,在电压为60 V的条件下电泳25 min,用Bio-Rad凝胶成像仪观察。
1.6 圆二色谱分析 利用圆二色谱来研究RDP与DNA相互作用后构象的变化,并对凝胶电泳检测出的最佳包裹比例进行确认。
1.7 体外细胞转染 转染前24 h,在96孔培养板内接种SH-SY5Y和CHO细胞,当孔内细胞生长达到60%~70%融合时开始转染。用PBS冲洗细胞2次,每孔中加入0.1 ml无血清、无抗生素的培养基。再取该适量培养基,稀释实验组(RDP/pEGFP)、对照组(转染试剂/pEGFP)和空白组(pEGFP)复合物至pEGFP浓度为0.2 mg·L-1,加入培养孔中,每组设3个平行孔。37℃,5%CO2培养箱中培养5 h后,移去介质,用PBS冲洗细胞2次,加入含有10%胎牛血清的培养基培养12~24 h,观察细胞瞬时表达。
1.8 动物体内组织检测 将RDP和pEGFP用ddH2O稀释后按最佳比例混合,室温静置30 min。将小鼠随机分为实验组(12只,每只注射0.6 ml RDP/pDNA包裹物),对照组(12只,每只注射等量生理盐水),在 d 1、d 3、d 5、d 7颈椎脱臼处死小鼠,取其脑、肝、肾等组织,迅速放置于-70℃冰箱,用OCT树脂包埋,快速冷冻,用冷冻切片机切片(厚40 μm),在荧光显微镜下(Olympus:IX-70)以蓝色波长范围的光线激发,观察EGFP荧光强度。
2 结果
2.1 RDP包裹EGFP-N1质粒的凝胶阻滞电泳检测 Fig 1结果显示,不同质量比条件下RDP与DNA的结合程度不同。DNA在加入较少的RDP(即R/E<2∶1)时,部分 DNA未能被阳离子载体完全包覆而向阳极做定向迁移。随着RDP的量不断增大,当R/E≥2∶1时,质粒与多肽结合的非常紧密,复合物未发生迁移,DNA全部被RDP完全包覆而滞留在点样孔内,达到了对DNA的阻滞作用。因此可得实验中第5孔的比例为包裹的最佳比例,即RDP和EGFP-N1混合的最佳比例为2∶1。

Fig 1 Gel retardation assay.
2.2 圆二色谱检测 圆二色谱仪于室温下测量RDP以及包裹了DNA后的二级结构。RDP包裹了pEGFP后β-折叠由35.2增至54.4,转角由14.9减至2.3。
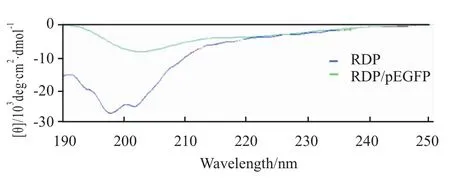
Fig 2 CD spectra of RDP with or without the plasmid DNA.
2.3 细胞转染 质粒pEGFP转染细胞12~48 h后观察荧光表达。Fig 3结果显示,穿膜肽RDP可以携带DNA进入SH-SY5Y中,并表达绿色荧光蛋白,而在CHO中未检测到荧光。此外,复合物 RDP/pEGFP转染SH-SY5Y细胞后,于不同时间点观察荧光表达。结果显示(Fig 4),基因转染12 h后,即能够观测到蛋白表达,随着时间的延长,荧光逐渐增加,表明目的蛋白在细胞中不断积累,而空白对照孔(仅加入pEGFP)未检测到荧光。
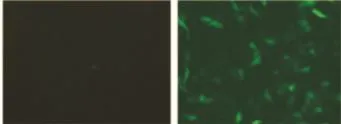
Fig 3 Complex of RDP/pDNA is transfected into the SH-SY5Y and CHO cells for examination of specific protein expression(×200)A:CHO;B:SH-SY5Y
2.4 小鼠组织切片检测EGFP基因在体内的表达
复合物RDP/pEGFP经尾静脉给予小鼠后,分别在d 1、d 3、d 5、d 7观察绿色荧光的分布。从组织的荧光强弱来看,脑组织的荧光最强,肾和肝次之。
3 讨论
本研究中,琼脂糖凝胶电泳阻滞实验是用来探索多肽包裹核酸最佳比例的方法,我们验证了RDP与DNA的最佳包裹比例是2∶1(W/W)。圆二色谱图显示出多肽RDP结合DNA后构象发生转变,由35.2增至54.4,说明多肽结构呈β-折叠构象。由于RDP是pI值为12.3的碱性多肽,与带负电荷的DNA可能通过正负电荷之间的静电作用而结合。
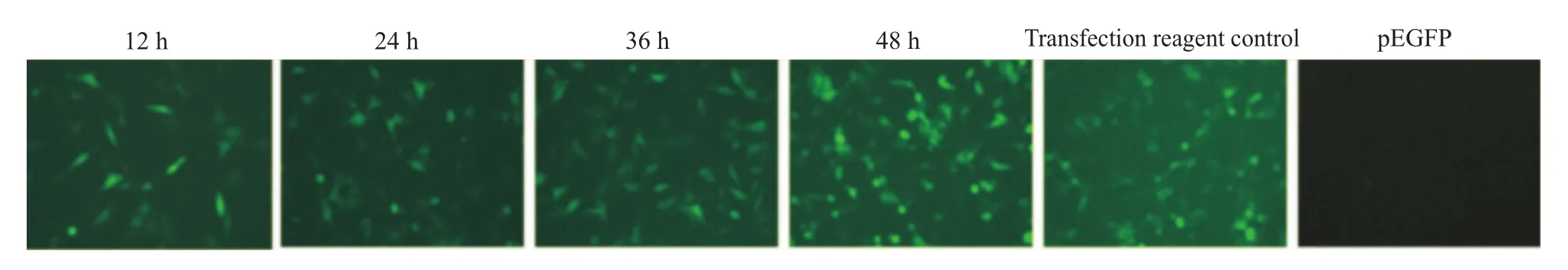
Fig 4 Complex of RDP/p DNA is transfected into the SH-SY5Y cell for fluorescence analysis of specific protein expression at different times(×200)

Fig 5 Fluorescence expression detected in mouse tissue sections
在体外实验中,RDP包裹的DNA能特异地进入SH-SY5Y细胞,且随着转染时间的增加荧光增强,而与之相同试验条件下的非神经细胞CHO细胞没有荧光显示。在体内实验中,可观测到小鼠各组织切片中脑组织切片荧光信号最强,且持续大约1周时间。这些结果说明,RDP作为一种新型穿膜肽,能够引导DNA靶向性进入神经细胞,在体内、体外均可表达目的蛋白,且不影响生物大分子的活性。
使用多肽作为基因治疗载体具有广阔的应用前景。一些穿膜肽,例如TAT、转运素、多聚Arg等能够在体外将核酸转导入培养的细胞中,然而在体内,由于血清等其它因素的影响,绝大多数多肽不能有效引导核酸进入细胞,需要联合其它非病毒载体(纳米粒子、脂质体)才能实现核酸的体内转运。在报道的文献中,仅有MPG和Pep-1可单独作为体内基因转移的载体,但它们多集中在外周,在脑内的浓度较低[11]。本实验中,我们使用的多肽RDP,能让复合物进入体内神经细胞,高效地表达外源基因,实现了DNA的入神经细胞转运。
RDP介导核酸入脑的机制目前尚不明确。已知RVG进入细胞是因为它能够特异性地和神经细胞的烟碱型乙胆碱受体(nAChR)结合,从而使得病毒可以进入细胞,有文献报道RVG29-d9R可通过nAChR的α7亚型受体介导siRNA进行胞吞作用转运[12-13]。RDP来源于 RVG,因此推测其特异性受体也为nAChR。然而,RDP引导蛋白质进入神经细胞的机制研究表明,RDP及其融合蛋白可能是通过γ-氨基丁酸(GABA)受体介导的内吞通路进入神经细胞。已知血脑屏障和神经细胞膜表面存在着特异性的GABA受体,而GABA的A型受体 (GABAA)与nAChR同属于配体门控的离子通道家族,配体进入细胞均依赖网格蛋白介导的内吞作用。此外,GABA和氯丙嗪(网格蛋白介导的内吞作用抑制剂)可以抑制细胞对RDP的特异性摄取,说明来源于RVG的RDP可以与GABA受体相互作用,通过网格蛋白介导的内吞作用进入细胞[14]。
总之,本研究表明RDP可能是一个有效的体内外神经细胞的基因表达载体。作为基因治疗的一种合适的靶向神经细胞的载体,RDP在未来的非病毒载体应用中可能具有较大的潜力。
参考文献:
[1]Pardridge W M.Biopharmaceutical drug targeting to the brain[J].J Drug Target,2010,18(3):157-67.
[2]周 宓,王志强.跨血脑屏障药物转运的研究进展[J].生命科学研究,2009,13(4):370-6.
[2]Zhou M,Wang Z Q.Advances in drug delivery across the bloodbrain barrier[J].Life Sci Res,2009,13(4):370-6.
[3]Brasnjevic I,Steinbusch H W,Schmitz C,et al.Delivery of peptide and protein drugs over the blood-brain barrier[J].Prog Neurobiol,2009,87(4):212-51.
[4]Fu A L,Yan X B,Sui L.Down-regulation of beta1-adrenoceptors gene expression by short interfering RNA impairs the memory retrieval in the basolateral amygdala of rats[J].Neurosci Lett,2007,428(2-3):77-81.
[5]Schlachetzki F,Zhang Y,Boado R,et al.Gene therapy of the brain:the trans-vascular approach[J].Neurology,2004,62(8):1275-81.
[6]张 阳,张志坚,俞晓岚,等.慢病毒介导的新型90CE8A系统大鼠YU14和9P双基因脑内转移对帕金森病大鼠模型的保护作用[J].中国药理学通报,2011,27(2):234-9.
[6]Zhang Y,Zhang Z J,Yu X L,et al.Protective effects of the intracerebal transfer of the lentiviral-mediated GDNF and TH bi-gene on the basis of improved Tet-on system in a rat model of Parkinson’s disease[J].Chin Pharmacol Bull,2011,27(2):234-9.
[7]Rittner K,Benavente A,Bompard-Sorlet A,et al.New basic membrane-destabilizing peptides for plasmid-based gene delivery in vitro and in vivo[J].Mol Ther,2002,5(2):104-14.
[8]Du L,Kayali R,Bertoni C,et al.Arginine-rich cell-penetrating peptide dramatically enhances AMO-mediated ATM aberrant splicing correction and enables delivery to brain and cerebellum[J].Hum Mol Genet,2011,20(16):3151-60.
[9]Meade B R,Dowdy SF.Exogenous siRNA delivery using peptide transduction domains/cell penetrating peptides[J].Adv Drug Deliv Rev,2007,59(2-3):134-40.
[10]Xiang L X,Zhou R M,Fu A L,et al.Targeted delivery of large fusion protein into hippocampal neurons by systemic administration[J].J Drug Target,2011,19(8):632-6.
[11]Deshayes S,Morris M,Heitz F,et al.Delivery of proteins and nucleic acids using a non-covalent peptide-based strategy[J].Adv Drug Deliv Rev,2008,60(4-5):537-47.
[12]Kumar P,Wu H,McBride J L,et al.Transvascular delivery of small interfering RNA to the central nervous system[J].Nature,2007,448(7149):39-43.
[13]Hwang do W,Son S,Jang J,et al.A brain-targeted rabies virus glycoprotein-disulfide linked PEI nanocarrier for delivery of neurogenic microRNA[J].Biomaterials,2011,32(21):4968-75.
[14]Fu A L,Zhao Z Z,Gao F Y,et al.Cellular uptake mechanism and therapeutic utility of a novel peptide in targeted-delivery of proteins into neuronal cells[J].Pharm Res,2013,30(8):2108-17.
