双功能融合蛋白RDP-BDNF对东莨菪碱所致认知功能障碍小鼠学习记忆的影响
2014-05-17张苗苗张恩齐高飞燕项松涛付爱玲
张苗苗,张恩齐,高飞燕,吴 静,项松涛,付爱玲
(西南大学药学院,重庆 400716)
脑源性神经营养因子(brain-derived neurotrophin factor,BDNF)是体内含量最高的神经营养因子,具有维持多种神经元存活并直接促进轴突生长的作用,能够保护胆碱能神经元并与学习记忆密切相关[1]。然而由于血脑屏障(blood-brain barrier,BBB)的存在,限制了外源性BDNF等具有治疗潜力的大分子化合物入脑并发挥作用。中枢神经系统给药方法包括侵入性给药方法和非侵入性给药方法,前者药物注射入脑后很快被组织清除,且不易扩散、对技术要求高、风险大,所以不能在临床使用[2-3];后者则主要是通过载体的协助作用,将大分子物质转运入脑。狂犬病毒糖蛋白(rabies virus glycoprotein,RVG)具有嗜神经性,能够携带其他物质向中枢神经系统转运[4]。序列分析显示,RVG上的330-357氨基酸序列是病毒与神经元结合的关键部位[5],我们将这段序列与含9个精氨酸的膜转导肽(cell penetrating peptides,CPPs)连接后形成 RVG衍生肽(RVG-derived peptide,RDP)。有文献报道,RDP能够携带多种生物大分子通过血脑屏障并发挥其生物学功能[6-8]。本实验试图通过将 RDP肽段与BDNF蛋白融合,检测其携带BDNF蛋白的入脑情况,探究RDP-BDNF对认知障碍模型小鼠的作用。
1 材料与方法
生物工程研究所;Ach ELISA检测试剂盒购自上海源叶生物科技有限公司;石杉碱甲、氢溴酸东莨菪碱,购自Aladdin公司;其它均为国产分析纯试剂。
1.2 pET28a-RDP-BDNF,p ET28a-BDNF载体构建及表达 为了尽量RDP与BDNF两个肽段的空间结构,在BDNF序列的上游引入Linker,将RDP基因与BDNF基因序列连接,并构建pET28a-BDNF载体作为对照。设计两对引物,导入HindⅢ和XhoⅠ酶切位点。pET28a-RDP-BDNF上游引物:5′-CAAAGCTTGGTGGAGGCGGTTCAGGCGGAGGTGGC TCAATGCACTCTGACCCTGCCCG-3′,下游引物:5′-GACTCGAG CTATCTTCCCCTTTTAATGG-3′;pET28a-BDNF上游引物:5′-CAAAGCTTCAATGCACTCTGACCCTGCCCG-3′,下游引物:5′-GACTCGAGCTATCTTCCCCTTTTAATGG-3′。
以pGEM-T-rhBDNF载体为模板,PCR扩增:反应条件:热启动5 min后加入pfu酶;94℃变性40 s,50℃退火40 s,72℃延伸3 min,40个循环;72℃保温10 min,使反应物扩增充分;4℃保存。所得产物胶回收后酶切,连接,转化至BL21中,挑取阳性菌落,提取质粒酶切鉴定并测序。
阳性克隆接种至LB培养基(含50 mg·L-1卡那霉素),37℃,160 r·min-1培养至 OD600约为0.6~0.8,加入终浓度 1.0 mmol·L-1的 IPTG,20℃,180 r·min-1,6 h诱导表达。诱导结束后高速离心收集菌体,用MCAC-0缓冲液(20 mmol·L-1Tris-HCl,500 mmol·L-1NaCl,质量分数 10%甘油,pH 8.0)洗涤后重悬浮。-20℃冻融,超声破碎后高速离心,取上清,经Ni+亲和层析柱纯化,冷冻干燥后得蛋白纯品,SDS-PAGE电泳。
1.3 RDP-BDNF在脑和血清中的含量测定 将小鼠分为3组,分别经尾静脉注射RDP-BDNF、BDNF蛋白(2 mg·kg-1),阴性对照注射等量的生理盐水,于 0.25、0.5、1、3、5 h取血清、大脑,-80℃保存备用。BDNF在脑和血清中的含量用BDNF ELISA试剂盒检测。
1.4 AD模型鼠的制备及RDP-BDNF治疗 将小鼠随机分为:正常对照组、东莨菪碱模型组、石杉碱甲治疗组(0.1 mg·kg-1)、RDP-BDNF治疗组(2 mg·kg-1)、BDNF治疗组(2 mg·kg-1),共 5组。实验前连续腹腔给药10 d,正常对照及模型组分别给予等量的生理盐水。于11 d开始造模并进行Morris水迷宫(成都泰盟科技有限公司)测试。
于每天实验前,除正常对照组腹腔注射等量的生理盐水外,其余各组小鼠均予腹腔注射东莨菪碱2 mg·kg-1,直到实验全部结束。
参照Morris[9]方法进行实验。各组于造模后20 min进行水迷宫测试。定位航行实验时每只小鼠每天训练1次,每次按东、西、南和北4个入水点分别放入水池。每只小鼠有120 s找到平台,120 s未找到平台者,将其引至平台,放置30 s,使其记忆平台的位置;数据采集和处理均由图像自动监视和处理系统完成。整个实验需要6 d完成,每只小鼠平均游泳时间和平均游泳速度作为衡量其学习记忆能力的指标。定位航行结束后,移去平台,将小鼠从某一点放入,每只小鼠游泳时间为90 s,记录其游泳轨迹及在目的象限游泳的时间。
1.5 生化指标测定 水迷宫实验结束后,将小鼠处死,快速取脑,-80℃保存备用。分别按照各试剂盒说明书上的方法测定各组小鼠脑中BDNF、乙酰胆碱(acetylcholine,ACh)、谷胱甘肽(glutathione,GSH)的含量及胆碱乙酰化转移酶(choline acetyltransferase,ChAT)和超氧化物歧化酶(superoxide dismutase,SOD)的酶活性。
1.6 统计学处理 使用SPSS 13.0软件进行数据分析,实验数据以¯x±s表示,数据采用单因素方差分析,组间比较采用q检验。
2 结果
2.1 融合蛋白的表达 以pGEM-T-rhBDNF载体作为模板,扩增出360 bp左右条带,经测序证实为BDNF基因,采用基因工程技术构建pET28a-RDPBDNF、pET28a-BDNF载体,测序验证成功后,IPTG诱导表达。样品处理后SDS-PAGE电泳分析,得到一条17 ku左右的特异性条带,与融合蛋白的理论大小一致,说明我们成功的得到了融合蛋白(见Fig 1)。

Fig 1 SDS-PAGE for RDP-BDNF fusion proteinM:Protein molecular weight markers;1:Null plasmid BL21 bacteria control;2:Uninduced pRDP-BDNF BL21;3:Induced pRDP-BDNF BL21;4:Purified RDP-BDNF fusion protein;5:RDP-BDNF in supernatant after ultrasonic disruption;6:Fusion protein in precipitation after ultrasonic disruption of bacteria.
2.2 RDP-BDNF在小鼠大脑和血清中的时效曲线由Fig 2A可知,尾静脉注射RDP-BDNF蛋白15 min后,即在小鼠脑中检测到外源性BDNF蛋白,蛋白的含量逐渐降低,在5 h时基本恢复到正常值;然而注射BDNF蛋白的小鼠脑中BDNF含量没有明显变化,说明RDP-BDNF可以穿过血脑屏障。Fig 2B则显示,注射RDP-BDNF和BDNF蛋白后,两组小鼠血清中BDNF含量都明显提高,BDNF组上升幅度更大。

Fig 2 Time-course relationship of RDP-BDNF delivery in cerebrum(A)and serum(B)

Fig 3 Results of probe testA:The time spent in target quadrant in probe test.**P<0.01 vs control;#P<0.05,##P<0.01 vs model;B:The representative swimming route of animals in probe test.
2.3 RDP-BDNF融合蛋白对东莨菪碱所致认知障碍小鼠学习记忆的影响 由Tab 1可知,在定位航行实验中,模型小鼠找到平台的潜伏期比对照组长,差异有统计学意义,说明认知障碍模型制备成功;石杉碱甲治疗组和RDP-BDNF治疗组的潜伏期比模型组短,且差异有统计学意义,说明融合蛋白对模型鼠的认知功能有明显改善作用;Tab 2中,各组小鼠之间的游泳速度没有差异,说明RDP-BDNF改善了小鼠的学习记忆能力,而不是其运动功能。由Fig 3可得,在空间探索实验中,移去平台后,石杉碱甲治疗组和RDP-BDNF治疗组在目的象限的停留时间比模型组明显延长,进一步说明融合蛋白治疗能增强模型小鼠的记忆能力。
2.4 RDP-BDNF的作用机制 为了探究RDP-BDNF的作用机制,我们测定了相关物质的指标。由Fig 4可知,与对照组相比,模型组小鼠脑中BDNF含量下降,RDP-BDNF治疗组模型小鼠脑中的BDNF蛋白含量则明显增高,说明RDP-BDNF可以穿过血脑屏障,改善模型组小鼠脑内BDNF的不足;Fig 5显示,与对照组相比,模型小鼠脑内ChAT酶活性和ACh水平都明显降低,而RDP-BDNF和阳性对照药石杉碱甲治疗都可以提高模型小鼠脑中二者的水平,说明补充模型小鼠脑内BDNF含量,可以增强胆碱能神经功能;Fig 6则表明,RDP-BDNF治疗明显提高模型小鼠脑中SOD酶活性和GSH水平,由此可知,提高脑内BDNF含量可以维持氧化应激平衡,保护神经元免受自由基损害。

Tab 1 Time of escape latency in Morris water maze

Tab 2 Swimming speed(cm/s)of mice in Morris water maze

Fig 4 Effect of exogenous RDP-BDNF on BDNF level in cerebra**P<0.01 vs control;##P<0.01 vs model.
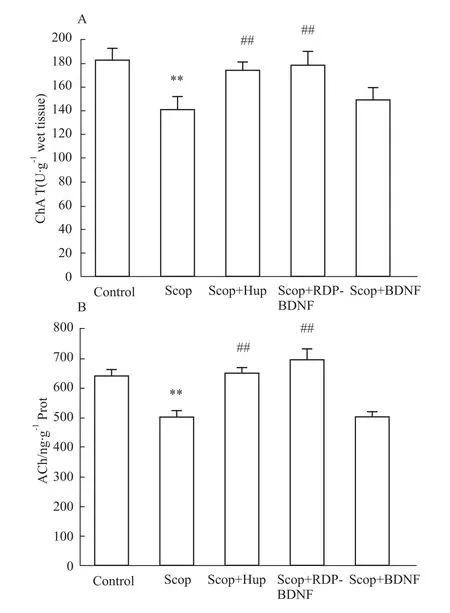
Fig 5 Influence of RDP-BDNF on activity of ChAT and level of ACh of model mice**P<0.01 vs control;##P<0.01 vs model.
3 讨论
BDNF几乎在神经回路发育的各个环节都发挥至关重要的作用,其可与酪氨酸激酶受体(trkB)结合,激活细胞分裂素活化蛋白激酶(MAPK)和磷脂酰肌醇(-3)激酶(PI3K)通路[10],同时影响下游的转录因子的活性[11]。研究表明,在痴呆病人的海马、颞叶及其他皮质区BDNF的水平都有降低,而给予外源性BDNF蛋白可以减缓胆碱能神经元的退化,提高其功能[12-14]。然而,BBB却限制了外源性BDNF蛋白活性的发挥。因此,本研究提出将新型穿膜肽RDP与BDNF连接制备融合蛋白,并通过ELISA方法检测融合蛋白的活性及其在脑和血清中分布的时效曲线;在行为学测试中,RDP-BDNF融合蛋白治疗明显改善认知障碍小鼠的学习记忆能力。以上结果表明,RDP可以携带BDNF进行入脑转运,并且不影响其生物活性。
关于RDP-BDNF治疗认知障碍小鼠的机制,我们基于两个假说进行研究。首先,根据胆碱能假说可知,胆碱能神经元的损伤对小鼠的认知功能有影响,因此,我们检测了小鼠大脑中ChAT的酶活性及ACh的水平。结果显示,RDP-BDNF治疗组小鼠脑中ChAT酶活性和ACh水平与模型组相比都有明显提高。其次,根据氧化应激假说,痴呆病人脑中自由基氧化会导致蛋白质氧化、脂质超氧化及线粒体氧化损伤。为了研究RDP-BDNF治疗与氧化应激系统的关系,我们检测了各组小鼠脑中SOD的酶活性及GSH的水平。结果显示,RDP-BDNF治疗组的SOD酶活性和GSH水平与模型组相比都有明显提高。所以,RDP-BDNF对东莨菪碱诱导的认知障碍小鼠的治疗可能与增强胆碱能神经功能及抑制自由基氧化,维持氧化应激状态平衡有关。
目前,RDP-BDNF穿过BBB进入脑组织的机制尚不清楚,我们实验室之前的研究表明,γ-氨基丁酸(GABA)和氯丙嗪可以阻断细胞对RDP的特异性摄取,这说明RDP可能通过与GABA受体结合,并经网格蛋白调节的细胞内吞途径进入细胞[7]。由此,我们推测,RDP-BDNF穿过血脑屏障的机制可能与受体介导有关,有关这方面的研究仍在继续进行。
尽管近年来科学家们一直在寻找能有效将有活性的生物大分子转运入脑的方法,BBB仍然是限制这些活性因子发挥作用的主要障碍。本研究结果表明,RDP可以携带BDNF进入脑内,并且不影响其生物活性,因此,我们推测由RDP携带有治疗活性的蛋白质入脑并发挥作用将为脑部疾病的治疗提供一种新方法。

Fig 6 Effects of RDP-BDNF on activity of SOD and level of GSH of model mice*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model.
参考文献:
[1] Lu B,Nagappan G,Guan X,et al.BDNF-based synaptic repair as a disease-modifying strategy for neurodegenerative diseases[J].Nat Rev Neurosci,2013,14(6):401-16.
[2] Pardridge W M,Kang Y S,Buciak J L.Transport of human recombinant brain-derived neurotrophic factor(BDNF)through the rat blood-brain barrier in vivo using vector-mediated peptide drug delivery[J].Pharm Res,1994,11(5):738-46.
[3] Pardridge W M.Blood-brain barrier drug targeting:the future of brain drug development[J].Mol Interv,2003,3(2):90-105.
[4] Tuffereau C,Benejean J,Alfonso A R,et al.Neuronal cell surface molecules mediate specific binding to rabies virus glycoprotein expressed by a recombinant baculovirus on the surfaces of lepidopteran cells[J].J Virol,1998,72(2):1085-91.
[5] Tang Q,Orciari L A,Rupprechti CE,et al.Sequencing and position analysis of the glycoprotein gene of four Chinese rabies viruses[J].Virol Sin,2000,15(1):22-33.
[6] Fu A L,Wang Y L,Zhan L P,et al.Targeted delivery of proteins into the central nervous system mediated by rabies virus glycoprotein-derived peptide[J].Pharm Res,2012,29(6):1562-9.
[7] Fu A L,Zhao ZZ,Gao FY,et al.Cellular uptake mechanism and therapeutic utility of a novel peptide in targeted-delivery of proteins into neuronal cells[J].Pharm Res,2013,30(8):2108-17.
[8] 高飞燕,张苗苗,徐兴然,等.穿膜肽引导核酸靶向性进入神经细胞的研究[J].中国药理学通报,2014,30(3):326-30.
[8] Gao F Y,Zhang M M,Xu X R,et al.The study of a cell-penetrating peptide mediated targeted-delivery of DNA into neuronal cell[J].Chin Pharmacol Bull,2014,30(3):326-30.
[9] Morris R.Development of a water maze procedure for studying spatial learning in the rat[J].J Neurosci Methods,1984,11(1):47-60.
[10]Barnabe-Heider F,Miller F D.Endogenously produced neurotrophins regulate survival and differentiation of cortical progenitors via distinct signaling pathways[J].J Neurosci,2003,23(12):5149-60.
[11]Ito H,Nakajima A,Nomoto H,et al.Neurotrophins facilitate neuronal differentiation of cultured neural stem cells via induction of mRNA expression of basic helix-loop-helix transcription factors Mash1 and Math1[J].J Neurosci Res,2003,71(5):648-58.
[12]Lee J,Fukumoto H,Orne J,et al.Decreased levels of BDNFprotein in Alzheimer temporal cortex are independent of BDNF polymorphisms[J].Exp Neurol,2005,194(1):91-6.
[13]Peng S,Wuu J,Mufson E J,Fahnestock M.Precursor form of brain-derived neurotrophic factor and mature brain-derived neurotrophic factor are decreased in the pre-clinical stages of Alzheimer′s disease[J].J Neurochem,2005,93(6):1412-21.
[14]Morse JK,Wiegand SJ,Anderson K,et al.Brain-derived neurotrophic factor(BDNF)prevents the degeneration of medial septal cholinergic neurons following fimbria transection[J].J Neurosci,1993,13(10):4146-56.
[15]Dunbar G L,Rylett R J,Schmidt B M,et al.Hippocampal choline acetyltransferase activity correlates with spatial learning in aged rats[J].Brain Res,1993,604(1-2):266-72.
[16]Beal MF.Aging,energy,and oxidative stress in neurodegenerative diseases[J].Ann Neurol,1995,38(3):357-66.
