吉非替尼和依维莫司对EGFR-TKI耐药鼻咽癌细胞的作用*
2014-05-16刘媛刘东伯龙国贤胡国清
刘媛,刘东伯,龙国贤,胡国清
(1.湖北省襄阳市中心医院肿瘤科,襄阳 441000;2.华中科技大学同济医学院附属同济医院肿瘤科,武汉 430030)
吉非替尼和依维莫司对EGFR-TKI耐药鼻咽癌细胞的作用*
刘媛1,2,刘东伯2,龙国贤2,胡国清2
(1.湖北省襄阳市中心医院肿瘤科,襄阳 441000;2.华中科技大学同济医学院附属同济医院肿瘤科,武汉 430030)
目的 探讨吉非替尼和依维莫司对吉非替尼耐药鼻咽癌细胞的作用效果及分子作用机制。方法吉非替尼、依维莫司单独或联合作用人鼻咽癌细胞株HONE1后,采用噻唑蓝(MTT)法检测细胞的增殖抑制,流式细胞术检测细胞凋亡率及周期分布,Western blot检测细胞磷酸化丝氨酸苏氨酸蛋白激酶(p-AKT)、磷酸化核糖体S6蛋白激酶(p-S6K)的表达水平。结果吉非替尼和依维莫司均呈浓度依赖性抑制HONE1细胞增殖,吉非替尼的半数抑制浓度(IC50)为17.92μmol·L-1,依维莫司的IC50为2.46 nmol·L-1,但二者联合作用效果与单药相比并未表现出明显的优势(P> 0.05);吉非替尼对p-AKT抑制作用不明显,依维莫司可下调p-S6K的表达,同时上调了p-AKT的表达,联合用药对p-S6K和p-AKT表达的抑制作用并不明显强于单药。结论吉非替尼和依维莫司联合作用于吉非替尼耐药鼻咽癌细胞株HONE1没有表现出协同效应,表皮生长因子受体/丝氨酸苏氨酸蛋白激酶(EGFR/AKT)信号通路与雷帕霉素蛋白(mTOR)信号通路在鼻咽癌细胞中的关系有待进一步研究。
吉非替尼;依维莫司;癌,鼻咽;联合用药
鼻咽癌(nasopharyngeal carcinoma,NPC)是一种地方性高发的恶性肿瘤,主要发生于东南亚地区和中国,特别是中国的广东、香港、广西、海南、福建等地,每年发病率(20~30)/100 000[1],严重威胁人民身体健康。放射治疗或同步放射治疗化学治疗(化疗)是局部鼻咽癌的主要治疗模式,对于远处复发或转移患者主要采用全身化疗,但有效率低,不良反应大。小分子靶向药物是目前治疗鼻咽癌的研究热点。表皮生长因子受体(epidermal growth factor receptor,EGFR)在超过80%的鼻咽癌患者中呈过表达,并与不良的临床预后密切相关[2]。EGFR抑制药分为两类:一类是单克隆抗体,直接抑制胞外配体结合区,如西妥昔单抗、尼妥珠单抗;另一类是小分子酪氨酸激酶抑制药(tyrosine kinase inhibitor,TKI),抑制胞内酪氨酸激酶区,如吉非替尼(gefitinib)。西妥昔单抗、尼妥珠单抗治疗晚期鼻咽癌效果显著,但是,吉非替尼的疗效却让人失望[3]。研究显示,鼻咽癌中丝氨酸苏氨酸蛋白激酶(protein serine threonine kinases,AKT)相关的信号传导通路呈持续活化状态,并参与了其对吉非替尼原发耐药[4]。持续活化的AKT通过使底物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、Chk1、MDM2、Bcl-xl/Bcl-2相关促凋亡因子BAD等磷酸化控制细胞进程,其中,mTOR相关信号通路的失控对于肿瘤的发生和发展最为重要[5-6]。研究显示,联合靶向EGFR和mTOR治疗在肺癌、胰腺癌、前列腺癌、乳腺癌等肿瘤中,均取得了良好的协同作用,mTOR抑制药可以逆转肿瘤细胞对EGFR-TKI的耐药[7-10]。而联合靶向EGFR和mTOR在鼻咽癌中的作用鲜见报道,笔者在本研究中探讨EGFR-TKI吉非替尼和mTOR抑制药依维莫司(everolimus)在鼻咽癌细胞HONE1中联合应用的效果,并初步探讨可能的分子作用机制,为鼻咽癌联合靶向治疗提供参考。
1 材料与方法
1.1 主要试剂与仪器 吉非替尼为阿斯利康公司惠赠;依维莫司为诺华公司惠赠;RPMI-1640培养液和胎牛血清购于Gibco公司;胰蛋白消化酶购于Sigma公司;一抗AKT、p-AKT(ser473)、S6K及p-S6K(thr389)单克隆抗体和辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗鼠及羊抗兔二抗购于Cell Signaling公司;噻唑蓝(thiazolyl blue,MTT)试剂盒购于北京普利莱基因技术有限公司;细胞膜磷酯酰丝氨酸异硫氰酸荧光素凋亡检测试剂盒和细胞周期检测试剂盒购于南京凯基生物技术有限公司;增强化学发光法(enhanced chemiluminescence,ECL)显色试剂盒购于GE Healthcare公司;酶标仪、电泳槽和转膜仪购于Bio-Rad公司;流式细胞仪购于Beckman Coulter公司。
1.2 细胞培养 HONE1为人鼻咽低分化鳞状细胞癌细胞株,由中南大学肿瘤研究所曹亚教授馈赠。用含10%胎牛血清、100 U·m L-1青霉素和100 U·m L-1链霉素的RPMI 1640培养液,于5%二氧化碳(CO2)、37℃培养箱中培养,每2~3 d用0.25%胰蛋白酶消化传代,选对数生长期细胞进行实验。
1.3 生长抑制率检测 取对数生长期的HONE1细胞种于96孔板中,分别用不同浓度的吉非替尼(0.1, 1.0,5.0,10.0,25.0,50.0,100.0μmol·L-1)和依维莫司(0.1,1.0,10.0,100.0,1 000.0 nmol·L-1)单独处理或两药物联合处理72 h。每孔加入MTT溶液20μL孵育4 h,当肉眼可见蓝紫色的产物甲臜形成时,小心吸出孔内的MTT液,每孔加入二甲亚砜溶液(dimethyl sulfoxide,DMSO)100μL溶解甲臜结晶。于酶标仪内测定490 nm波长吸光度(A)值,根据公式,细胞生长抑制率=100%×(A对照-A实验)/(A对照-A空白),绘制生长抑制-药物浓度曲线。每孔设3个复孔,该实验至少重复3次。
1.4 凋亡检测 取对数生长期HONE1细胞种于6孔板中,分别加入吉非替尼1.0μmol·L-1、依维莫司1.0 nmol·L-1、吉非替尼1.0μmol·L-1联合依维莫司1.0 nmol·L-1、同体积培养液处理48及72 h。用不含乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)的胰酶消化细胞,4℃预冷磷酸盐缓冲液(phosphate buffer solution,PBS)洗细胞2次,收集(1~5)×105的细胞,加入细胞膜磷酯酰丝氨酸异硫氰酸荧光素5μL混匀后,加入碘化丙啶溶液5μL混匀,室温避光反应5~15 min,1 h内进行流式细胞仪检测并用CellQuest软件分析。该实验至少重复3次。
1.5 细胞周期检测 取对数生长期HONE1细胞种于6孔板中,分别加入吉非替尼1.0μmol·L-1、依维莫司1.0 nmol·L-1、吉非替尼1.0μmol·L-1联合依维莫司1.0 nmol·L-1、同体积培养液处理48 h及72 h。用不含EDTA的胰酶消化细胞,4℃预冷PBS洗涤细胞1次,收集1×106的细胞,加入70%冷乙醇3 m L固定,-20℃过夜,4℃预冷PBS洗涤细胞1次,离心弃上清液,加入核糖核酸酶A(ribonuclease A, RNaseA)100μL混匀后,37℃水浴30 min,再加入PI 400μL染色混匀,在4℃避光反应30 min,24 h内进行流式细胞仪检测并用Mod-Fit TM for Mac version 3.0软件分析。该实验至少重复3次。
1.6 细胞蛋白表达检测取 对数生长期的HONE1细胞种于培养瓶中,分别加入吉非替尼1.0μmol·L-1、依维莫司1.0 nmol·L-1、吉非替尼1.0μmol·L-1联合依维莫司1.0 nmol·L-1、同体积培养液,培养箱中孵育48 h。收集细胞,加入含蛋白酶和磷酸酶抑制药的Buffer溶解细胞,4℃低温离心,小心吸取蛋白上清液,移入预冷的离心管。BCA法检测蛋白浓度,加入上样缓冲液,置于沸水(95~100℃)5min使蛋白变性。十二烷基苯磺酸钠-聚丙烯酰胺(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶电泳分离蛋白,用转膜仪将蛋白转移至硝酸纤维膜(nitrocellulose fiter membrance,NC膜)上,并将其置入4℃预冷5%脱脂奶中,室温封闭1 h。分别用一抗孵育,4℃过夜,TBST漂洗NC膜5次,每次3 min。二抗孵育,室温1 h,三羟甲基氨基甲烷缓冲液-聚山梨酯-80溶液漂洗NC膜5次,每次3min。ECL显色法显示相关蛋白影像,扫描底片并分析。该实验至少重复3次。
1.7 作图方法 实验结果使用GraphPad Prism 5作图软件绘图;在吉非替尼和依维莫司靶向位点不同并且不相关的前提下,用Bliss法研究药物的联合效果,其公式为:

E(χ)为一种药物在浓度χ时的效果,E(y)为另一种药物在浓度y时的效果,E(χ,y)即为两药的联合效果。
1.8 统计学方法 实验结果使用SPSS 11.5版数据分析软件进行分析,t检验比较单药组和联合用药组的差异,P<0.05为差异有统计学意义。
2 实验结果
2.1 药物单独或联合处理对HONE1细胞生长影响
HONE1经不同浓度吉非替尼、依维莫司分别处理72 h后,进行MTT检测并绘制生长抑制曲线,吉非替尼在HONE1中的半数抑制浓度为17.92μmol·L-1,依维莫司在该细胞中的半数抑制浓度为2.46 nmol· L-1,两种药物均呈现出剂量依赖性生长抑制。为检验联合用药的效果,将不同浓度吉非替尼分别与依维莫司(1.0 nmol·L-1)同时作用于细胞72 h,Bliss法求出预期联合用药效果,与实际联合用药效果比较,两组数据没有明显的差别,说明联合用药没有表现出协同作用。
2.2 药物单独或联合处理HONE1前后细胞凋亡率的变化 吉非替尼、依维莫司单独或联合处理HONE1细胞48,72 h后,采用流式细胞术检测细胞凋亡情况。见图1所示,吉非替尼和依维莫司作用于细胞72 h后的凋亡率较48 h高,具有时间依赖性。但是,联合用药与单药相比,在48 h组及72 h组均未表现出明显的优势[48 h组:t(吉非替尼∶联合用药)=0.348,t(依维莫司∶联合用药)=0.245;72 h组:t(吉非替尼∶联合用药)=0.513,t(依维莫司∶联合用药)=0.265;P> 0.05]。
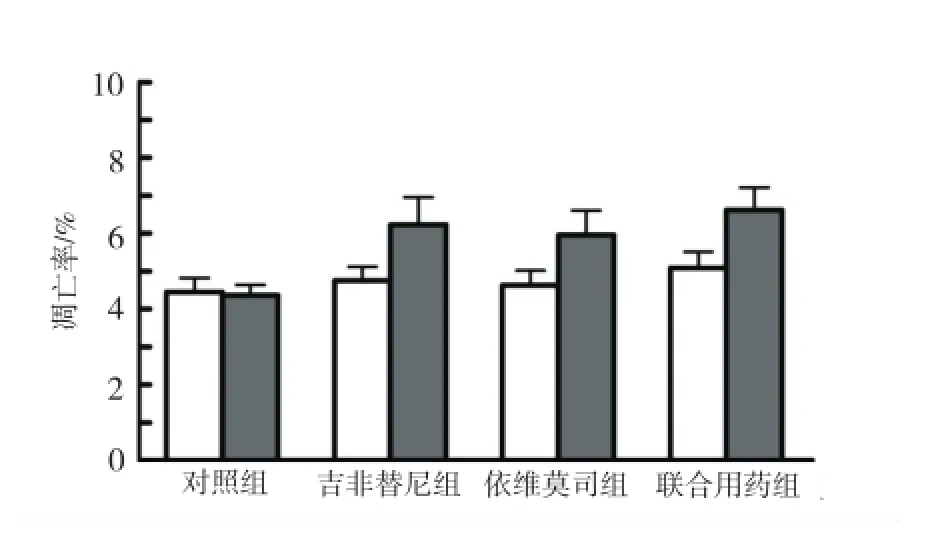
图1 吉非替尼和依维莫司单独或联合作用48,72 h时HONE1细胞凋亡率
2.3 吉非替尼和依维莫司单独或联合处理HONE1前后细胞生长周期的变化 48及72 h后,流式细胞术检测并分析对照组、吉非替尼组、依维莫司组及联合用药组细胞的周期变化,见图2所示,吉非替尼组出现G0/G1期细胞阻滞,并且,这种现象在72 h较48 h更为明显。作用48 h后,依维莫司组和对照组相比无明显差异,但其在作用72 h后,亦可引起G0/G1期细胞阻滞。然而,无论是处理48 h或72 h,联合用药组的G0/G1期细胞阻滞效果虽略高于单独用药组,但均差异无统计学意义[48 h组:t(吉非替尼∶联合用药)= 0.789,t(依维莫司∶联合用药)=0.080;72 h组:t(吉非替尼∶联合用药)=0.171,t(依维莫司∶联合用药)=0.054;P>0.05]。
2.4 吉非替尼、依维莫司单独或联合作用对通路蛋白的影响 Western blot检测吉非替尼、依维莫司单独或联合用药处理48 h后,HONE1细胞胞浆内p-AKT及p-S6K的表达情况。见图3,吉非替尼没能抑制AKT及S6K的磷酸化,依维莫司可下调p-S6K的表达,但是,它同时也上调了p-AKT的表达。联合用药时,p-AKT的表达水平与单药吉非替尼相似,并能抑制S6K的活化。
3 讨论
EGFR信号通路与mTOR信号通路密切相关[5],越来越多研究显示,通过联合靶向EGFR和mTOR抑制药阻断下游信号通路,可以更全面地抑制肿瘤细胞的生长及促进周期阻滞,从而更好地发挥药物的抗肿瘤效果[11]。EGFR与mTOR抑制药联合抗肿瘤的临床研究已显示出令人鼓舞的疗效[12-13]。

图2 吉非替尼和依维莫司单独或联合作用48,72 h时HONE1细胞周期分布
本研究发现,吉非替尼在鼻咽癌细胞株HONE1中的半数抑制浓度为17.92μmol·L-1,远远高于临床试验中吉非替尼研究剂量所能达到的血浆药物浓度[14],可以认为该细胞对吉非替尼耐药。Western blot实验结果显示吉非替尼抑制p-AKT效果不佳,这也从分子水平证实了HONE1对吉非替尼耐药,且其机制与p-AKT“逃逸”相关,这同以往吉非替尼在鼻咽癌中的研究结果一致[4]。
研究显示,在非小细胞肺癌、淋巴瘤等细胞中,依维莫司主要通过诱导G0/G1期细胞周期阻滞抑制肿瘤细胞生长,而引起细胞凋亡的作用甚微[15-16]。但也有研究显示在卵巢癌、非小细胞肺癌及神经胶质瘤细胞株中,依维莫司抑制细胞生长与诱导凋亡相关[17-18]。MA等[19]开展的一项基础研究发现依维莫司可以通过诱导细胞凋亡抑制鼻咽癌细胞株的生长,但不引起细胞周期阻滞。然而,本研究结果显示,依维莫司既能诱导HONE1细胞凋亡,又可以引起细胞G0/G1期阻滞,两种作用效果均呈时间依赖性。值得一提的是,本实验中依维莫司对细胞周期的作用在72 h后才表现出来,而MA等[19]的实验中依维莫司仅作用了24 h,这可能是导致不同结果的主要原因。为了更深入地了解依维莫司在HONE1中的作用机制,笔者检测了药物作用下信号通路上几种关键蛋白的表达,结果发现依维莫司在抑制p-S6K活化的同时明显上调p-AKT的表达,这种现象在其他肿瘤的研究中也有发现,可能与依维莫司诱导IGF-1/IGF-1R/PI3K/AKT信号通路激活有关[20]。

图3 吉非替尼和依维莫司单独或联合处理48 h对PI3K/AKT/m TOR信号通路的影响Fig.3 Effect of 48-hour treatment w ith gefitinib and everolimus alone or in combination on PI3K/AKT/m TOR signaling pathway
进一步研究结果显示,联合用药在抑制细胞生长、促进细胞凋亡、诱导细胞周期阻滞及抑制通路蛋白活化中的作用与单药相比差异无统计学意义,mTOR抑制药依维莫司并不能逆转鼻咽癌细胞HONE1对吉非替尼的耐药性。其原因可能包括以下两点:首先, Rictor-mTOR复合物(即mTORC2)使AKT的Ser473位点磷酸化,它可以促进PDK1识别并活化AKT的Thr308位点,从而使AKT完全激活。mTOR抑制药虽然不能特异性结合Rictor-mTOR复合物,但是,长期作用时仍能干扰Rictor-mTOR复合物的功能,抑制AKT活化[21]。超过20%的肿瘤细胞具有这种特性,它具有细胞类型依赖性和时间依赖性[22]。本研究中联合用药最长时间为72 h,虽然在一些肿瘤中表现出了明显的效果[10,23],但似乎在HONE1细胞中效果不佳。这可能是因为作用时间不够,或者,HONE1根本不具备这种特性。其次,有报道称,尽管EGFR/PI3K/AKT信号通路在鼻咽癌的发生及发展中极为重要,但是,它主要是通过下游的BAD、FKHR/FOXO信号分子或细胞周期负调控因子p21和p27发挥作用,p-mTOR的表达不受AKT的调节,EGFR/AKT/mTOR这种简单的线性模式并不适用于鼻咽癌[24-25]。
综上所述,吉非替尼和依维莫司联合作用于鼻咽癌细胞株HONE1并未表现出明显的协同效应,依维莫司不能逆转吉非替尼耐药鼻咽癌细胞株HONE1的耐药性,EGFR/AKT信号通路与mTOR信号通路在鼻咽癌细胞中的关系有待进一步研究。
[1]TAO Q,CHAN A T.Nasopharyngeal carcinoma:molecular pathogenesis and therapeutic developments[J].Exp Rev Mol Med,2007,9(12):1-24.
[2]CHUA D T,NICHOLLS JM,SHAM J S,et al.Prognostic value of epidermal growth factor receptor expression in patients with advanced stage nasopharyngeal carcinoma treated with induction chemotherapy and radiotherapy[J]. Int JRadiat Oncol Biol Phys,2004,59(1):11-20.
[3]CHUA D T,WEIW I,WONGM P,etal.Phase IIstudy of gefitinib for the treatment of recurrent and metastatic nasopharyngeal carcinoma[J].Head Neck,2008,30(7): 863-867.
[4]MA B B,LUIV W,POON F F,et al.Preclinical activity of gefitinib in non-keratinizing nasopharyngeal carcinoma cell lines and biomarkers of response[J].Invest New Drugs, 2010,28(3):326-333.
[5]SHAW R J,CANTLEY L C.Ras,PI(3)K and mTOR signalling controls tumour cell growth[J].Nature,2006, 441(7092):424-430.
[6]郑炜,史道华.哺乳动物雷帕霉素靶蛋白靶标及其靶向治疗[J].医药导报,2008,27(11):1366-1369.
[7]DRAGOWSKAW H,WEPPLER SA,QADIR M A,et al. The combination of gefitinib and RAD001 inhibits growth of HER2 overexpressing breast cancer cells and tumors irrespective of trastuzumab sensitivity[J].BMC Cancer, 2011,11(2):420.
[8]WEDEL S,HUDAK L,SEIBEL JM,et al.Combined targeting of the VEGFr/EGFr and the mammalian target of rapamycin(m TOR)signaling pathway delays cell cycle progression and alters adhesion behavior of prostate carcinoma cells[J].Cancer Lett,2011,301(1):17-28.
[9]SCHMID K,BAGO-HORVATH Z,BERGERW,etal.Dual inhibition of EGFR and mTOR pathways in small cell lung cancer[J].Br JCancer,2010,103(5):622-628.
[10]AZZARITIA,PORCELLIL,GATTIG,et al.Synergic antiproliferative and antiangiogenic effects of EGFR and mTor inhibitors on pancreatic cancer cells[J].Biochem Pharmacol,2008,75(5):1035-1044.
[11]ADJEIA A.Novel combinationsbased on epidermal growth factor receptor inhibition[J].Clin Cancer Res,2006,12 (14 Pt 2):4446-4450.
[12]KREISL TN,LASSMAN A B,MISCHEL PS,etal.A pilot study of everolimus and gefitinib in the treatment of recurrent glioblastoma(GBM)[J].JNeurooncol,2009, 92(1):99-105.
[13]MILTON D T,RIELY G J,AZZOLI C G,et al.Phase 1 trial of everolimus and gefitinib in patients with advanced nonsmall-cell lung cancer[J].Cancer,2007,110(3): 599-605.
[14]RANSON M,HAMMOND L A,FERRY D,et al.ZD1839, a selective oral epidermal growth factor receptor-tyrosine kinaseinhibitor,is well tolerated and active in patients with solid,malignant tumors:results of a phase I trial[J].J Clin Oncol,2002,20(9):2240-2250.
[15]WANNER K,HIPPS,OELSNERM,et al.Mammalian target of rapamycin inhibition induces cell cycle arrest in diffuselarge B cell lymphoma(DLBCL)cells and sensitises DLBCL cells to rituximab[J].Br JHaematol,2006,134 (5):475-484.
[16]BOFFA D J,LUAN F,THOMASD,et al.Rapamycin inhibits the growth and metastatic progression of non-small cell lung cancer[J].Clin Cancer Res,2004,10(1 Pt1): 293-300.
[17]MABUCHI S,ALTOMARE D A,CHEUNG M,et al.RAD001 inhibits human ovarian cancer cell proliferation, enhances cisplatin-induced apoptosis,and prolongs survival in an ovarian cancermodel[J].Clin Cancer Res,2007,13 (14):4261-4270.
[18]BEUVINK I,BOULAY A,FUMAGALLI S,et al.The mTOR inhibitor RAD001 sensitizes tumor cells to DNA-damaged induced apoptosis through inhibition of p21 translation[J].Cell,2005,120(6):747-759.
[19]MA B B,LUIV W,HUIE P,et al.The activity ofmTOR inhibitor RAD001(everolimus)in nasopharyngeal carcinoma and cisplatin-resistant cell lines[J].Invest New Drugs,2010,28(4):413-420.
[20]TAMBURINI J,CHAPUIS N,BARDET V,et al.Mammalian target of rapamycin(mTOR)inhibition activates phosphatidylinositol 3-kinase/Akt by up-regulating insulinlike growth factor-1 receptor signaling in acute myeloid leukemia:rationale for therapeutic inhibition of both pathways[J].Blood,2008,111(1):379-382.
[21]SARBASSOV D D,GUERTIN D A,ALI SM,et al.Phosphorylation and regulation of Akt/PKB by the rictor-mTOR complex[J].Science,2005,307(5712):1098-1101.
[22]SARBASSOV D D,ALISM,SENGUPTA S,et al.Prolonged rapamycin treatment inhibits mTORC2 assembly and Akt/PKB[J].Mol Cell,2006,22(2):159-168.
[23]LA MONICA S,GALETTIM,ALFIERIR R,et al.Everolimus restores gefitinib sensitivity in resistant non-small cell lung cancer cell lines[J].Biochem Pharmacol,2009,78 (5):460-468.
[24]YIP W K,LEONGe V C,ABDULLAH M A,et al.Overexpression of phospho-Akt correlates with phosphorylation of EGF receptor,FKHR and BAD in nasopharyngeal carcinoma[J].Oncol Rep,2008,19(2):319-328.
[25]SHIN I,YAKES F M,ROJO F,et al.PKB/Aktmediates cell-cycle progression by phosphorylation of p27(Kip1)at threonine 157 and modulation of its cellular localization[J].NatMed,2002,8(10):1145-1152.
DOI 10.3870/yydb.2014.01.012
Effect of Gefitinib and Everolimus on Nasopharyngeal Carcinoma Cells Resistant to Epidermal Growth Factor Receptor-Tyrosine Kinases Inhibitor(EGFR-TKI)
LIU Yuan1,2,LIU Dong-bo2,LONG Guo-xian2,HU Guo-qing2
(1.Department ofOncology,Xiangyang Central Hospital,Xiangyang 441000,China;2.Department of Oncology,Tongji Hospital,Tongji Medical College, Huazhong University of Science and Technology,Wuhan 430030,China)
Objective To investigate the synergistic effect and molecular mechanism of the epidermal growth factor receptor(EGFR)inhibitor gefitinib and the mammalian target of rapamycin(mTOR)inhibitor everolimus on nasopharyngeal carcinoma resistant to gefitinibin vitro.MethodsHuman nasopharyngeal carcinoma cell line HONE1 were incubated with gefitinib and everolimus alone and in combination,the effect of cell growth inhibition was measured by MTT assay.Flow cytometry was applied to assess the cell cycle and apoptosis.Western blot was used to detect the expression of phosphorylated levels of protein serine threonine kinases(p-AKT)and ribosomal S6 kinases(p-S6K)in cells.ResultsThe effects of cell growth inhibition by gefitinib or everolimus separately were dose-dependent in the HONE1 cell line.The IC50value for gefitinib was 17.92μmol·L-1,and that for everolimus was 2.46 nmol·L-1.However,the combination of two agents did not show a obvious advantage over the drug used alone(P>0.05).The inhibition of p-AKT expression was not remarkable in the HONE1 cell line after gefitinib treatment.Everolimuswas revealed to down-regulate the expression of po-S6K and up-regulate the level of p-AKT in the HONE1 cell line.Moreover,no stronger inhibitory effect on p-S6K and p-AKT expression by combined agentswas found.ConclusionCombined treatmentof gefitinib and everolimus doesn’t show a synergistic effect against nasopharyngeal carcinoma cell line HONE1 resistant to gefitinib.Further research is in need to investigate the relationship between the EGFR/ AKT signaling pathway and themTOR signaling pathway in nasopharyngeal carcinoma cells.
Gefitinib;Everolimus;Carcinoma,nasopharyngeal;Combination therapy
R979.1;R965
A
1004-0781(2014)01-0043-06
2013-07-25
2013-10-22
*吴阶平医学基金资助项目(320.6700. 09065);国家自然科学基金资助项目(81272491)
刘媛(1987-),女,湖北荆州人,住院医师,硕士,主要研究方向:肿瘤诊断与综合治疗。电话:0710-3229190,E-mail:susan746@126.com。
胡国清(1954-),男,湖北荆州人,主任医师,博士,主要研究方向:肿瘤诊断与综合治疗。电话:027-63089802,E-mail:gqhu@tjh.tjmu.edu.cn。
