高效液相色谱-串联质谱法测定大鼠血浆紫檀芪浓度*
2014-05-15郭润正吴春江张艳黄启慧李海峡王勖曹仲厚毛育华沈杰
郭润正,吴春江,张艳,黄启慧,李海峡,王勖,曹仲厚,毛育华,沈杰
(1.交通部长江航务管理局疾病预防控制中心卫生检验所,武汉 430019;2.华中科技大学同济医学院公共卫生学院环境医学研究所教育部重点实验室,武汉 430030)
高效液相色谱-串联质谱法测定大鼠血浆紫檀芪浓度*
郭润正1,吴春江1,张艳1,黄启慧1,李海峡1,王勖1,曹仲厚1,毛育华2,沈杰2
(1.交通部长江航务管理局疾病预防控制中心卫生检验所,武汉 430019;2.华中科技大学同济医学院公共卫生学院环境医学研究所教育部重点实验室,武汉 430030)
目的 建立高效液相色谱-串联质谱法(LC-MS/MS)测定大鼠血浆紫檀芪浓度。方法血浆样品经乙醚液液萃取处理。分析柱为Thermo Hypsil Gold色谱柱(2.1 mm×50 mm,5.0μm),保护柱为Thermo C18柱(4 mm×3.0 mm, 10.0μm),以乙腈-水(含1 mmol·L-1甲酸铵)为流动相梯度洗脱,流速为0.3 mL·min-1,进样量10μL,内标为白藜芦醇,采用电喷雾离子源(ESI),以多反应监测(MRM)模式检测。用于定量紫檀芪和内标的MRM扫描离子通道分别为m/z255.1→240.2,227.1→143.0。每个样品的分析时间为5 min。结果紫檀芪和内标的保留时间分别为2.07, 1.90 min。血浆中内源性物质对测定无干扰,紫檀芪的线性范围为1~100 ng·mL-1,日内、日间精密度(RSD)均<15%;血浆低、中、高3种浓度(3,50,80 ng·mL-1)紫檀芪苷的准确度分别为103.10%,98.12%和93.23%;血浆低、中、高3种浓度(3,50,80 ng·mL-1)紫檀芪的萃取回收率分别为78.6%,80.3%和83.2%;检测方法不受基质效应影响。结论该方法灵敏、准确、快速,测定结果可靠,可用于紫檀芪的药动学研究。
紫檀芪;色谱-串联质谱法,高效液相;血浆浓度
紫檀芪(pterostilbene)是广泛存在于多种小浆果和红酒中的芪类化合物。与同类白藜芦醇(resveratrol)比较,其苯环上3,5的甲氧基取代了羟基。药理学研究表明,甲基化的芪类化合物比羟基化的芪类化合物具有更高的生物活性,紫檀芪的多种生物活性优于或至少不低于白藜芦醇。近年研究显示,紫檀芪除具有降血脂[1-2]、降血糖[3]、预防氧化应激反应[4-5]、抗炎[6]、抗真菌[7]、抗辐射[8]等作用,还能显著抑制多种肿瘤细胞增殖、侵袭和转移[9-11]。紫檀芪的研究展现了良好的应用前景。
关于紫檀芪的分析方法国内外研究较少[12-14],尤其紫檀芪在生物样品中浓度的检测方法,笔者尚未见报道。本实验旨在应用高效液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry,LCMS/MS)检测技术,建立一种样品处理简便、快速、灵敏、准确的大鼠血浆紫檀芪的定量分析方法,以满足紫檀芪生物样本分析的需求。
1 材料与仪器
1.1 仪器 LC-20A型高效液相色谱系统:DGU-20A3脱气机、LC-20AT溶剂输送泵、SIL-20A自动进样器、CTO-20A柱温箱、CBM-20A系统控制器(美国Aglient公司)。AB SCIEX API 4000型三重四级杆质谱仪,配备电喷雾离子源(Turbo Ionspray)、Analyst1.5分析软件(美国Applied Biosystems公司)。VXW-80A型漩涡混合器(上海琪特分析仪器有限公司);MD 200 Sample concentrator型氮吹仪(杭州奥盛仪器有限公司);ALC 4239R型高速大容量台式离心机;DL-5型微型高速离心机(北京仪诚科技公司);KH-600E型超声波清洗器(昆山禾创超声仪器有限公司);BS 124S电子天平(德国Sartorius公司)。
1.2 试药 紫檀芪、白藜芦醇对照品(纯度99.5%,避光保存)购自中国食品药品检定研究院;乙腈、甲醇、乙醚、甲酸氨均为色谱纯(美国Fisher Scientific公司,色谱纯);其他试剂均为市售分析纯;水为乐百氏纯净水。
1.3 动物 普通级SD大鼠,购自华中科技大学同济医学院实验动物中心[单位许可证号:SCXK(鄂) 2008-0005,动物质量合格证号NO.4200600335],常规饲养。
2 方法与结果
2.1 色谱条件 色谱柱:Thermo Hypsil Gold色谱柱(2.1 mm×50 mm,5.0μm);保护柱:Thermo C18柱(4 mm×3.0 mm,10.0μm),柱温30℃;流动相:A:水(含1 mmol·L-1甲酸铵),B:乙腈(含1 mmol·L-1甲酸铵),梯度条件:0~0.2 min,5%B;0.2~1.5 min, 5%B→95%B;1.5~2.5 min,2.5~2.6 min,95%B→5%B;2.6~5.0 min,5%B;流速:300μL·min-1;进样量:10μL。每个样品的分析时间:5 min。
2.2 质谱条件 电喷雾离子源,负离子扫描;喷雾口位置:3:5;Gas 1:0.27 MPa,Gas 2:0.35 MPa;气帘气压:0.20 MPa;碰撞气压力:Medium;离子源电压: -5 000.0 V,离子源温度:500℃;驻留时间:200 ms;多重反应监测扫描分析;紫檀芪和白藜芦醇的解簇电压分别为:-100和-120 V;碰撞电压分别为:-35和-30 V;用于定量紫檀芪和白藜芦醇的多重反应监测扫描离子通道分别为m/z255.1→240.2,227.1→143.0。
2.3 溶液的配制
2.3.1 紫檀芪标准溶液 准确称取紫檀芪对照品适量,置棕色量瓶中,用甲醇-水(50∶50)溶解并定容,配制成浓度为100μg·mL-1的储备液I。将储备液I用流动相稀释成系列标准溶液供分析用。
2.3.2 内标溶液 准确称取内标白藜芦醇对照品适量,用甲醇-水(50∶50)溶解并定容,配成浓度为100μg·mL-1的储备液Ⅱ,并从中取出少量用流动相稀释并定容,配成浓度为100 ng·mL-1的内标溶液。将以上所有溶液置于4℃冰箱内贮藏,备用。
2.4 样品预处理 取空白大鼠血浆样品200μL,置于10.0 mL塑料离心管中,加入100 ng·mL-1内标溶液20μL,涡旋混匀3 min,然后加入乙醚3.0 m L,涡旋混匀5 min,4 000 r·min-1离心5 min,取上层有机相在40℃氮气吹干,加入流动相200μL复溶,涡旋混匀3 min,12 000 r·min-1离心5 min后,取上清液10μL进样分析。
2.5 方法学考察
2.5.1 特异性 取空白血浆、空白血浆加标准品溶液加内标溶液样品按“2.4”项下方法依次操作,照“2.1”及“2.2”项下色谱及质谱条件进样分析,考察6个来自不同个体的质谱图,结果表明,紫檀芪和内标的保留时间分别为2.07,1.90 min,血浆中内源性物质不干扰测定,色谱图见图1,2。
2.5.2 标准曲线的制备 精密吸取空白血浆200μL,分别加入不同浓度的紫檀芪工作溶液20μL,使血浆中紫檀芪的浓度分别为1,5,10,20,50,100 ng·mL-1,所有样品按“2.4”项下方法操作,记录色谱。以紫檀芪与内标峰面积比(Y)对紫檀芪浓度(X)进行线性回归,得到典型回归方程Y=0.010 1+0.059 9X(r= 0.996 9),权重因子W=1/χ2。结果表明,紫檀芪血浆浓度在1~100 ng·mL-1范围内线性关系良好,最低定量限为1 ng·mL-1。
2.5.3 精密度及准确度实验 分别配制浓度为3, 50,80 ng·mL-1的血浆样本各5份,按“2.4”项下方法处理样品,进样分析,考察紫檀芪日内精密度及方法回收率;连续测定3 d,考察日间精密度。精密度及准确度实验结果见表1。
2.5.4 基质效应及提取回收率的考察 精密吸取空白血浆200μL于离心管内,按“2.4”项下方法处理样品,氮气吹干后,分别用浓度为3,50,80 ng·m L-1的紫檀芪标准溶液200μL复溶,每个浓度配制5份样品,取5μL进样分析,得到色谱峰面积A与同样浓度紫檀芪标准溶液直接进样获得的色谱峰面积B的比值,考察基质效应。另分别配制浓度为3,50,80 ng·mL-1的血浆样品各5份,按“2.4”项下方法处理样品,进样分析得到血浆样品中紫檀芪的峰面积C,C/A×100%即为提取回收率。结果表明,紫檀芪低、中、高3种浓度的基质影响百分比(n=5)分别为100.98%, 102.39%,94.29%,相应的RSD分别为13.65%, 10.18%,8.13%。可见,该方法基质效应小,具有特异性和专一性。紫檀芪低、中、高3浓度提取回收率分别为78.6%,80.3%和83.2%,相应的RSD分别为8.08%,5.17%,7.85%。
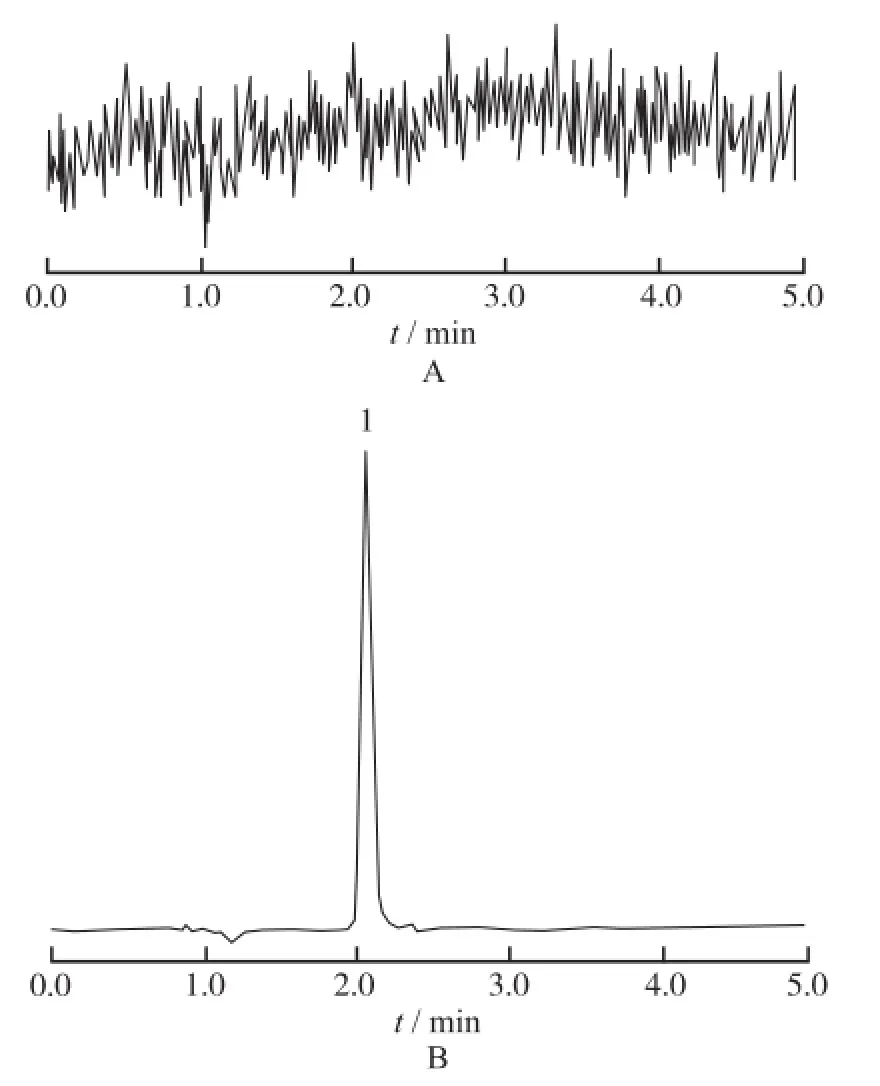
图1 空白血浆和紫檀芪的HPLC-MS/MS图A.空白血浆;B.空白血浆+紫檀芪(10 ng·m L-1);1.紫檀芪Fig.1 HPLC-MS/MS ch romatogram s of pterostilbene and blank plasmaA.blank plasma;B.blank plasma spiked with pterostilbene (10 ng·mL-1);1.pterostilbene

表1 紫檀芪含量测定的精密度与准确度结果Tab.1 Precision and accuracy of the content determ ination of pterostilbene n=5,%
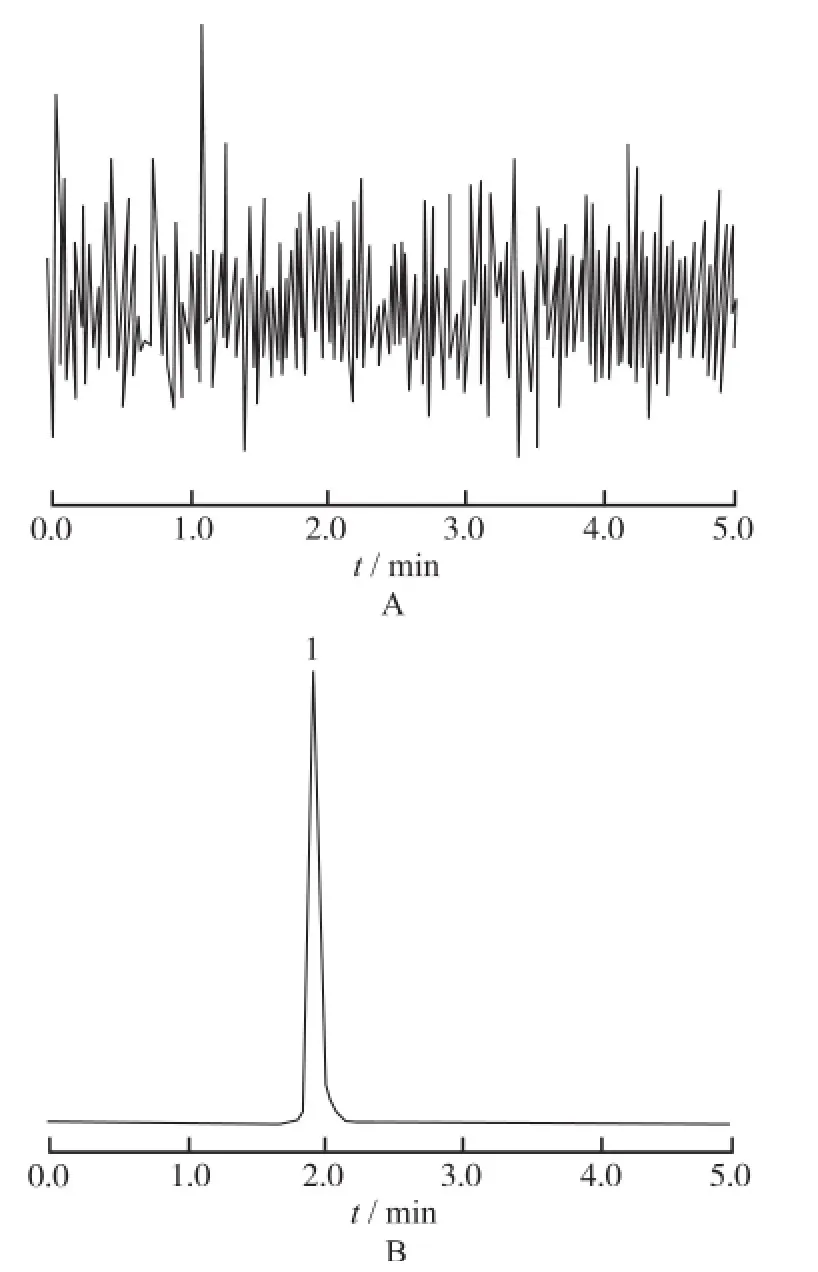
图2 空白血浆和内标白藜芦醇的HPLC-MS/MS图A.空白血浆;B.空白血浆+内标白藜芦醇(10 ng·m L-1); 1.白藜芦醇Fig.2 HPLC-MS/M S ch romatogram s of as blank plasma and resveratrol internal standardA.blank plasma;B.blank plasma plus resveratrol (10 ng·mL-1);1.resveratrol
2.5.5 样品稳定性考察 配制浓度分别为3,50, 80 ng·mL-1的血浆样品若干,萃取处理前在室温下放置24 h,萃取处理后在自动进样器放置24 h,室温→-80℃冻融3个循环,-80℃保存1个月,按“2.4”项下方法处理,进样分析,当日随行标准曲线,考察样品稳定性。样品稳定性结果表明,低、中、高血浆样品在以上4种储存条件下紫檀芪的浓度见表2。由表2可知,紫檀芪在上述保存条件下均是稳定的。
3 讨论
本实验建立了一种样品处理简便、准确、精密的测定大鼠血浆中紫檀芪浓度的LC-MS/MS方法。在方法摸索中,血浆样本处理条件对比了沉淀蛋白法与液液萃取法。本研究中之初,采用甲醇和乙腈沉淀蛋白法处理样本时,质谱响应值均有不同程度降低,分析原因可能是沉淀法处理血浆样本,不能彻底去除内源性物质,紫檀芪与内源性物质在LC-MS接口处竞争性地与初级离子反应,降低待测物离子的生成效率,进而使其响应值偏低。采用乙醚为有机溶剂进行血浆样品萃取,紫檀芪提取回收率接近80%,且各个浓度非常接近。
表2 紫檀芪稳定性考察结果Tab.2 Determination result of stability of pterostilbene ng·mL-1,±s,n=3
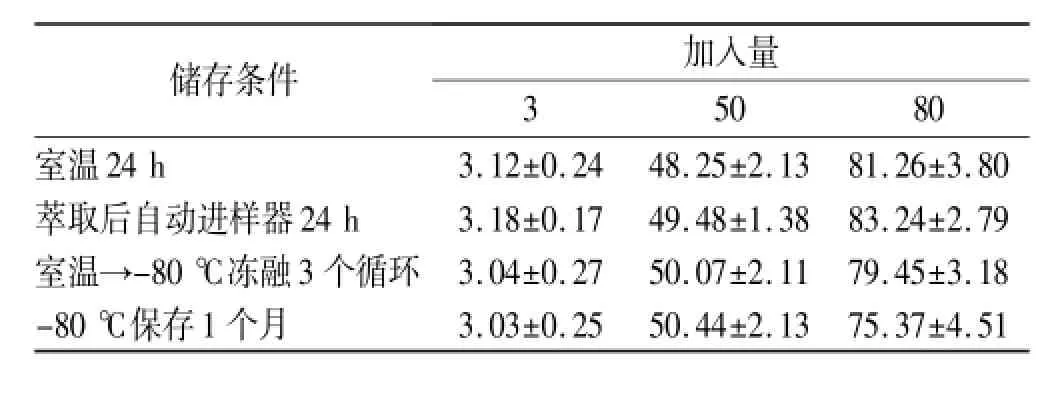
表2 紫檀芪稳定性考察结果Tab.2 Determination result of stability of pterostilbene ng·mL-1,±s,n=3
储存条件加入量3 50 80室温24 h 3.12±0.24 48.25±2.13 81.26±3.80萃取后自动进样器24 h 3.18±0.17 49.48±1.38 83.24±2.79室温→-80℃冻融3个循环3.04±0.27 50.07±2.11 79.45±3.18 -80℃保存1个月3.03±0.25 50.44±2.13 75.37±4.51
由于LC-MS/MS法的高特异性,分析工作者一度认为色谱分离对于质谱检测的重要性下降了,但越来越多的事实表明,生物样本分析中不能实现良好分离时,内源性物质虽然看不见,却仍然对色谱后共流出组分的响应值产生或强或弱的影响。因此,目前对基质效应的考察已成为LC-MS/MS法分析生物样本时的重要内容。本研究中之初,笔者采用甲醇和乙腈蛋白沉淀法,绝对基质效应超出85%~115%范围,使测定结果偏差较大。使用液液萃取的方法将样本处理得较为干净,并配以较为充分的色谱分离时,基质效应得以消除。
总之,本实验所建立的测定血浆中紫檀芪的LCMS/MS法,预处理简单,分析时间适中,适于紫檀芪的生物样本分析。
[1]PARK E S,LIM Y,HONG J T,et al.Pterostilbene,a natural dimethylated analog of resveratrol,inhibits rat aortic vascular smoothmuscle cell proliferation by blocking Akt-dependent pathway[J].Vascul Pharmacol,2010,53 (1):61-67.
[2]ZHANG L,ZHOU G,SONGW,et al.Pterostilbene protects vascular endothelial cells against oxidized low-density lipoprotein-induced apoptosisin vitroandin vivo[J]. Apoptosis,2012,17(1):25-36.
[3]AMARNATH SM,PARI L.The antioxidant role of pterostilbene in streptozotocin-nicotinamide-induced type 2 diabetesmellitus in Wistar rats[J].J Pharm Pharmacol, 2006,58(11):1483-1490.
[4]AMORATI R,LUCARINIM,MUGNAINI V,et al.Antioxidant activity of hydroxystilbene derivatives in homogeneous solution[J].J Org Chem,2004,69(21): 7101-7107.
[5]CHAKRABORTY A,GUPTA N,GHOSH K,et al.In vitroevaluation of the cytotoxic,anti-proliferative and antioxidant properties of pterostilbene isolated from pterocarpus marsupium[J].ToxicolIn Vitro,2010,24(4):1215-1228.
[6]HSU C L,LIN Y J,HO C T,et al.The inhibitory effect of pterostilbene on inflammatory responses during the interaction of 3T3-L1 adipocytes and RAW 264.7 macrophages[J].JAgric Food Chem,2013,61(3):602-610.
[7]CARUSO F,MENDOZA L,CASTRO P,et al.Antifungal activity of resveratrol against botrytis cinerea is improved using 2-furyl derivatives[J].PLoS One,2011,6(10): 25421-25423.
[8]白佳利,于程程,王德芝,等.对比评价紫檀芪和白藜芦醇的抗辐射活性[J].医药导报,2013,32(4):415-418.
[9]ALOSI J A,MCDONALD D E,SCHNEIDER J S,et al. Pterostilbene inhibits breast cancerin vitrothrough mitochondrial depolarization and induction of caspasedependent apoptosis[J].JSurg Res,2010,161(2):195-201.
[10]CHAKRABORTY A,BODIPATIN,DEMONACOSM K,et al.Long term induction by pterostilbene results in autophagy and cellular differentiation in MCF-7 cells via ROS dependent pathway[J].Mol Cell Endocrinol,2012,355 (1):25-40.
[11]CHEN R J,TSAI S J,HO C T,et al.Chemopreventive effects of pterostilbene on urethane-induced lung carcinogenesis in mice via the inhibition of EGFR-mediated pathways and the induction of apoptosis and autophagy[J].JAgric Food Chem,2012,60(46):11533-11541.
[12]FAN L L,TU P F,CHEN H B,et al.Simultaneous quantification of five major constituents in stems of Dracaena plants and related medicinal preparations from China and Vietnam by HPLC-DAD[J].Biomed Chromatogr,2009,23 (11):1191-200.
[13]李云,萧伟,秦建平,等.HPLC同时测定龙血竭及其提取物中5个有效成分的含量[J].中国中药杂志,2012, 37(7):929-933.
[14]RODRIGUEZ-BONILLA P,LOPEZ-NICOLAS JM,MENDEZ-CAZORLA L,et al.Development of a reversed phase high performance liquid chromatography method based on the use of cyclodextrins as mobile phase additives to determine pterostilbene in blueberries[J].JChromatogr B Analyt Technol Biomed Life Sci,2011,879(15-16): 1091-1097.
DOI 10.3870/yydb.2014.01.008
Determination of Pterostilbene in Rat Plasma by High Performance Liquid Chromatography-Tandem Mass Spectrometry
GUO Run-zheng1,WU Chun-jiang1,ZHANG Yan1,HUANG Qi-hui1,LIHai-xia1,WANG Xu1,CAO Zhonghou1,MAO Yu-hua2,SHEN Jie2
(1.CDC of Changjiang River Administration and Navigational Affairs,General Hospital of the Yangtze River Shipping,Wuhan 430019,China;2.Ministry of Education Key Laboratory of Environment and Health,School of Public Health,TongjiMedical College,Huazhong University ofScience and Technology,Wuhan 430030,China)
Objective To establish a liquid chromatography-tandem mass spectrometry(LC-MS/MS)method for determination of pterostilbene in rat plasma.MethodsThe plasma samples were extracted with ethyl ether and then separated on Thermo Hypersil Gold column(2.1 mm×50 mm,5.0μm),and guarded by a Thermo C18column(4 mm×3.0 mm, 10.0μm).Themobile phase consisted of acetonitrile-water(containing 1 mmol·L-1ammonium formate)as gradient elution, and the flow rate was 0.3 mL·min-1.The injection volume was 10μL and resveratrol was used as the internal standard(IS). Electrospray ionization(ESI)source was applied and operated in a negativemode usingmultiple reaction monitoring(MRM). Pterostilbene and trans-resveratrol were detected on MRM by transition from the precursor to production(m/z255.1→240.2 and 227.1→143.0).The total run time was 5 min.ResultsThe retention time of pterostilbene and resveratrol was 2.07 and 1.90min,respectively.No endogenous interfering peaks were observed.The linearity was obtained within the range of 1-100 ng·mL-1.The precision(RSD)of inter-and intra-day was less than 15%and the accuracy was 103.1%,98.12%and 93.23%at low,mid,and high concentrations(3,50,80 ng·mL-1),respectively.The extraction recovery of pterostilbene was 78.6%,80.3%and 83.2%,respectively,and nomatrix effectwas observed.ConclusionThemethod is simple,sensitive, accurate and reliable,which is suitable for pharmacokinetics study of pterostilbene.
Pterostilbene;Chromatography-tandem mass spectrometry,high performance liquid;Plasma concentration
R282.71;R965
A
1004-0781(2014)01-0027-04
2013-01-07
2013-06-17
*国家自然科学基金资助项目(21177046)
郭润正(1957-),男,浙江宁波人,高级工程师,硕士,研究方向:卫生检验。电话:(0)15342601717,E-mail:guorunzheng2013@163.com。
