大豆查尔酮还原酶基因CHR1的功能研究
2014-05-10吴楠王丕武李丹代力强郑成忠卢实才源张卓曲静夏海丰
吴楠,王丕武,李丹,代力强,郑成忠,卢实,才源,张卓,曲静,夏海丰,2
1. 吉林农业大学农学院,长春 130118;
2. 通化市农业科学研究院,梅河口 135000
大豆苷元是大豆异黄酮(Soybean Isoflavone)的主要成分之一[1],在大豆(Glycine max)苗期胚轴中含量最高,可达到异黄酮含量的 30%; 同时也是大豆中重要的生理活性物质,可以提高大豆对致病菌类微生物的抗性[2,3]。现代医学研究表明,大豆苷元同样可以调节人体的多项生理功能,具有预防和治疗心脑血管疾病、预防乳腺癌和激素依赖性肿瘤[4]以及骨质疏松[5]和雌激素样[6]等。因此,利用分子生物学手段研究大豆苷元合成及调控具有重要的意义。
查尔酮还原酶 (Chalcone reductase,CHR)是大豆苷元合成的关键酶之一。CHR能与查尔酮合成酶(Chalcone synthesis,CHS)联合作用催化合成异甘草素[7],其是合成大豆苷元必要的前体化合物。刘江等[8]从栽培大豆中克隆得到第14号染色体上一个编码大豆查尔酮还原酶的 GmCHR,并通过与豆科中其他查尔酮还原酶基因相比可知,CHR在豆科植物基因组中以多基因形式共同存在,并能够联合调节合成异甘草素,因此,对不同类型的 CHR进行分析有助于明确其在催化过程中的效率及相互调控关系。
RNA干扰(RNA interference,RNAi)是指利用小的双链RNA高效特异阻断特定基因的表达,使其在转录后水平上促使mRNA降解,达到基因沉默的效果,进而确定该基因的功能。本文构建了大豆查尔酮还原酶基因1(CHR1)的RNAi植物表达载体[9]并转化大豆,通过对转基因大豆中 CHR1的表达量及其催化产物的检测,分析 CHR1对大豆苷元合成的影响,初步验证 CHR1的催化功能与效率,为利用转基因技术提高大豆苷元含量、改良大豆的抗病性[10]提供了理论依据,并为 CHR1在基因工程中的高效利用奠定了基础。
1 材料和方法
1.1 材料
大豆种子吉农28、大肠杆菌DH5α菌株、农杆菌EHA105菌株、克隆重组载体pMD18-T-CHR1、表达载体pCPB、克隆载体 pMD18-T均由吉林农业大学植物生物技术中心提供与保存。
1.2 方法
1.2.1 目的片段的获得
以已知CHR1(GenBank登录号:X55730.1)的重组克隆载体pMD18-T-CHR1质粒为模板,利用特异性引物CZS/CZAS和CFS/CFAS(序列见表1,由北京三博远志生物公司合成)扩增得到目的片段,测序后在NCBI上进行序列比对,该基因含有两个内含子。本研究选择该基因带有内含子的序列扩增正、反义片段,大小404bp,其中正反义各323bp,内含子81bp,用于形成茎环结构。
PCR扩增体系为 25μL,包括:2.5μL MgCl2,2.5μL Buffer,1μL 特异性引物 CZS/CZAS 或CFS/CFAS(表 1),1μL 模板,0.5μL dNTP,0.2μL Taq聚合酶(PCR扩增试剂为TaKaRa公司产品),无菌水补充至25μL。扩增条件:94℃预变性10 min; 94℃变性45 s,51℃复性45 s,72℃延伸45 s,35个循环;最后再72℃延伸10 min,4℃保存。PCR产物经1%的琼脂糖凝胶电泳,回收(DNA凝胶回收试剂盒为TaKaRa公司产品)后与 pMD18-T载体连接,获得重组克隆载体pMD18-T-CHR1并转化大肠杆菌感受态细胞 DH5α,挑取单克隆菌落,提取质粒后由北京三博远志生物技术公司进行测序。
1.2.2 RNA干扰表达载体的构建
PCR扩增带有内含子的正反义片段,扩增产物经 1%的琼脂糖凝胶电泳,回收纯化目的片段并将正义片段与基础表达载体 pCPB同时用 XbaI和BamHⅠ(限制性内切酶为TaKaRa公司产品)进行双酶切,回收载体和正义片段,按体积比为 1:3进行连接,连接体系如下:12μL目的片段,4μL载体,1μL T4 连接酶,2μL T4 Buffer,1μL ddH2O。22℃反应过夜。此时得到的载体命名为pCPB-Z。

表1 引物信息
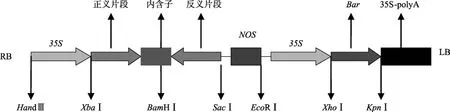
图1 RNA干扰载体结构图
采用同样的方法,用 SacⅠ和 BamHⅠ双酶切,将反义片段连接入 pCPB-Z载体中,得到以抗除草剂 Bar基因为筛选标记的 RNA干扰表达载体pCPB-CHR1-RNAi。对该载体进行PCR检测及双酶切鉴定。载体构建图如图1所示。
1.2.3 大豆的遗传转化
本文采用农杆菌侵染大豆子叶节方法[11,12]将构建好的pCPB-CHR1-RNAi的质粒DNA转入受体大豆品种“吉农28”中,并获得转化植株。
1.2.4 转基因植株的后代检测
1.2.4.1 PCR检测 按抗除草剂基因Bar(552bp)、启动子35S(500bp)的基因序列分别用primer 5.0软件设计引物BarS/BarAS和35S/35AS(表1)。取幼嫩转化大豆植株叶片,用 CTAB法[13,14]提取基因组并进行PCR检测,并以未转化的受体大豆叶片基因组作为阴性对照。Bar基因的PCR扩增体系为25μL,扩增条件为:94℃预变性5 min; 94℃变性40 s,60℃复性40 s,72℃延伸40 s,30个循环; 最后72℃再延伸8 min,4℃保存。35S基因的PCR扩增体系为25μL,扩增条件为:94℃预变性5 min; 94℃变性30 s,55℃复性30 s,72℃延伸30 s,40个循环; 最后72℃再延伸8 min,4℃保存。PCR产物经1%的琼脂糖凝胶电泳检测后,将目的片段回收并测序。
1.2.4.2 转基因植株的Southern blotting检测 提取 PCR检测为阳性的 T1代转化植株叶片的基因组DNA,用限制性内切酶BamHⅠ 酶切,以纯化的 35S作为探针,使用 DIG DNA Labeling and Detection Kit I试剂盒(罗氏公司产品),按照说明书标记探针,制备样品、转膜、杂交、洗膜、染色显影等程序,进行Southern blotting检测。
1.2.4.3 转基因植株的荧光定量PCR检测 提取经 Southern blotting检测出现阳性信号的转基因植株的叶片RNA,反转录得到cDNA,5倍稀释后待用。设计荧光定量PCR引物QCHR1和QACHR1(表1)。选择大豆肌动蛋白 β-actin基因(GenBank登录号:NM_001252731.2)为内参基因,设计定量 PCR引物QFACT和QRACT(表1)。利用Mx 3000P荧光定量PCR仪(吉泰生物科技公司产品)对大豆叶片组织总RNA进行分析[15,16]。按照SYBR Premix Ex TaqTM试剂盒说明操作(TaKaRa公司产品),PCR扩增体系为 25μL:2×SYBR Premix Ex Taq 聚合酶 12.5μL,QCHR1 引物 1μL,QACHR2 引物 1μL,模板 2μL,无菌水补至25μL。两步法PCR扩增条件:95℃预变性3 min; 95℃变性10 s,60℃反应35 s,40个循环。根据公式计算:

分析目的基因的相对表达量。
1.2.5 CHR1基因表达产物异甘草素的测定
利用高效液相(HPLC)对异甘草素的含量进行测定,高温干燥处理转化的大豆叶片组织并选择同品种未转化的大豆植株叶片作为对照,各称取干重0.5 g,用液氮研磨至细小粉末状并溶于的甲醇溶液中(4:1,体积比),超声波处理进一步破坏叶片组织(40℃,50 min,功率显示70%)之后浸泡过夜。过滤除去不溶的杂质,蒸发脱去萃取溶液中的溶剂,再加入乙醋酸盐缓冲液充分溶解提取物,使溶液 pH值稳定在5,同时加入适量的纤维素酶,37℃条件下反应过夜,确保除去所有修饰异甘草素糖苷的糖基。然后采用乙酸乙酯进行萃取酶水解液中的配基异甘草素,再将乙酸乙酯萃取。样品溶解于甲醇溶液中,用0.22μm有机滤膜抽滤,上样量为20μL,进行高效液相色谱定量分析[19,20]。
2 结果与分析
2.1 大豆查尔酮还原酶基因CHR1正反义片段的克隆和RNA干扰表达载体构建
以本实验室已克隆的pMD18-T-CHR1质粒为模板,利用其特异性引物 CZS/CZAS和 CFS/CFAS(表1)分别扩增带有内含子的正反义片段,扩增片段长度为404bp,其中正反义片段各323bp,内含子81bp; 将扩增片段重组到pCPB,构建成干扰表达载体pCPB-CHR1-RNAi。XbaⅠ/BamHⅠ双酶切鉴定得到404bp带有内含子的正义片段,BamHⅠ/SacⅠ双酶切得到404bp带有内含子的反义片段。
2.2 T1代转基因植株的获得及检测
2.2.1 T1代植株的PCR检测
将pCPB-CHR1-RNAi干扰载体转入受体大豆品种“吉农 28”中,经 PCR检测得到 4株 T0代阳性植株。收获 T0代种子37粒,室内种植后得到T1代植株,提取基因组DNA,利用抗除草剂 Bar基因和35S基因的特异性引物进行 PCR检测,以重组表达载体 pCPB-CHR1-RNAi的质粒 DNA为阳性对照,未转化的受体大豆植株作为阴性对照,检测结果如图2所示。
由图2可知,从T1代转基因植株中扩增出的条带与目标基因大小一致(552bp,500bp),初步证明外源基因已整合进大豆基因组中,PCR扩增结果显示T1代共获得13株转基因阳性植株。
2.2.2 T1代阳性植株的Southern blotting检测
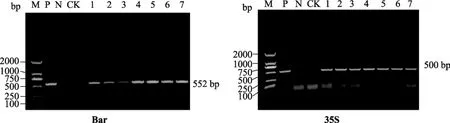
图2 T1代阳性植株抗除草剂Bar及35S的检测
分别提取PCR阳性植株的基因组DNA,用限制性内切酶BamHⅠ酶切,以35S为探针,进行Southern blotting检测。如图 3所示,未转化植株没有出现杂交信号,检测的转基因植株中有 3株出现明显的杂交信号,共获得7株经Southern blotting检测为阳性的植株。表明功能元件以单拷贝的形式整合到受体大豆基因组中,但整合位点不相同。
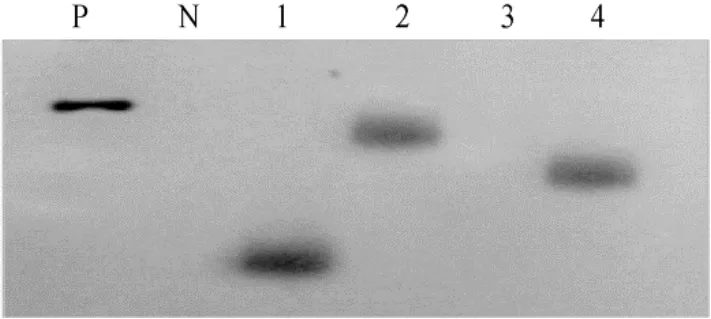
图3 T1代转基因植株Southern杂交检测
2.2.3 T1代转基因植株荧光定量PCR检测
以SYBR Green I为染料,经Southern blotting检测为阳性的转基因植株进行qRT-PCR检测。如图4所示,转基因大豆植株中CHR1基因mRNA的相对表达量与受体植株相比有明显的差异,且不同转化植株间CHR1基因的表达变化量差异也较大。2~8号转基因植株的干扰效率分别为:97.88%、98.09%、78.02%、98.33%、65.78%、56.98%、91.76%,其中5号植株干扰效率最高。
2.3 T1代转基因植株异甘草素含量的测定
对 CHR1调控的代谢产物异甘草素的含量进行检测,通过 HPLC检测 5号转化大豆植株异甘草素的含量。如图 5所示,转化植株叶片组织中异甘草素的含量为 0.979μmol/g,未转化植株异甘草素的含量为1.597μmol/g,其含量降低了38.7%。

图4 CHR1基因相对表达量
2.4 CHR1基因编码蛋白的预测
根据 EsPASy和 InterPro的分析结果,预测CHR1基因编码含有315个氨基酸残基的蛋白产物,分子量为 35489.8 Da,理论等电点 pI=6.32。根据CHR1的氨基酸序列分析可知,在49~66和152~169处含有两个阿尔多/酮(AIdo/keto)还原酶家族的特征性催化位点(Aldo/keto reductase family signature 1 and Aldo/keto reductase family signature 2),在262~277处含有一个阿尔多/酮(AIdo/keto)还原酶家族可能的特征性活性结合位点(Aldo/keto reductase family putative active site signature),预示该蛋白可能属于阿尔多/酮(AIdo/keto)还原酶蛋白。同时构建CHR1基因表达产物结构图(图6),含有典型的特征性的阿尔多/酮(AIdo/keto)还原酶催化位点的折叠结构,进一步证明了CHR1基因表达产物的催化功能。

图5 异甘草素HPLC检测图
3 讨 论
研究显示,查尔酮还原酶是由多基因家族组成的[21,22],对于不同的CHR基因的功能和效率、相互之间的关系,需要进一步深入的研究。Shimada等[23]从百脉根中克隆出与查尔酮还原酶同源的聚酮还原酶基因,在牵牛花中过表达,证明其促进异甘草素的形成。Xu等[23]对蒙古黄芪AmCHR进行克隆,结果表明AmCHR在根、茎、叶中均有表达,在根中优势表达。刘江等[23]从栽培大豆南农1138-2中克隆出GmCHR序列,构建过表达载体并对大豆进行遗传转化,通过组织表达分析结果显示,GmCHR在大豆叶片中表达量最高。本研究结果显示,CHR1基因在大豆的叶片部位的表达量最高,其次为根部。

图6 CHR1基因表达产物的3D立体结构预测图
利用农杆菌介导法将功能元件转入受体大豆基因组中,Southern blotting检测说明功能元件以单拷贝形式整合到大豆基因组当中,荧光定量PCR检测CHR1基因 mRNA的表达量,最高下降98.33%,而HPLC检测 CHR1调控的代谢产物异甘草素的含量仅下降38.7%,可能的原因有待进一步研究。
[1]毛峻琴,宓鹤鸣. 大豆异黄酮的研究进展. 中草药,2000,31(1): 61–64.
[2]Subramanian S,Graham MY,Yu O,Graham TL. RNA interference of soybean isoflavone synthase genes lead to silencing in tissues distal to the transformation site and to enhanced susceptibility to Phytophthora sojae. Plant Physiology,2005,137(4): 1345–1353.
[3]Screevidya VS,Srinivasa Rao C,Sullia SB,Ladha JK,Reddy PM. Metabolic engineering of rice with soybean isoflavone synthase for promoting nodulation gene expression in rhizobia. J Exp Bot,2006,57(9): 1957–1969.
[4]Choi EJ,Kim GH. Daidzein causes cell cycle arrest at the G1 and G2/M phases in human breast cancer MCF-7 and MDA-MB-453 cells. Phytomedicine,2008,15(9): 683–690.
[5]任萍,季晖,陈秀英,韩景超,邵卿,濮祖茂. 大豆苷元磺酸钠对维甲酸诱导大鼠骨质疏松的保护作用. 中国骨质疏松杂志,2006,12(6): 623–626.
[6]郑高利,张信岳,郑经伟,孟倩超,郑东升. 葛根素和葛根总异黄酮的雌激素样活性. 中药材,2002,25(8):566–568.
[7]Welle R,Schroder G,Schiltz E,Grisebach H,Schroder J.Induced plant responses to pathogen attack analysis and heterologous expression of the key enzyme in the biosynthesis of phytoalexins in soybean. Eur J Biochem,1991,196(2): 423–430.
[8]刘江,陈沛,邢光南,赵团结,李艳,盖钧镒. 大豆查尔酮还原酶基因 GmCHR的克隆与植物表达载体构建.大豆科学,2013,32(2): 139–142.
[9]付永平,周海涛,王丕武. 大豆种子特异性启动子的克隆及功能分析. 西北农林科技大学学报,2009,37(12):105–111.
[10]Graham TL,Graham MY,Subramanian S,Yu O. RNAi silencing of genes for elicitation or biosynthesis of 5-deoxyisoflavonoids suppresses race-specific resistance and hypersensitive cell death in Phytophthora sojae infected tissues. Plant Physiology,2007,144: 728–740.
[11]Zhu CF,Wu JH,He CZ. Induction of chromosomal inversion by integration of T-DNA in the rice genome. J Genet Genomics,2010,37(3): 189–196.
[12]Zhu QH,Ramm K,Eamens AL,Dennis ES,Upadhyaya NM. Transgene structures suggest that multiple mechanisms are involved in T-DNA integration in plants. Plant Sci,2006,171(3): 308–322.
[13]杨金慧,王丕武,曲静,王巍,王俊玲. BADH/pepB 双价基因无选择标记表达载体转化苜蓿的初步研究. 中国草地学报,2009,31(4): 20–23.
[14]王关林,方宏筠. 植物基因工程原理与技术. 北京: 科学出版社,2002: 742–744.
[15]付春华,陈孝平,余龙江. 实时荧光定量PCR的应用和进展. 激光生物学报,2005,14(6): 466–471.
[16]刘冰峰,张延明,闫玉清,徐香玲. 利用实时荧光定量PCR技术检测转基因烟草. 哈尔滨师范大学自然科学学报,2005,21(1): 69–72.
[17]Livak KJ,Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod. Methods,2001,25(4): 402–408.
[18]Schmittgen TD,Livak KJ. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc,2008,3(6):1101–1108.
[19]阮洪生,葛文中,安红波. 高效液相色谱法测定豆粕中染料木素和大豆苷元的含量. 大豆科学,2006,25(4):461–463.
[20]王哲,白志明,宋宏哲,田娟娟. 高效液相色谱法测定大豆异黄酮含量的研究. 中国油脂,2003,28(11): 82–84.
[21]Bomati EK,Austin MB,Bowman ME,Dixon RA,Noel JP.Structural elucidation of chalcone reductase and implications for deoxychalcone biosynthesis. J Biol Chem,2005,280(34): 30496–30503.
[22]Liu GY. Isolation,sequence identification and tissue expression profile of two novel soybean (Glycine max)genes-vestitone reductase and chalcone reductase. Mol Biol Rep,2009,36(7): 1991–1994.
[23]刘江. 大豆查尔酮还原酶基因GmCHR的克隆及农杆菌介导的大豆遗传转化的研究[学位论文]. 南京: 南京农业大学,2013.
