免疫荧光双标对肝细胞癌及癌旁异型增生肝细胞Ki-67与AMACR和RAS表达的定位分析
2014-05-10符雪莲王军臣
符雪莲,王军臣,韩 扬,史 阳
(同济大学附属东方医院病理科,上海 200120)
肝细胞癌(hepatocellular carcinoma,HCC)的发生是多因素、多步骤、多基因参与的复杂过程[1]。α-甲酰基-辅酶A消旋酶(alpha-methylacyl-coenzyme A racemase,AMACR/P504s)最早发现是诊断前列腺癌的分子标志物[2]。采用多瘤组织芯片免疫组化检测发现[3],AMACR不仅在前列腺癌中高表达,在肾细胞癌肝癌中也有表达,AMACR在肝细胞癌中的阳性率为81%。肝硬化是HCC发生的高危病理因素,RAS基因信号参与了肝硬化肝细胞异型增生癌变过程中肝酶变化和细胞增殖的调节机制[4]。为了研究AMACR和RAS在HCC发生中作用,本研究采用免疫荧光双标记的方法研究了HCC及其癌旁异型增生肝细胞中Ki-67的表达,及其分别与AMACR和RAS的原位定位关系。
1 材料与方法
1.1 病例的选择和组织芯片制作
采自2010至2012年东方医院肝脏手术切除病例,全部均经4%中性甲醛固定,石蜡包埋。共收集和分组如下:HCC组织90例,癌旁肝组织90例,另取正常肝组织20例对照。制作组织芯片,组织芯直径0.2 cm。制作组织芯片切片,厚度为4 μm。
1.2 免疫荧光双标记试剂
选购抗AMACRA单克隆抗体(克隆号P504s,小鼠单抗,DAKO公司产品),RAS单克隆抗体(克隆号D1712,小鼠单抗,Abnova公司产品),Ki-67单克隆抗体(克隆号 RB9043-PO,兔单抗,Thermo公司产品);采用简洁免疫荧光标记,二抗抗小鼠 IgG(H+L),Fab'片段(Alexa Fluor@555 Conjugat),红色荧光,抗兔 IgG(H+L),Fab'片段(Alexa Fluor@555 Conjugat),绿色荧光。按照说明书推荐的条件和我室常规的步骤进行免疫荧光组织化学反应。
1.3 免疫荧光检测癌与癌旁肝异型增生肝细胞Ki-67、RAS和AMACR的表达
分别采用免疫荧光双标记在组织芯片上检测HCC与癌旁肝异型增生肝细胞Ki-67和AMACR的表达,以及Ki-67和RAS的表达。随机完整切片验证实验结果。免疫荧光组织化学操作方法按照说明书推荐的程序进行,并按本室以往的工作流程稍加改进。反应完毕后置于激光共聚焦显微镜下观察,定位阳性细胞,每份样本固定位点分别拍摄单色照片,然后利用设备设置的程序自动合成照片,分析相互的表达定位。Ki-67定位于细胞核,AMACR为胞浆着色,RAS为膜浆阳性,阳性细胞数<5%视为阴性,阳性细胞数5% ~25%定义为灶性阳性,25%~50%定义为片状阳性,>50%且弥散分布定义为弥漫阳性。
1.4 统计学处理
采用SPSS 11.5软件进行统计学分析。率的比较采用χ2检验及精确χ2检验;AMACR和RAS表达的关系用Sperman相关分析。P<0.05为差异具有统计学意义。
2 结 果
2.1 HCC组织与癌旁肝组织中AMACR、RAS及Ki-67表达的比较分析
AMACR在HCC中的表达率高于正常对照组,在HCC组织中AMACR的表达多呈弥漫性分布,而在癌旁肝细胞中则呈现小灶性阳性和片状阳性,差异有统计学意义(P<0.05)。RAS在HCC中表达的阳性率高于癌旁肝组织,30%(27例)呈弥漫性高表达。统计学显示,AMACR和RAS弥漫性表达的分布特征呈正相关(r=0.416,P<0.05),见表1。
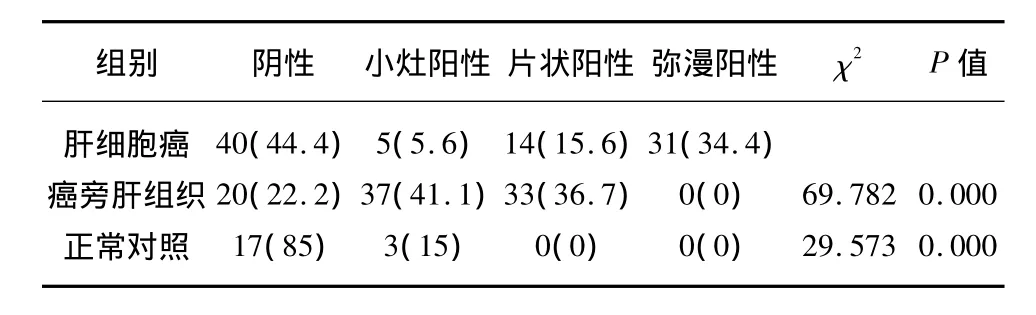
表1 AMACR在肝细胞癌及其癌旁组织中的表达Tab.1 Expression of AMACR in HCC and pericancerous tissue [n(%)]
进一步分析Ki-67在HCC及其癌旁组织中表达显示(见表2),HCC组织中显示Ki-67标记指数高,提示癌巢中的肿瘤细胞比癌旁异型增生肝细胞增殖活性高。
2.2 免疫荧光Ki-67分别与AMACR和RAS双标记染色
HCC及其癌旁异型增生肝细胞Ki-67和AMACR的表达以及Ki-67和RAS表达的激光共聚焦显微镜定位分析。红色信号代表AMACR,分布于细胞浆,绿色信号代表 Ki-67,定位于细胞核。HCC组织显示AMACR强阳性表达,并见大量Ki-67阳性细胞,提示癌细胞增殖活跃(图1B);癌旁异型增生肝细胞显示局灶性AMCR强表达,有少数Ki-67表达细胞,提示有一定增殖活性(图1C)。HCC组织RAS和Ki-67双标记,胞浆中等表达RAS蛋白,Ki-67阳性细胞较多见。实验结果显示,在肝细胞癌组织和癌旁异型增生的肝细胞中AMACR与Ki-67表达较一致。
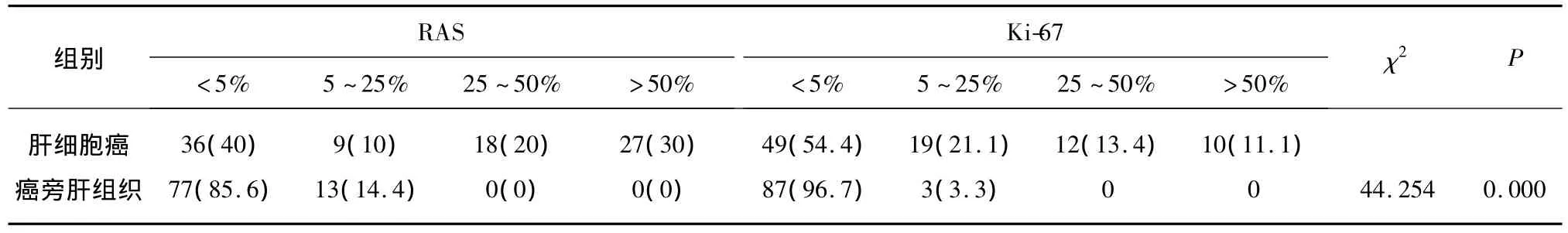
表2 RAS和Ki67在肝细胞癌及其癌旁组织中的表达Tab.2 Expression of RAS and Ki67 in HCC and pericancerous tissue [n(%)]
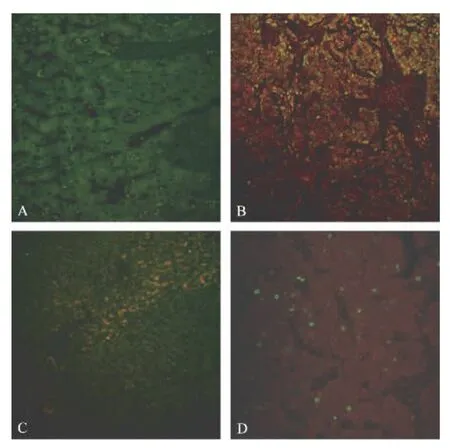
图1 免疫荧光Ki-67分别与AMACR和RAS双标记染色Fig.1 Double-labelled immunofluorescence staining(B and C:AMACR with Ki-67;D:RAS with Ki-67)
3 讨 论
AMACR参与HCC癌旁肝细胞异型增生至癌变的临床病理生物学行为相关的机制目前尚不清楚。已知AMACR在线粒体和过氧化酶体内参与脂肪酸支链及其衍生物的β氧化代谢过程中起重要作用[5-6]。已证明过氧化氢产物可引起基因和染色体异常,而中间代谢产物可致线粒体损伤,还可与过氧化酶体增殖物激活受体(peroxisome proliferatoractivated receptor,PPAR)结合[7]。PPAR 是细胞核受体转录因子家族成员之一,与其配体即过氧化酶体增殖物结合,可以激活PPAR调节路径,影响细胞的增生、分化和细胞内氧化剂的平衡,参与肿瘤的形成[8]。
本研究发现,HCC癌旁肝硬化组织中RAS的表达主要呈小灶性强表达,这一表达及分布特征与郑杰等[9]研究二乙基亚硝胺诱发大鼠肝癌变过程中N-ras、c-myc和Ha-ras基因及其蛋白原位表达的结果一致,有关机制有待阐明。
本组免疫荧光双标记显示,AMACR与RAS表达伴随细胞增殖活性变化趋势是一致的。HCC组织中AMACR呈弥漫强表达时,RAS也明显表达,其Ki-67标记的细胞增殖活性较高。统计分析提示,两者弥漫性表达的这种分布特征呈正相关。在癌旁肝组织,AMACR呈灶性强阳性表达,RAS也呈灶性弱表达,增殖活性较低。这可能与肝细胞癌变需要一个多步骤基因改变的蓄积过程和串话机制有关。RAS参与AKT/mTOR和Ras/MAPK信号机制的序贯机制[10],其信号通路活化将促进HCC发生。RAS还可能通过 Ras/Raf/ERK和 Ras/Raf/JNK信号通路影响细胞周期而促进细胞增生参与肿瘤的发生[11]。靶向RAS信号通路将可抑制肿瘤形成[11]。本组实验显示AMACR在HCC及其癌旁异型增生肝细胞中表达变化特征,与RAS的原位定位趋势一致,提示有可能AMACR参与RAS信号调控通路机制,从而促进肝细胞异型增生和HCC的发生。该假设有待基因调控实验进一步阐释。
[1] Bosch FX,Ribes J,Borras J.Epidemiology of primary livercancer[J].Semin Liver Dis,1999,19:271-285.
[2] Jing Z,Wu CL,Woda BA,et al.P504S/alphamethylacyl-CoA racemase:a useful marker for diagnosis of small foci of prostatic carcinoma on needle biopsy[J].Am J Surg Pathol,2002,26:1169-1174.
[3] Jiang Z,Fanger GR,Woda BA,et al.Exp ression of alpha-methylacyl-CoA racemase(p504s)in various malignant neoplasms and normal tissues:a study of 761 cases[J].Hum Pathol,2003,34:792-796.
[4] Martínez-López N,García-Rodríguez JL,Varela-Rey M,et al.Hepatoma cells from mice deficient in glycine N-methyltransferase have increased RAS signaling and activation ofliver kinase B1[J].Gastroenterology,2012,143(3):787-798.e1-13.
[5] Ferdinandusse S,Denis S,Li J,et al.Subcellular localization and physiological role of alpha-methylacyl-CoA racemase[J].Lip id Res,2000,41:1890-1896.
[6] Wanders RJ, Vreken P, Ferdinandusse S, etal.Peroxisomalfatty acid alpha-and beta-oxidation in humans:enzymology,peroxisomal metabolite transporters and peroxisomal diseases[J].Biochem Soc Trans,2001,29:250-267.
[7] Ockner RK,Kaikaus RM,Bass NM.Fattyacid metabolism and the pathogenesisofhepatocellular carcinoma:review and hypothesis[J].Hepatology,1993,18:669-676.
[8] Yeldandi AV,RaoM S,Reddy JK.Hydrogen peroxide generation in peroxisome p roliferator-induced oncogenesis[J].Mutat Res,2000,448:159-177.
[9] 郑杰,武忠弼,阮幼冰,等.二乙基亚硝胺诱发大鼠肝癌变过程中三种基因的原位表达[J].中华病理学杂志,1995,24(5):309-311.
[10] Wang C,Cigliano A,Delogu S,et al.Functional crosstalk between AKT/mTOR and Ras/MAPK pathways in hepatocarcinogenesis:Implications for the treat-ment of human liver cancer[J].Cell Cycle,2013,12(13):1999-2010.
[11] Zhang Z,Miao L,Lv C,et al.Wentilactone B induces G2/M phase arrest and apoptosis via theRas/Raf/MAPK signalingpathwayin human hepatoma SMMC-7721 cells[J] .Cell Death Dis,2013,4:e657.
[12] Jang JY,Lee YS,Jeon YK,et al.ANT2 suppression by shRNA restores miR-636 expression,thereby downregulating Ras and inhibiting tumorigenesis of hepatocellular carcinoma [J].Exp Mol Med,2013,10:45:e3.
