突触囊泡内吞的分子机制
2014-05-06张妮王世伟苟兴春
张妮,王世伟,苟兴春,2
(1.西安医学院基础医学研究所细胞生物学与转化医学研究室,陕西西安 710021;2.西安医学院基础与转化医学研究所,陕西西安 710021)
·综述·
突触囊泡内吞的分子机制
张妮1,王世伟1,苟兴春1,2
(1.西安医学院基础医学研究所细胞生物学与转化医学研究室,陕西西安 710021;2.西安医学院基础与转化医学研究所,陕西西安 710021)
突触传递是神经系统实现其功能的最基本的方式。神经细胞进行着快速的突触囊泡信息传递而没有耗尽突触囊泡,这主要依赖于突触囊泡在神经末梢进行着精确而快速的内吞作用。本文将主要介绍四种突触囊泡的回收分子机制,网格蛋白介导的经典途径、Kiss-and-run、Bulk endocytosis以及2013年12月在Nature上报道的超速内吞机制。
内吞;网格蛋白;Kiss-and-run;Bulk endocytosis;超速内吞
突触是神经元间信息传递的桥梁,包括突触前膜、突触后膜和突触间隙。突触传递是神经系统信息流通的最主要的方式。神经信号的跨突触传递是由突触囊泡通过胞吐释放神经递质实现的。突触囊泡从内吞体牙生后,神经递质在转运蛋白的介导下转运至突触囊泡中,充满神经递质的突触囊泡运送到突触前膜的活动区停泊,当神经冲动传至突触末端,钙离子内流触发神经递质释放,最终突触囊泡通过内吞作用重新回收进入到下一个循环中。神经细胞进行着快速的囊泡传递而没有耗尽突触囊泡,这主要依赖于突触囊泡在神经末梢进行着精确而快速内吞作用。详细的阐述突触传递的内吞机制对理解突触传递的特异性、可塑性以及学习和记忆都至关重要。本文将主要介绍四种突触囊泡的回收利用机制,网格蛋白介导的经典途径内吞机制、Kiss-and-run、Bulk endocytosis以及2013年12月在nature上报道的超速内吞机制(图1)。
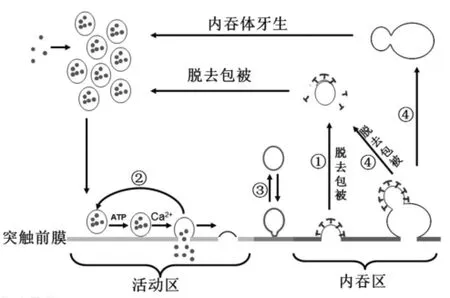
图1 突触囊泡内吞循环机制
1 网格蛋白介导的经典内吞机制
网格蛋白介导的内吞作用是突触囊泡膜回收利用的经典途径。按其发生的过程可分为网格蛋白包被组装、质膜内陷和凹窝形成、囊泡的剪切、去包被等过程。
1.1 网格蛋白包被组装(Clathrin coats)突触囊泡在活动区(Active zone)完全融合释放神经递质后,囊泡膜成分快速向内吞区移动,典型的内吞区和胞吐的活动区间隔1 μm。囊泡膜成分一旦移动到内吞区,连接蛋白AP-2(Adaptors 2)就可将其识别,触发网格蛋白和AP-180(Adaptors 180)、Stonin2、Epsin等其他连接蛋白协同形成网格蛋白包被[1-3]。网格蛋白包被由内外两层结构构成,外层的网格蛋白(Clathrin)和内层的连接蛋白(Adaptors)。网格蛋白是一个三脚复合体,可以组装成任何形状和网格,从而形成包被的外壳和主要支架。连接蛋白通过含有SH3结构域,BAR结构域,ENTH/ANTH、PH结构域等把网格蛋白包被与突触前膜磷酸肌醇(PI)丰富的区域紧密连在一起。
1.2 质膜内陷和凹窝形成(Coated pit maturation)网格蛋白包被形成后,被包被的小段膜在曲率蛋白作用下逐渐弯曲、内陷,形成凹窝。曲率蛋白包括所有参与网格蛋白包被的蛋白和其他含有α螺旋结构内吞蛋白、BAR结构域的F-BAR分子,以及其他影响细胞骨架因素的蛋白[4-5]。曲率蛋白通过直接或间接与脂质双分子层中相连,或者影响细胞骨架的因素,最终导致脂质双分子层的不对称性产生的而使质膜内陷,凹窝形成。体外实验和八目鳗的巨大神经突触进行微注射的实验研究发现,凹窝的形成不能由网格蛋白包被中的蛋白独立完成,需要包括Endophilin、Epsin在内的一些辅助因子参与[6-7]。突触前若微注射抗Endophilin、Epsin抗体,然后刺激囊泡释放,观察到内吞区出现大量微突起的包被凹窝堆积,囊泡的重新形成被抑制。其他的含有BAR-结构域的分子,如SNX9/SNX18、FCHo、Toca也被证明参与了质膜内陷凹窝形成的过程[8-9]。
1.3 囊泡的剪切(Fisson)被网格蛋白包被的凹窝在曲率蛋白的作用下获得足够的弯曲度后,要产生一个新的囊泡,需要具有GTP酶作用的Dynamin蛋白的作用。囊泡的剪切是一个需能量过程,Dynamin引起的GTP水解驱动剪切的进行[10]。凹窝与突触前膜连接的颈口处在Dynamin和Amphiphysin以及Endophilin等的作用下越变越窄。待凹窝缩缢进行到一定程度,Dynamin在颈口通过多聚化形成环带状结构,这种环带状结构能产生向内挤压的力量,在Amphiphysin和Endophilin等蛋白的帮助下,突触前膜与囊泡膜相连的颈口最终断裂,网格蛋白包被的囊泡从膜脱离。Dynamin是一个100 kD的GTP酶,Dynamin在囊泡剪切过程中的重要作用首次是在果蝇中发现的,破坏Dynamin表达后,尽管囊泡能与质膜继续融合,但是囊泡一直处在未成熟阶段,突触传递受到抑制。这一结果在小鼠的突触研究中也得到证实,在缺乏Dynamin1,或者Dynamin1和Dynamin3同时缺乏的情况下,阻止了凹窝的剪切,导致凹窝在神经元末端的聚集而阻碍了内吞作用,并且Dynamin1的高表达与突触前膜囊泡的产生分泌成正相关[11-12]。
1.4 囊泡去包被(Uncoating)囊泡被剪切后,迅速脱去网格蛋白包被,进入下一个突触囊泡循环。去除网格蛋白包被的过程是能量依赖性的,需要具有ATP酶活性的热休克蛋白(Hsc70)和其辅酶Auxilin、4,5-二磷酸磷脂酰肌醇(PIP2)的水解酶等协同作用裂解多边形的蛋白网格[13]。Hsc70本身表现出较低的ATP酶活性,它的酶活性能被一种辅助蛋白Auxilin激活。Auxilin是在神经末梢含量丰富的胞质蛋白,它帮助Hsc70与网格蛋白结合,从而停靠到网格蛋白包被上。PIP2的水解酶主要参与去除包被中的连接蛋白。最近的研究发现,基因敲除小鼠,苍蝇和蠕虫synaptojanin1基因,可在神经末梢观察到大量带包被的游离囊泡的聚集,同时神经末梢内突触囊泡的循环减弱;Synaptojanin1去磷酸化PIP2为磷酸肌醇4磷酸盐(PI4P),不仅去除网格蛋白包被的连接蛋白,而且能够产生Auxilin的结合位点,表明Synaptojanin1在去包被的过程中起到重要作用[13-14]。同时,Auxilin通过其含有的张力蛋白样结构域催化Synaptojanin1来调控网格蛋白去包被作用[13]。因此,Hsc70、Auxilin和Synaptojanin三者协同参与去包被的过程。
2 Kiss-and-run
Kiss-and-run机制首先是在1994年研究蛙神经肌肉节发现,神经递质释放后,囊泡膜未完全塌陷,仅形成纳米级瞬时的融合孔道释放神经递质,随后孔道关闭,突触囊泡在活动区回收利用,直接填充神经递质进入下一个突触囊泡循环。这一机制与网格蛋白介导的经典机制(20~30 s)中囊泡膜的完全塌陷不同,而且更迅速,整个过程大约只需要1 s,是突触囊泡回收的补偿途径。但是,2003年Nature杂志报道了两个研究小组的研究成果,他们用不同的荧光标记,追踪源自大鼠海马的神经元在接受单次电刺激后单个囊泡的变化,两个小组均得出如下结论:大量的神经递质释放活动涉及Kiss-and-run机制,而不是囊泡塌陷,表明Kiss-and-run机制并非只是突触囊泡回收的补偿机制[15-16]。最近的研究发现,中枢神经系统的神经元递质的释放过程同时存在Kiss-and-run和囊泡膜完全融合两种模式[17-19]。并且这两种模式在一定条件下可以相互转化,高浓度的Ca2+、高浓度的Ca2+联合Synaptotagmin-7可以逆转突触囊泡完全融合为Kiss-and-run中的不完全融合方式[20-21]。
Kiss-and-run的分子机制目前还不是很清楚,瞬间融合孔道的形成是SNARE复合体和细胞膜上其他因素相互作用的结果,这种相互作用未达到完全塌陷融合的阈值时形成瞬时融合孔[22-23]。最新的研究表明,肌动蛋白Action和MyosinⅡ与SNARE复合体相互作用参与调控瞬间融合孔道的形成[24-25]。Dynamin1被证实在Kiss-and-run机制中起到重要作用,但不是起突触囊泡剪切作用,而是在融合孔道处形成一个帽结构,抑制囊泡膜其他部位与突触前膜的继续融合,而且能与Action协同关闭瞬时融合孔道[17-25]。
3 超速内吞
2013年12月Nature上报道犹他大学和德国生物学家合作发现神经细胞循环利用囊泡的新机制——超速内吞[26-27]。用一个单刺激来刺激培养的海马神经细胞,然后迅速冰冻,用电子显微镜观察其亚显微结构。发现在刺激30 ms内囊泡停泊并与质膜融合,但并未发现完整的囊泡,而且观察到囊泡融合有广阔的开口,这表明超速内吞机制中囊泡膜完全融合。突触囊泡内吞作用发生在刺激50~100 ms之间,活动区和内吞区之间,并且在电镜下未看到明显的网格蛋白包被的形成。因此超速内吞是区别于网格蛋白介导的经典途径和Kiss-and-run机制的新发现第三种内吞作用机制。线虫中研究中也同样证实存在超快内吞这一新的机制[28]。
超速内吞作用受到肌动蛋白聚合和Dynamin调控。在应用肌动蛋白的聚合剂和Dynamin的抑制剂后,电镜照片显示在突触前膜上形成了巨大的融合囊泡,囊泡的剪切被抑制。
网格蛋白介导的经典途径中囊泡循环一次需要20 s,Kiss-and-run整个过程只需要1 s,而超速内吞机制整个过程只需1/10 s,比经典机制快200倍。超速内吞的发现者认为超速内吞在突触囊泡的回收中起到主要作用,没有此机制,人类就无法实现连续的思考和行动,而且这一过程可以保护神经元,防止肌萎缩性侧索硬化症和阿尔茨海默症等神经退行性疾病,帮助人类开发开发相应的治疗方式。
4 Bulk endocytosis
在中低强度刺激下,机体通过网格蛋白介导经典途径、Kiss-and-run、超速内吞机制回收突触囊泡。在较强刺激下,主要依赖于Bulk endocytosis进行突触囊泡的回收循环。Bulk endocytosis途径是一个可快速激活的大容量的内吞途径[29-30]。其主要过程为,在受到强刺激后,突触前膜内陷一大块胞膜,形成一个大的“内吞体”,在这个“内吞体”上生成一批囊泡,而且补充胞内内吞体,形成内吞体循环。Bulk endocytosis在哺乳动物中成熟的的神经突触末端表现为快速激活并且在刺激过程中终止,整个过程小于1 s,表现为一种快速的内吞过程;而在非哺乳动物中Bulk endocytosis刺激停止后仍然能够持续数分钟,表现为一种慢速的内吞过程。Bulk endocytosis途径的的分子机制仍然不清楚,体外实验证实F-BAR超家族和肌动蛋白参与了此机制。但这种机制不依赖于Dynamin1蛋白。即使在当网格蛋白介导的内吞作用严重受损,没有Dynamin1的作用下也能够发生。
5 展望
突触传递是神经系统实现其功能的最基本的方式。以往的研究表明,机体主要依靠网格蛋白介导的经典途径回收利用突触囊泡。而随着研究的不断深入,对这一理论提出了挑战。Kiss-and-run、超速内吞等高效快速内吞过程在囊泡的内吞作用中扮演了越来越重要的作用。但是,机体回收突触囊泡主要依赖于经典途径还是高效的快速内吞作用,亦或者两者均在突触囊泡的回收作用中起到重要作用,目前还不是很清楚,还需要进一步的研究探讨。
[1]Ford MG,Mills IG,Peter BJ,et al.Curvature of clathrin-coated pits driven by epsin[J].Nature.2002,419:361-366.
[2]Koo SJ,Markovic S,Puchkov D,et al.Snare motif-mediated sorting of synaptobrevin by the endocytic adaptors clathrin assembly lymphoid myeloid leukemia(calm)and ap180 at synapses[J].Proc NatlAcad Sci U SA,2011,108:13540-13545.
[3]Walther K,Diril MK,Jung N,et al.Functional dissection of the interactions of stonin 2 with the adaptor complex ap-2 and synaptotagmin[J].Proc NatlAcad Sci USA,2004,101:964-969.
[4]Antonny B.Mechanisms of membrane curvature sensing[J].Annu Rev Biochem,2011,80:101-123.
[5]Frost A,Perera R,Roux A,et al.Structural basis of membrane invagination by f-bar domains[J].Cell,2008,132:807-817.
[6]Jakobsson J,Gad H,Andersson F,et al.Role of epsin 1 in synaptic vesicle endocytosis[J].Proc Natl Acad Sci USA,2008,105: 6445-6450.
[7]Ringstad N,Gad H,Low P,et al.Endophilin/sh3p4 is required for the transition from early to late stages in clathrin-mediated synaptic vesicle endocytosis[J].Neuron,1999,24:143-154.
[8]Itoh T,De Camilli P.Bar,f-bar(efc)and enth/anth domains in the regulation of membrane-cytosol interfaces and membrane curvature [J].Biochim BiophysActa,2006,1761:897-912.
[9]Henne WM,Boucrot E,Meinecke M,et al.Fcho proteins are nucleators of clathrin-mediated endocytosis[J].Science,2010,328: 1281-1284.
[10]Ferguson SM,De Camilli P.Dynamin,a membrane-remodelling gtpase[J].Nat Rev Mol Cell Biol,2012,13:75-88.
[11]Lou X,Paradise S,Ferguson SM,et al.Selective saturation of slow endocytosis at a giant glutamatergic central synapse lacking dynamin 1[J].Proc NatlAcad Sci U SA,2008,105:17555-17560.
[12]Raimondi A,Ferguson SM,Lou X,et al.Overlapping role of dynamin isoforms in synaptic vesicle endocytosis[J].Neuron,2011,70: 1100-1114.
[13]Guan R,Dai H,Harrison SC,et al.Structure of the pten-like region of auxilin,a detector of clathrin-coated vesicle budding[J].Structure,2010,18:1191-1198.
[14]Milosevic I,Giovedi S,Lou X,et al.Recruitment of endophilin to clathrin-coated pit necks is required for efficient vesicle uncoating after fission[J].Neuron,2011,72:587-601.
[15]Gandhi SP,Stevens CF.Three modes of synaptic vesicular recycling revealed by single-vesicle imaging[J].Nature,2003,423:607-613.
[16]Aravanis AM,Pyle JL,Tsien RW.Single synaptic vesicles fusing transiently and successively without loss of identity[J].Nature, 2003,423:643-647.
[17]Zhang Q,Li Y,Tsien RW.The dynamic control of kiss-and-run and vesicular reuse probed with single nanoparticles[J].Science,2009, 323:1448-1453.
[18]Harata NC,Choi S,Pyle JL,et al.Frequency-dependent kinetics and prevalence of kiss-and-run and reuse at hippocampal synapses studied with novel quenching methods[J].Neuron,2006,49: 243-256.
[19]He L,Wu XS,Mohan R,et al.Two modes of fusion pore opening revealed by cell-attached recordings at a synapse[J].Nature,2006, 444:102-105.
[20]Ales E,Tabares L,Poyato JM,et al.High calcium concentrations shift the mode of exocytosis to the kiss-and-run mechanism[J].Nature Cell Biology,1999,1:40-44.
[21]Aoki R,Kitaguchi T,Oya M,et al.Duration of fusion pore opening and the amount of hormone released are regulated by myosin ii during kiss-and-run exocytosis[J].The Biochemical Journal,2010, 429:497-504.
[22]Bretou M,Anne C,Darchen F.A fast mode of membrane fusion dependent on tight snare zippering[J].J Neurosci,2008,28: 8470-8476.
[23]Shi L,Shen QT,Kiel A,et al.Snare proteins:One to fuse and three to keep the nascent fusion pore open[J].Science,2012,335: 1355-1359.
[24]Segovia M,Ales E,Montes MA,et al.Push-and-pull regulation of the fusion pore by synaptotagmin-7[J].Proc Natl Acad Sci USA, 2010,107:19032-19037.
[25]Trouillon R,Ewing AG.Actin controls the vesicular fraction of dopamine released during extended kiss and run exocytosis[J].ACS Chem Biol.2014[Epub ahead of print]
[26]Watanabe S,Rost BR,Camacho-Perez M,et al.Ultrafast endocytosis at mouse hippocampal synapses[J].Nature,2013,504:242-247. [27]Zhou L,McInnes J,Verstreken P.Ultrafast synaptic endocytosis cycles to the center stage[J].Dev Cell,2014,28:5-6.
[28]Watanabe S,Liu Q,Davis MW,et al.Ultrafast endocytosis at caenorhabditis elegans neuromuscular junctions[J].Elife,2013,2: e00723.
[29]Clayton EL,Evans GJ,Cousin MA.Bulk synaptic vesicle endocytosis is rapidly triggered during strong stimulation[J].J Neurosci, 2008,28:6627-6632.
[30]Clayton EL,Cousin MA.The molecular physiology of activity-dependent bulk endocytosis of synaptic vesicles[J].J Neurochem, 2009,111:901-914.
Molecular mechanism of synaptic vesicle endocytosis.
ZHANG Ni1,WANG Shi-wei1,GOU Xing-chun1,2.The Department of Cell Biology&Translational,School of Basic Medical Sciences,Xi'an Medical University,Xi'an 710021, Shaanxi,CHINA;2.Lab of Cell Biology&Translational Medicine,Xi'an Medical University,Xi'an 710021,Shaanxi, CHINA
Synaptic transmission is the most basic way for nervous system to realize its function.Neurons can sustain high rates of synaptic transmission without exhausting their supply of synaptic vesicles.This property relies on a highly efficient local endocytic recycling of synaptic vesicle membranes.This article summarizes four modes of synaptic vesicle endocytosis,which are clathrin-mediated endocytosis,kiss-and-run,bulk endocytosis and ultrafast endocytosis(reported in Nature in Dec.2013),with an emphasis on the underlying molecular mechanisms.
Endocytosis;Clathrin;Kiss-and-run;Bulk endocytosis;Ultrafast endocytosis
R329.2+6
A
1003—6350(2014)16—2404—04
10.3969/j.issn.1003-6350.2014.16.0937
2014-03-03)
陕西省科技厅科研经费资助项目(编号:2013JQ3017);陕西省教育厅科研项目资助项目(编号:11JK 0665;2013JK0757);西安医学院校基金(编号:10ZD01,12FZ23);陕西省大学生创新创业计划(编号:201211840013,201211840014)。
苟兴春。E-mail:gouxingchun@189.cn
