肠道干细胞移植对创伤后肠黏膜屏障功能障碍的影响
2014-05-03李云
李云
深圳市龙岗区南湾人民医院外科,广东 深圳 518000
肠道干细胞移植对创伤后肠黏膜屏障功能障碍的影响
李云
深圳市龙岗区南湾人民医院外科,广东 深圳 518000
目的:观察肠道干细胞移植对创伤后肠黏膜屏障的治疗作用,寻找肠道干细胞治疗肠黏膜屏障功能障碍的方法。方法:利用荧光激活细胞分类法将肠上皮干细胞分离,通过肠腔人工生物支架等组织工程方法建立理想的ISC移植模型,实现肠道干细胞的体外培养,并将体外分离培养的肠道干细胞群移植入放射性小肠损伤动物模型鼠肠腔中。结果:正常组大鼠小肠黏膜各层结构正常,绒毛排列整齐;模型组7天大鼠黏膜绒毛严重受损,脱落明显;治疗组7天黏膜破坏较少,黏膜增厚,逐渐恢复正常。同时对治疗组和模型组进行RIS评分比较,结果显示治疗组的黏膜损伤程度明显低于模型组(P<0.05)。结论:ISCs移植可促进损伤后肠黏膜的修复,肠道干细胞移植有望成为治疗某些肠道疾病的新方法。
肠黏膜屏障功能障碍;肠道干细胞;移植
正常肠黏膜屏障由机械屏障、化学屏障、免疫屏障、生物屏障构成,能有效阻止肠道内细菌和内毒素易位。机体在遭受各种创伤如放射性损伤后,肠黏膜屏障的结构将发生一系列病理生理变化,如肠黏膜萎缩、肠绒毛短而稀疏,可导致黏膜通透性增加,黏膜屏障功能障碍,使肠腔内细菌穿过肠黏膜屏障到达其他器官定植和过度生长,引发感染,甚至出现系统性炎症反应综合征(SIRS)和多器官功能障碍综合征(MODS),严重者可危及生命。因此,探索创伤(放射性损伤)后肠黏膜屏障功能障碍的有效治疗方法,减少其对机体的严重损害具有重要的临床价值。本研究拟利用荧光激活细胞分类法将肠上皮干细胞分离,然后通过肠腔人工生物支架等组织工程方法建立理想的ISC移植模型,实现肠干细胞体外培养,将体外分离培养的肠干细胞群移植入放射性小肠损伤动物模型鼠肠腔中,观察ISCs对放射性小肠损伤的修复作用,探讨治疗肠黏膜屏障功能障碍的新途径。
1 材料与方法
1.1实验试剂及仪器Hoechst33342、碘化丙啶溶液(均购自Sigma Corporation);兔抗musashi1多克隆抗体(Chemicon);HBSS溶液(Gibco);中性蛋白酶、Ⅲ型胶原(FACS420);流式细胞仪(美国BD公司),兔抗musashi-1多克隆抗体(Chemicon)。
1.2肠上皮干细胞的分离、鉴定及培养参照Dekaney CM等[1]方法:将小鼠空肠段剪碎至1 m m3大小,利用中型蛋白酶和Ⅲ型胶原将组织块消化,经70μm孔滤膜过滤后制成每100μL含1×106个细胞悬液;荧光染色剂Hoechst33342(浓度5mL),37℃孵育90分钟;再与FIT C标记的抗CD45抗体(滴度为1∶100)低温孵育10分钟,以区别造血干细胞,然后加浓度为2μg/m L碘化吡啶(PI)溶液4℃染色10~1 5分钟,以区别死亡细胞;接着在流式细胞仪上进行S P细胞分离,利用波长350nm紫外光源激发Hoechst33342和PI,450nm/30nm带通收集蓝光,670nm/30nm带通及655nm长通收集红光;575nm/26nm带通收集PI发射的红光。去除PI阳性死亡细胞后,收集、分离Hoechst33342阳性和阴性细胞。将肠道组织作为肠上皮干细胞的生长支架,参照StelznerM等[2]利用EDTA将小鼠小肠黏膜剥离,保留黏膜下组织,然后把分离的肠干细胞移植至经上述方法处理后的肠腔中。
1.3干细胞特性鉴定检测Musashi-lmRNA表达水平。培养细胞按RNeasy Mega总RNA提取试剂盒操作说明提取总R N A,以o l i g o d T j为引物,用逆转录酶逆转录cDNA,最后以逆转录的c D N A为模板;以上游引物5′C G A G C T C G A C T C C A A A A C A A T-3′,下游引物5′-G G C T T T C T T G C A T T C C A C C A-3′进行R T-P C R扩增;条件为:9 4 C 2 m i n变性,9 4 C l 5 S,5 3 C 3 0 S,7 2 C 3 0 S,扩增3 5个循环,P C R产物用1%琼脂糖电泳鉴定。
1.4放射性肠损伤动物模型的建立选用成年Wistar雌性大鼠30只,体质量240~260g。10%水合氯醛麻醉(3.5m L/kg),仰卧在特制的固定盒中,以X.S.S.Z250型深部X线机(贵阳医疗仪器厂生产)给予全腹部照射,大鼠腹部给予1 c m的组织补偿,从剑突到耻骨联合,照射面积为8.5cm×8.5cm,源皮距60cm,单次照射剂量5Gy,每隔7 2小时照射1次,共5次。
1.5动物分组将辐射大鼠随机分为ISCs治疗组、模型组、正常对照组各10只。ISCs治疗组大鼠分别于第3、4、5次照射后,当日尾静脉注射同种异体肠干细胞1mL,浓度为每100μL含1×106个细胞;正常对照组和模型组不做其他处理,于最后一次注射ISCs后第7天处死各组动物,免疫组化染色观察小肠黏膜结构。
1.6放射性肠损伤评分(RIS)对移植后第7天模型组大鼠进行R I S评分,分析放射性肠损伤黏膜组织形态变化,具体评分标准参照文献[3]。
1.7统计学方法采用SPSS18.0进行统计分析,计量资料采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1大鼠肠道干细胞的分离培养结果分离出CD44和Hoechst33342双阴性SP细胞占细胞总数的1.1%~2.1%,虽然高于肠上皮干细胞比例的理论数值(0.5%),却表明小鼠小肠段含有较丰富的肠上皮干细胞;新生小鼠来源的小肠黏膜单细胞悬液中包含的特定细胞群体即侧群细胞,染包液中加入维拉帕米后,侧群细胞被阻断后消失,经RT-PC R扩增,侧群细胞中显示有MSI-1 mRNA及蛋白的表达;新生小鼠的小肠黏膜侧群细胞富集小肠黏膜干细胞。
2.2各组大鼠小肠黏膜组织学观察结果正常组大鼠小肠黏膜各层结构正常,绒毛排列整齐;模型组7天大鼠黏膜绒毛严重受损,脱落明显,排列紊乱,隐窝结构破坏,间质明显水肿,炎性细胞浸润;治疗组7天黏膜破坏较少,黏膜增厚,绒毛逐步再生,逐渐恢复正常(见图1—2)。RIS评分显示治疗组大鼠黏膜损伤程度明显低于模型组(P<0.05),见表1。
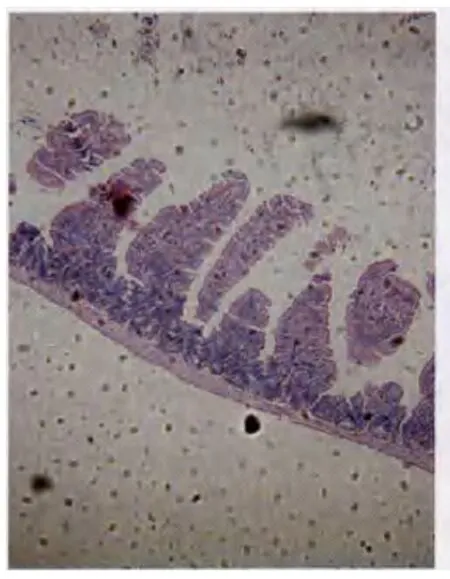
图1 损伤后的肠黏膜病理形态

表1 照射损伤后大鼠RIS评分

图2 ISCs移植后逐渐修复的肠黏膜形态
3 讨论
肠黏膜是更新很快的组织,目前认为肠道干细胞增生、分化是肠黏膜更新的主要细胞学基础。肠道干细胞参与肠道正常生理过程和一些病理过程,位于肠黏膜隐窝基底部,即基底隐窝是肠道干细胞的细胞库。肠上皮所有细胞均来自隐窝干细胞。肠上皮经历了艰难而又卓越的进化,增殖的隐窝和分化的绒毛折叠形成的“谷”和“脊”构成了独一无二的二维拓扑结构,这对于维持肠道屏障结构和功能的完整性以及损伤后的修复具有重要作用[4]。
近年研究表明肠道上皮存在一类组织特异性肠道干细胞(ISCs),ISCs具有长期自我更新潜能和产生至少一种终末分化细胞的能力[5],其中尤为突出的研究结果是揭示了肠上皮干细胞的持续增殖、分化,以及对促进肠道损伤后结构与功能修复的研究。已有研究证实体外存活生长的肠道干细胞可以被外来基因所转染,KawaguchiAL等[6]通过研究证实基因转染的IEC6细胞(来源于肠道隐窝的细胞)移植至网膜下或小肠内可以存活,并且迅速生长,采用聚碳酸酯膜作为载体,进一步研究发现[7]移植的肠道干细胞可持续生长并稳定表达基因产物,骨髓或干细胞移植对炎症性肠病有治疗作用。
随着细胞分选和基因标记技术的逐渐成熟,干细胞研究由原来的干细胞移植雏形-骨髓移植研究逐步发展成为一门新兴学科。作为机体内细胞更新最快的组织器官之一小肠,其干细胞的研究日益受到人们的关注。肠上皮干细胞具有终身自我更新的能力[8],由于小肠黏膜单层上皮细胞的简单结构和特有的昼夜更新节律,使得小肠干细胞成为继造血干细胞和皮肤干细胞之后新的研究热点。同时,由于部分肠道疾病导致的黏膜破坏,肠功能难以自我代偿,小肠干细胞移植为肠黏膜的再生和肠黏膜屏障功能的恢复提供了新的前景。前期研究通过“微克隆分析法”发现,肠道隐窝的某些细胞具有重建上皮的能力。肠道上皮损伤后,这些位于李培昆氏(1ieberkuhn)隐窝的干细胞具有很强的组织修复作用,以维持上皮的完整性。PottenCS等[9]报道,小肠放射性损伤模型的小肠隐窝干细胞在胰岛索样生长因子和肝细胞生长因子的作用下能够迅速分化修复损伤。将小鼠含有干细胞的隐窝“细胞团(organoid)”分离出来并接种到受体小鼠的皮下等部位后发现,这些细胞团能够形成新的黏膜样结构,并且具有一定的原始肠黏膜功能。通过组织工程技术将隐窝细胞团种植到小鼠腹腔内培育了新的原始小肠,并将这些原始小肠与正常小鼠空肠吻合。结果显示,这些新产生的小肠形态、增殖速度、解剖学特征以及转运功能等都与正常黏膜类似。这些实验的成功使肠道干细胞移植从基础到临床又迈进了一步。本研究利用荧光激活细胞分类法成功完成了肠上皮干细胞分离,然后通过肠腔的人工生物支架等组织工程方法建立了理想的ISC移植模型,为肠上皮干细胞提供良好的生长环境,实现肠干细胞的体外培养,并成功建立了放射性小肠损伤模型,将体外分离培养的肠干细胞群移植入放射性小肠损伤动物模型鼠肠腔中,通过免疫组化染色观察ISCs对放射性小肠损伤的修复作用,结果显示正常组大鼠小肠黏膜各层结构正常,绒毛排列整齐;模型组7天大鼠黏膜绒毛严重受损,脱落明显,排列紊乱,隐窝结构破坏,间质明显水肿,炎性细胞浸润;治疗组7天黏膜破坏较少,黏膜增厚,逐渐恢复正常,说明ISCs参与了放射性小肠损伤的修复过程。
当前对于胃肠道黏膜屏障的治疗主要集中于胃肠道黏膜屏障的保护方面,包括氧化剂、谷氨酰胺、短链脂肪酸以及微生态制剂等的应用,但随着损伤的进一步加重,单纯保守治疗常难以治愈。随着研究方法的不断进步,肠上皮干细胞的许多生物学特征将被揭示,可为提高消化道黏膜疾病(如吸收不良、溃疡和肿瘤等)的治疗水平奠定理论基础,也可为肠上皮干细胞的进一步应用提供理论指导。随着肠干细胞移植治疗及肠道黏膜屏障研究的不断深入,胃肠黏膜损伤,尤其是炎症性肠病等一系列自身免疫性疾病的治疗将不再是医学的难题。
[1]Dekaney CM,Rodri guez JM,GraulMC,etal.Isolation and characterization of a putativeint estinal stem cell fract i on fromm ouse j ej unum[J].G ast roent erol ogy,2005,129(5):1567-1580.
[2]St el zner M,Chen D C.To m ake a new i nt est i nal m ucosa[J].Rej uvenat i on Res,2006,9(1):20-25.
[3]Langberg CW,W al dron JA,Baker M L,et al.Si gni fi cance ofoveral lt reat m entt i m e fort he devel opm entof radi at i on i nduced i nt est i nalcom pl i cat i ons.A n experi m ent al st udy i n t he rat[J].Cancer,1994,73(10):2663-2668.
[4]Radt ke F,Cl evers H,Riccio0.From guthom eost asi s t o cancer[J].Curr M ol M ed,2006,6(3):275-289.
[5]付焱,刘志苏,江从庆.肠道干细胞标志物研究进展[J].临床外科杂志,2010,18(1):55-57.
[6]K aw aguchiA L,D unn JC,Fonkal srud EW.In vi vo grow t h oft ranspl ant edgenet i cal l yal t eredi nt est i nal st em cel l s[J].J Pedi at r Surg,1998,33(4):559-563.
[7]K hal i lPN,W ei l er V,N el son PJ.eta1.N onm yel oabl at i ve st em cel lt herapyenhancesm i croi rcul at i onand t i ssueregenerat i oni nm uri nei nfl am m at orybow el di sease[J].G ast roent erol ogy,2007,132(3):944-954.
[8]魏亚明,聂玉强,李瑜元,等.炎症性肠病及其干细胞移植再生修复[J].世界华人消化杂志,2006,14(13):1314-1317.
[9]Pot t en CS,El l i s JR.A dul t sm al l i nt est i nal st emcel l s:i dent i fi cat i on,l ocat i on,charact eri st i cs,and cl i nical appl i cat i ons[J].Ernst Scheri ng Res Found W orkshop,2006(60):81-98.
Effects of Intestinal Stem Cells Transplant on Dysfunction of Intestinal Mucosal Barrier after Trauma
LI Yun
Surgery Department of Nanwan People's Hospital in Longgang District,Shenzhen 518000,China
Objective:To find the method of intestinal stem cells(ISCs)in the treatment for dysfunction of intestinal mucosal barrier by observing intestinal stem cells for intestinal mucosal barrier after trauma.Methods:Intestinal epithelial stem cells were separated by fluorescence-activated cell sorting(FACS)method,the models for ISCs transplant were established by artificial frame of intestinal cavity to realize the cultivation of ISCs in vitro,ISCs cultivated in vitro could be transplanted to mouse model with radiation damage of small intestine.Results:The structures of different layers in the mucosa of rats in the normal group were normal,fine hairs were arranged in good order;the fine hairs of mucosa of rats in the model group were damaged severely,and dropped obviously;the damages of mucosa in the treatment group were less,the mucosa thickened,and returned to normal gradually.The treatment group and the model group were evaluated by RIS scale,the results demonstrated that the degree of mucosal damage in the treatment group was lower than that of the model group(P<0.05).Conclusion:Transplant of intestinal stem cells could promote the recovery of intestinal mucosa after the injury,and the transplant could be the new method of treating intestinal diseases.
dysfunction of intestinal mucosal barrier;intestinal stem cells;transplant
R457.7
A
1004-6852(2014)05-0009-04
2013-06-25
李云(1963—),男,硕士学位,副主任医师。研究方向:胃肠道肿瘤的诊治。
