腐殖酸和半胱氨酸对Shewanella oneidensis MR-1生物转化硫化汞的影响
2014-04-26司友斌安徽农业大学资源与环境学院安徽合肥230036
陈 艳,黄 潇,司友斌(安徽农业大学资源与环境学院,安徽 合肥 230036)
腐殖酸和半胱氨酸对Shewanella oneidensis MR-1生物转化硫化汞的影响
陈 艳,黄 潇,司友斌*(安徽农业大学资源与环境学院,安徽 合肥 230036)
研究了不同浓度腐殖酸和半胱氨酸条件下,铁还原菌Shewanella oneidensis MR-1对固态硫化汞的生物溶解和甲基化作用.结果表明,固态硫化汞的生物溶解量随加入腐殖酸浓度的增大而增加,当腐殖酸浓度为10mg/L时,固态硫化汞的溶解量约为3.35mg/L;在腐殖酸浓度为1~5mg/L范围内, S. oneidensis MR-1对硫化汞的生物甲基化率呈上升趋势,在5~10mg/L范围时呈下降趋势,其中生物甲基化率最大值约为10.55%;加入不同浓度半胱氨酸对菌株生物溶解固态硫化汞的影响不明显,但能增加S. oneidensis MR-1对硫化汞的生物甲基汞生成量,加速甲基化反应进程,使硫化汞的生物甲基化率提高至19.23%.该研究为自然水体生态系统中铁还原菌参与固态硫化汞生物溶解及生物甲基化提供了直接证据.
铁还原菌;硫化汞;生物转化;腐殖酸;半胱氨酸
汞是一种有毒的重金属物质,其有机化合物甲基汞能在生物体内,尤其是鱼体内[1]进行生物累积和生物放大,具有致神经毒性.甲基汞的产生主要发生在厌氧的沉积物和土壤中,经过微生物如某些硫酸盐还原菌[2]和铁还原菌[3]作用,将无机汞转化为甲基汞.Fleming等[4]报道分离出的铁还原菌菌株Geobacter sp. CLFeRB在纯培养时的汞甲基化率与硫酸盐还原菌相当.由此,铁还原菌(FeRB)对汞甲基化的研究成为近年来研究的热点.奥奈达希瓦氏菌(Shewanella oneidensis MR-1)为革兰氏染色阴性兼性厌氧细菌,是最先被阐明通过 Fe(Ⅲ)还原使有机物氧化获得生长能量的细菌,根据细菌16S rRNA基因的系统分析法, S. oneidensis MR-1已被认定为γ-变形菌门的亚群[5],属于铁还原细菌.
在自然界的沉积物和水环境中,有机质的浓度远高于汞污染物的浓度[6],二价汞离子能够与有机质形成结合能力很强的络合物,因为二价汞离子和有机质中的硫基、巯基官能团相结合[7],形成的络合物限制了微生物对汞离子的生物转化[8].但也有研究指出,二价汞离子与小分子量硫醇相结合时,如半胱氨酸,能够促进微生物对汞的甲基化[9].另外,硫化物与 Hg(Ⅱ)也有很强的结合能力,决定着汞化合物在厌氧环境下的各种形态.已有很多学者探索了 Hg(Ⅱ)、硫化物、有机质之间的相互作用,特别是 Hg(Ⅱ)在水环境中的迁移转化[10].
单质汞(Hg)存在于自然界中比较少,主要是以固态硫化汞(HgS)的形态存在,这种化合物亦称为汞砂,广泛存在于土壤和自然沉积物中,通常认为很难被微生物转化.但有相关研究指出,纳米颗粒HgS能够存在于水体表层及污染的沉积物中[11],且能够被甲基化微生物高效转化[12].已有很多研究探讨了 Hg2+和有机物质之间的相互作用,但铁还原菌S. oneidensis MR-1对固态硫化汞转化的研究却相对较少.本研究通过对铁还原菌S. oneidensis MR-1进行纯培养,在实验室模拟条件下,探讨S. oneidensis MR-1在不同浓度腐殖酸、半胱氨酸存在时,对固态硫化汞的生物溶解及生物甲基化作用的影响,以期为沉积物中汞污染防治提供科学依据.
1 材料与方法
1.1 实验材料
硫化汞(HgS)、甲基汞(MeHg),纯度 95%以上,均购于Merck公司.MeHg为溶于甲醇的1000mg/L贮备液,置于 4℃冰箱中用棕色瓶保存,所需稀溶液用超纯水依次逐级稀释.原子荧光的载流硝酸(HNO3)和还原剂硼氢化钾(KBH4)以及氢氧化钾(KOH)为优级纯,水为Mili-Q超纯水,其他试剂均为分析纯.
菌种来源:S. oneidensis MR-1由西北农林科技大学土壤微生物实验室提供.
S. oneidensis MR-1培养基(g/L):KH2PO4⋅7H2O 3.0, Na2HPO4⋅7H2O 12.8, NH4Cl 1.0, NaAc 2.0, 酵母抽提物2.0.
LB富集培养基(g/L):牛肉膏5.0,蛋白胨10.0, NaCl 5.0, pH=7.0;固体培养基再按1.5%~2%的比例加入琼脂粉,121℃灭菌30min.
1.2 实验方法
菌株的厌氧培养:在超净厌氧工作台上,高纯N2通过一个装有细菌过滤器的塑胶管充入装有培养液的棕色瓶中,充气15min后,快速拧紧瓶盖密封后置于30℃恒温培养箱中静置培养.
将1mL S. oneidensis MR-1菌悬液无菌操作接种至含有1mg HgS的液体培养基的棕色瓶中,使总体积约为20mL,形成HgS悬浮液,设计观察不同浓度腐殖酸和半胱氨酸对硫化汞生物溶解和生物甲基化的影响,厌氧处理后,恒温避光静置培养.培养时间为14d,分别于0,0.5,1,2,3,4,5,6,7,9, 11,13,14d取样,测定溶解态汞浓度及甲基汞含量.实验同时以不加S. oneidensis MR-1菌悬液作为对照.每处理3次重复.
1.3 样品处理与汞的测定
样品经过 4000r/min离心分离后,测定上清液中无机汞、甲基汞和总汞的含量.
1.3.1 无机汞和甲基汞的测定 上清液样品经25% KOH/甲醇溶液提取后,用0.22 µm滤膜过滤,再加入0.05mol/L TBABr(四丁基溴化铵)溶液混合衍生成络合物,然后进样测定[13].测定采用Agilent 1100 高效液相色谱仪,配可变波长紫外检测器和 HP化学工作站.色谱操作条件[14]: C18Hypersil ODS色谱柱(4.6mm×150mm, 5µm),流动相为含 0.01mol/L TBABr和 0.025mol/L NaCl的水溶液:甲醇=45:55(体积比),柱温 35℃,流速 1.0mL/min,检测波长为 225nm,进样量为20µL.
1.3.2 溶液中总汞的测定 采用 AFS-230E型双道氢化物发生原子荧光(北京科创海光仪器有限公司)测定总汞.样品经4000r/min离心15min,用0.22 µm滤膜过滤后,进行消解[15]:加入1.5mL硫酸, 1.5mL (1+1)硝酸, 4mL 5%高锰酸钾, 4mL 5%过硫酸钾,补充适量去离子水约至50mL,置沸水浴中 1h.临近测定时,边摇边滴加 20%盐酸羟胺溶液直到刚好使过剩高锰酸钾褪色及二氧化锰全部溶解为止,最后测定.
双道氢化物发生原子荧光操作条件[15]:空心阳极汞电流强度为24mA,仪器的负高压为280V,载气流氩气流速为400mL/min,载流中硝酸浓度为2%,氢氧化钾的浓度为10g/L,硼氢化钾浓度为5g/L.
2 结果与讨论
2.1 S. oneidensis MR-1对HgS的生物转化动力学
在S. oneidensis MR-1作用下,当腐殖酸浓度为5mg/L,初始pH值为7.0时,上清液中离子汞、甲基汞和溶解态总汞的浓度随时间的变化趋势如图1所示.其中上清液中测得的溶解态总汞浓度约等于离子汞和甲基汞浓度之和.在不加 S. oneidensis MR-1,其他条件相同时,上清液中检测到的溶解态汞最大值不超过20µg/L(实验数据未列出),而加菌处理后检测到的上清液溶解态汞是未加菌处理的 90倍之多.因此, S. oneidensis MR-1的存在明显促进了固态硫化汞在含腐殖酸溶液中的溶解.基汞含量约是未添加半胱氨酸处理的1.85倍,如图2所示.由图2可见,半胱氨酸的加入明显缩短了菌株对硫化汞生物转化的反应时间,其中溶解态总汞、无机汞和甲基汞浓度都在第2d达到最大值,且第 4d即达到反应平衡,其中菌株对固态硫化汞的甲基化率提高到19.16%.
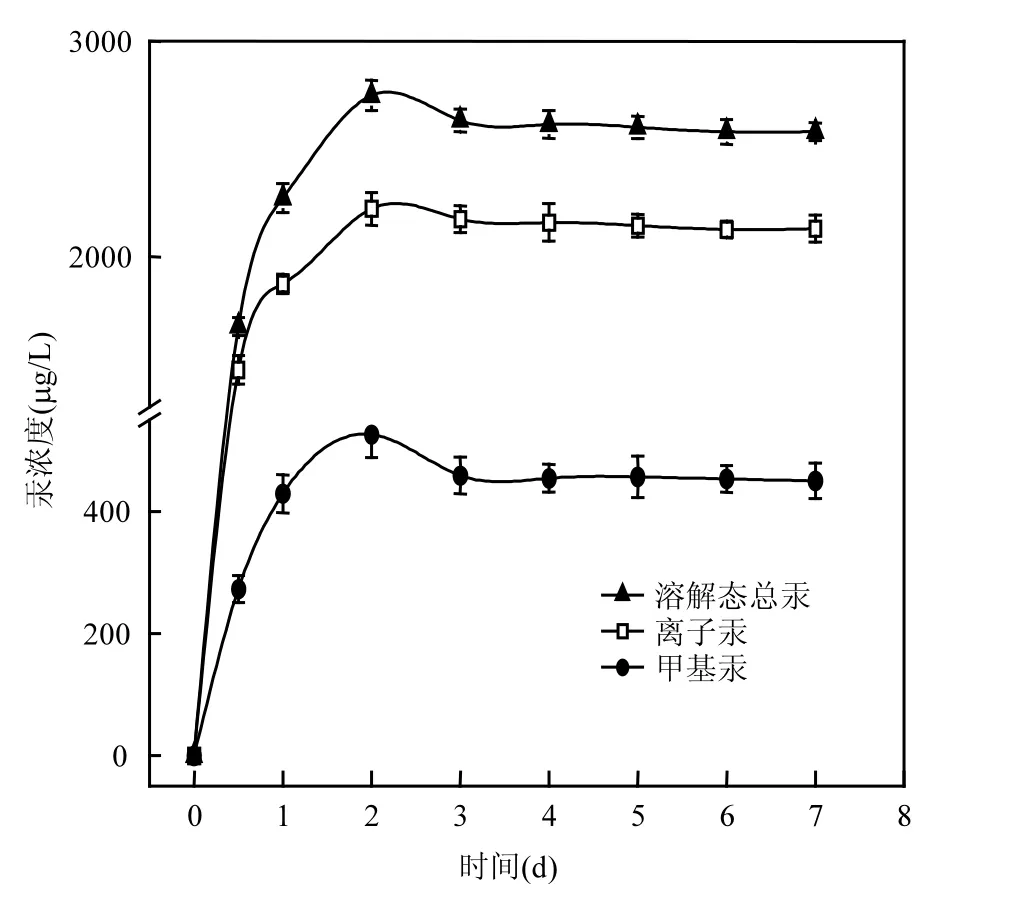
图2 半胱氨酸存在时S. oneidensis MR-1对HgS生物转化动力学Fig.2 Dynamics of HgS biotransformation by S. oneidensis MR-1in the presence of cysteine

图1 腐殖酸存在时S. oneidensis MR-1对HgS生物转化动力学Fig.1 Dynamics of HgS biotransformation by S. oneidensis MR-1in the presence of humic acid
由图 1可见,溶解态总汞和离子汞浓度在第3d达到最大值,甲基汞浓度在第2d达到最大值,之后都有略微下降,可能是汞挥发所致,至反应第9d达到稳定状态,其中汞甲基化率最大值约为10.55%.另外,当其他条件相同,溶液中添加300mg/L半胱氨酸时,上清液中溶解态总汞浓度变化较小,但能够促进菌株对硫化汞的甲基化,甲
2.2 S. oneidensis MR-1对HgS的生物溶解作用
2.2.1 腐殖酸(HA)对S. oneidensis MR-1生物溶解HgS的影响 在温度为30℃, pH 7.0,腐殖酸浓度分别为 1.0,3.0,5.0,10.0mg/L时,上清液中总汞浓度随时间的变化趋势如图 3所示. S. oneidensis MR-1对硫化汞的溶解量随着腐殖酸浓度的增大而增加,并在第 3d达到最大值,之后有略微下降,至第7d上清液中汞浓度不再变化达到平衡.其中有略微下降的原因可能是因为溶解态汞挥发所致,当腐殖酸浓度为 10mg/L时,上清液中检测到的最大溶解态汞浓度为3.15mg/L,是未添加腐殖酸时的114倍之多.这是因为HgS能够和 HA 中的硫醇官能团相结合,形成HgS-HA络合物,加强了溶液中固态硫化汞的溶解性. Haitzer等[16]认为腐殖质的芳香性和分子量大小影响着HgS和腐殖质之间的相互作用.相关研究
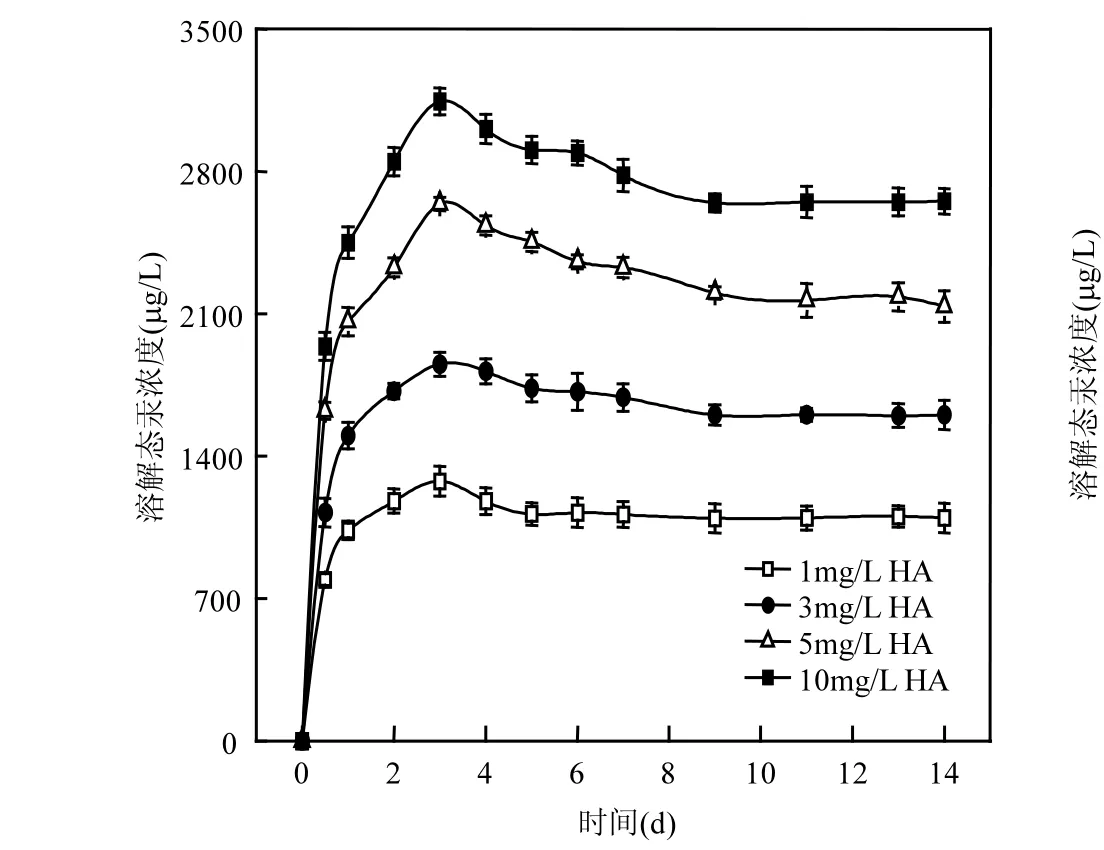
图3 腐殖酸(HA)对S. oneidensis MR-1生物溶解HgS的影响Fig.3 Effect of humic acid on HgS biological dissolution by S. oneidensis MR-1
[17-18]表明,腐殖质能够减缓HgS的聚合和结晶度,因此腐殖质能够通过减缓HgS的聚合、结晶速度来加强微生物对 HgS的生物转化.另外,HgS与腐殖质络合物结合强度与腐殖质本身颗粒物的大小密切相关,从而影响到HgS的溶解性[10]以及自然环境中甲基汞的生成量[19].不能明显地促进固态硫化汞的溶解.半胱氨酸是一种小分子量的氨基酸,含有还原性巯基,HgS可以和半胱氨酸的巯基结合形成HgS-Cys络合物,这一络合物的分子量较小,与HgS-HA相比较更有利于铁还原菌S. oneidensis MR-1对其的生物转化.此外,也有文献指出,半胱氨酸能够加强甲基化微生物对二价汞离子的生物转化,促进无机汞转化为甲基汞[9,20].
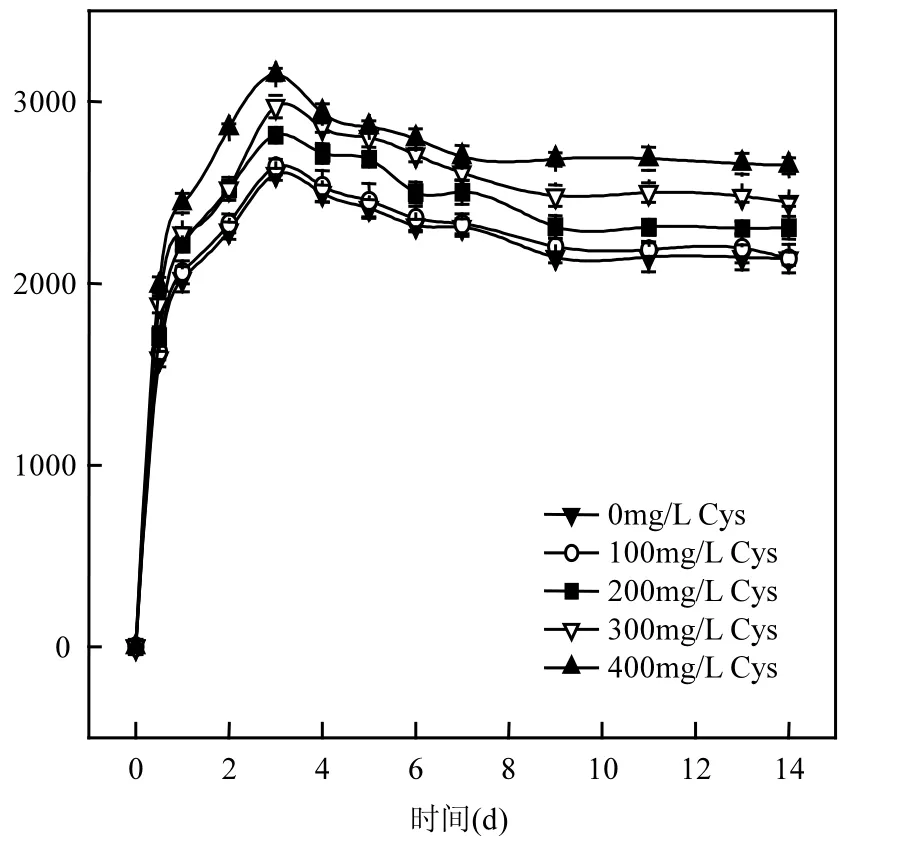
图4 半胱氨酸(Cys)对S. oneidensis MR-1生物溶解HgS的影响Fig.4 Effect of cysteine on HgS biological dissolution by S. oneidensis MR-1
2.2.2 半胱氨酸(Cys)对S. oneidensis MR-1生物溶解HgS的影响 在S. oneidensis MR-1作用下,当温度为30℃, pH 7.0,腐殖酸浓度为5mg/L,半胱氨酸浓度分别为 100,200,300,400mg/L时,上清液中溶解态汞浓度随时间的变化趋势如图4所示.上清液中溶解态汞浓度随半胱氨酸浓度的增加呈上升趋势,但上升幅度略小,而这略微上升的趋势主要是因为半胱氨酸的存在增强了 S. oneidensis MR-1对HgS的生物转化,增加了HgS的电离程度,并在第3d达到最大值,之后有略微下降,可能是溶解态汞络合物挥发所致,至第9d时达到平衡.当不添加腐殖酸,仅有不同浓度的半胱氨酸存在时,上清液中检测到的溶解态汞浓度很小,不超过20μg/L(数据未列出),因此得出半胱氨酸的存在并
2.3 S. oneidensis MR-1对HgS的生物甲基化作用
2.3.1 腐殖酸(HA)对S. oneidensis MR-1生物甲基化HgS的影响 当温度为30℃, pH 7.0,腐殖酸浓度分别为1.0,2.0,3.0,5.0,10.0mg/L时,上清液中甲基汞浓度随时间的变化趋势如图 5所示.在上清液中溶解态汞产生的同时,也检测出甲基汞的存在,并且甲基汞含量在第2d即达到最大值,之后含量随时间而逐步下降,至第9d达到平衡.
当腐殖酸浓度为 5mg/L 时, S. oneidensis MR-1对硫化汞的甲基化生成量最大,为284.5µg/L.腐殖酸浓度在 1.0~5.0mg/L时,上清液甲基汞呈上升的趋势;腐殖酸浓度在5.0~10.0mg/L时,上清液中甲基汞增加不多,上清液中甲基汞的含量并非随着腐殖酸浓度的增加而呈上升趋势.这是因为当腐殖酸浓度在 1.0~5.0mg/L时,上清液中第2~3d溶解态汞浓度为1.18~2.64mg/L, S. oneidensis MR-1在这个范围内活性较高,甲基化效率较好,达到10.55%;当腐殖酸浓度为5.0~10.0mg/L时,上清液中第 2~3d溶解态汞浓度为 2.33~3.35mg/L, S. oneidensis MR-1在这个汞浓度范围内其活性受到一定程度的抑制,甲基化效率降低.有很多研究发现,沉积物、水体和生物体中的甲基汞含量会随着可溶性有机质含量的升高而增加[21],尤其是芳香族有机物有利于汞的释放,能促进汞的甲基化.在湖泊沉积物中, MeHg含量与有机质变化趋势相近,MeHg含量的垂直分布均在表层富集,且随深度增加逐渐降低趋于稳定,且两者存在极显著性相关,说明有机质对湖泊沉积物MeHg的分布起到重要作用[22]. 2d达到最高值,第4d时达到反应平衡,未加入半胱氨酸处理,甲基汞的转化率约为10%,当半胱氨酸浓度为400mg/L时,第2d时上清液中甲基汞含量最高,为549.2µg/L,转化率达到19.23%.其中半胱氨酸含量从100mg/L增加到300mg/L时,甲基汞转化率明显提高,达到300mg/L后再增加半胱氨酸含量对汞甲基化率提高的作用不明显.半胱氨酸能够影响微生物细胞内汞的甲基化作用,通过与汞形成一种可以透过细胞膜、容易进出细胞的络合物,从而使能够进入细胞内进行甲基化的汞含量提高,也就是说增加了细胞能利用的汞含量[9].Schaefer等[20]的研究表明半胱氨酸能够提高甲基汞的生成量以及加快反应的进行,是因为半胱氨酸带有-SH基团,与汞形成的络合物在细胞膜上的传输不能单纯地只以被动扩散来解释,而是以某种未知的促进传输的方式进行.Kelly等[23]和 Golding等[24]发现对于汞在细胞膜上的传输而言,促进吸收如被动扩散一样,都是微生物会使用的细胞传输机制.
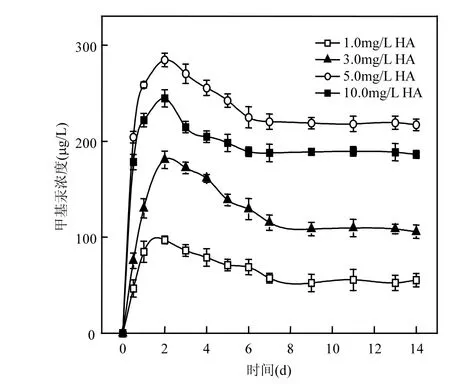
图5 腐殖酸(HA)对S. oneidensis MR-1生物甲基化HgS的影响Fig.5 Effect of humic acid on HgS biological methylation by S. oneidensis MR-1
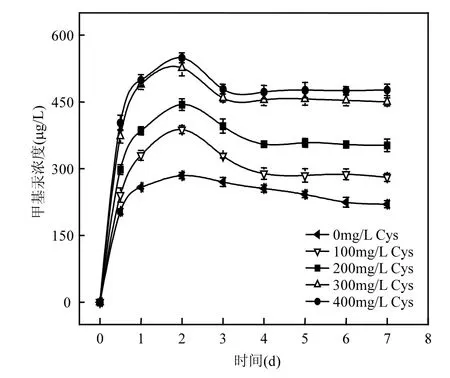
图6 半胱氨酸(Cys)对S. oneidensis MR-1生物甲基化HgS的影响Fig.6 Effect of cysteine on HgS biological methylation by S. oneidensis MR-1
2.3.2 半胱氨酸(Cys)对S. oneidensis MR-1生物甲基化HgS的效应 当温度30℃,腐殖酸浓度为 5mg/L,半胱氨酸浓度分别为 100,200,300, 400mg/L时,在S. oneidensis MR-1作用下,上清液中甲基汞含量随时间的变化趋势如图 6所示.在不同浓度半胱氨酸存在时,甲基汞含量都在第
3 结论
3.1 S. oneidensis MR-1对固态硫化汞的生物溶解量随腐殖酸浓度的增大而增大,但生物甲基化率在腐殖酸浓度为1~5mg/L范围内呈上升趋势,腐殖酸浓度为 5~10mg/L范围内呈抑制作用,其中最大生物甲基化率达到10.55%.
3.2 加入不同浓度半胱氨酸,对 S. oneidensis MR-1生物溶解固态硫化汞的影响较小,但却能增加菌体的生物甲基汞生成量,提高生物甲基化率,使汞甲基化率达到 19.23%,当半胱氨酸浓度超过300mg/L时, 促进汞生物甲基化作用不明显.
[1] Harris R C, Rudd J W M, Amyot M, et al. Whole-ecosystem study shows rapid fish-mercury response to changes in mercury deposition [J]. Proceedings of the National Academy of Sciences, 2007,104(42):16586-16591.
[2] Gilmour C C, Henry E A, Mitchell R. Sulfate stimulation of mercury methylation in freshwater sediments [J]. Environmental Science and Technology, 1992,26(11):2281-2287.
[3] Kerin E J, Gilmour C C, Roden E, et al. Mercury methylation by dissimilatory iron-reducing bacteria [J]. Applied and Environmental Microbiology, 2006,72(12):7919-7921.
[4] Fleming E J, Mack E E, Green P G, et al. Mercury methylation from unexpected sources: molybdate-inhibited freshwater sediments and an iron-reducing bacterium [J]. Applied and Environmental Microbiology, 2006,72(1):457-464.
[5] Kato C, Nogi Y. Correlation between phylogenetic structure and function: examples from deep-sea Shewanella [J]. FEMS Microbiology Ecology, 2006,35(3):223-230.
[6] Barkay T, Gillman M, Turner R R. Effects of dissolved organic carbon and salinity on bioavailability of mercury [J]. Applied and Environmental Microbiology, 1997,63(11):4267-4271.
[7] Skyllberg U. Competition among thiols and inorganic sulfides and polysulfides for Hg and MeHg in wetland soils and sediments under suboxic conditions: Illumination of controversies and implications for MeHg net production [J]. Journal of Geophysical Research-Biogeosciences, 2008,113(G00C03):1-14.
[8] Hintelmann H K, Keppel J, Evans R D. Constants of mercury methylation and demethylation rates in sediments and comparison of tracer and ambient mercury availability [J]. Environmental Toxicology and Chemistry, 2009,19(9):2204-2211.
[9] Schaefer J K, Morel F M. High methylation rates of mercury bound to cysteine by Geobacter sulfurreducens [J]. Nature Geoscience, 2009,2(2):123-126.
[10] Waples J S, Nagy K L, Aiken G R, et al. Dissolution of cinnabar (HgS) in the presence of natural organic matter [J]. Geochimica et Cosmochimica Acta, 2005,69(6):1575-1588.
[11] Deonarine A, Hsu-Kim H. Precipitation of mercuric sulfide nanoparticles in NOM-containing water: Implications for the natural environment [J]. Environmental Science and Technology, 2009,43(7):2368-2373.
[12] Benoit J M, Gilmour C C, Mason R P, et al. Sulfide controls on mercury speciation and bioavailability to methylating bacteria in sediment pore waters [J]. Environmental Science and Technology, 1999,33(6):951-957.
[13] 颜 雪,司友斌,邹 嫣,等.碱消解-HPLC同时测定土壤中的无机汞和甲基汞 [J]. 环境科学与技术, 2012,35(9):89-93.
[14] Ho Y S, Uden P C. Determination of inorganic Hg (Ⅱ) and organic mercury compounds by ion-pair high-performance liquid chromatography [J]. Journal of Chromatography A, 1994,688(1): 107-116.
[15] 黄志勇,黄智陶,张 强,等.原子荧光光谱法测定环境水及土壤样品中的汞形态含量 [J]. 光谱学与光谱分析, 2008,27(11):2361-2366.
[16] Haitzer M, Aiken G R, Ryan J N. Binding of mercury (II) to aquatic humic substances: Influence of pH and source of humic substances [J]. Environmental Science and Technology, 2003, 37(11):2436-2441.
[17] Slowey A J. Rate of formation and dissolution of mercury sulfide nanoparticles: The dual role of natural organic matter [J]. Geochimica et Cosmochimica Acta, 2010,74(16):4693-4708.
[18] Gerbig C A, Kim C S, Stegemeier J P, et al. Formation of nanocolloidal metacinnabar in mercury-DOM-sulfide systems [J]. Environmental Science and Technology, 2011,45(21):9180-9187.
[19] Mitchell C P J, Gilmour C C. Methylmercury production in a Chesapeake Bay salt marsh [J]. Journal of Geophysical Research -Biogeosciences, 2008,113(G00C04):1-14.
[20] Schaefer J K, Rocks S S, Zheng W, et al. Active transport, substrate specificity, and methylation of Hg(II) in anaerobic bacteria [J]. Proceedings of the National Academy of Sciences, 2011,108(21):8714-8719.
[21] Fjeld E, Rognerud S. Use of path analysis to investigate mercury accumulation in brown trout (Salmo trutta) in Norway and the influence of environmental factors [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1993,50(6):1158-1167.
[22] 任家盈, 姜 霞, 陈春霄,等.太湖营养状态对沉积物中总汞和甲基汞分布特征的影响 [J]. 中国环境科学, 2013,33(7):1290-1297.
[23] Kelly C A, Rudd J W, Holoka M H. Effect of pH on mercury uptake by an aquatic bacterium: Implications for Hg cycling [J]. Environmental Science and Technology, 2003,37(13):2941-2946.
[24] Golding G R, Sparling R, Kelly C A. Effect of pH on intracellular accumulation of trace concentrations of Hg(II) in Escherichia coli under anaerobic conditions, as measured using a mer-lux bioreporter [J]. Applied and Environmental Microbiology, 2008,74(3):667-675.
Effects of humic acid and cysteine on the biotransformation of HgS by Shewanella oneidensis MR-1.
CHEN Yan,
HUANG Xiao, SI You-bin*(School of Resources and Environment, Anhui Agricultural University, Hefei 230036, China). China Environmental Science, 2014,34(2):526~531
Effects of humic acid and cysteine on the biological dissolution and methylation of solid HgS by Shewanella oneidensis MR-1were studied. The results showed that the biological solubility of solid HgS was increased with the increasing humic acid concentration, and the concentration of dissolved HgS was 3.35mg/L at the humic acid concentration of 10mg/L. The biological methylation rate of HgS was rising at the humic acid concentration from 1 to 5mg/L, declining while the humic acid concentration from 5 to 10mg/L, and the highest methylation rate was about 10.55%. Cysteine added with different concentration had little influence on the biological solubility of solid HgS, but it could accelerate the methylation reaction process and increase the biological methylation rate of HgS by S. oneidensis MR-1up to 19.23%. The present study provided direct evidence for the biological dissolution and methylation of solid HgS by iron-reducing bacteria in the natural aquatic ecosystem.
iron reducing bacteria;HgS;biotransformation;humic acid;cysteine
X172
:A
:1000-6923(2014)02-0526-06
陈 艳(1987-),女,安徽淮南人,安徽农业大学资源与环境学院硕士研究生,研究方向为环境污染化学与控制工程.
2013-06-21
国家自然科学基金(40971182,41171254);财政部、环境保护部重金属污染防治专项资金(财建[2010]375号)
* 责任作者, 教授, youbinsi@ahau.edu.cn
