姜黄素纳米结构脂质载体的药动学
2014-04-12孙立力胡雪原张景勍
万 坤, 孙立力, 胡雪原, 杨 梅, 张景勍
(重庆医科大学药物高校工程研究中心和生物化学与分子药理学重点实验室, 重庆 400016)
姜黄素纳米结构脂质载体的药动学
万 坤, 孙立力, 胡雪原, 杨 梅, 张景勍
(重庆医科大学药物高校工程研究中心和生物化学与分子药理学重点实验室, 重庆 400016)
目的 建立测定大鼠血浆中姜黄素的 HPLC法, 并研究姜黄素纳米脂质体大鼠灌胃给药后的药动学行为。 方法12 只 SD大鼠随机分成 2 组, 单剂量灌胃给予纳米脂质体及游离姜黄素后, 采用 HPLC法测定血浆中药物浓度, 计算药代动力学参数。结果 建立了姜黄素在大鼠血浆中的测定方法。结果表明纳米脂质体在大鼠体内吸收迅速,清除率降低, 其 AUC(0-t)为 (930.08 ±18.95) μg·h/L,t1/2为 (10.71 ±3.30) h, Cmax为 (117.57 ±4.61) μg/L, 相对于游离药物, 纳米脂质体的生物利用度提高了约 800%。 结论 纳米脂质体是姜黄素较好的递送系统, HPLC法可用于大鼠血浆姜黄素测定及药代动力学研究。
姜黄素;纳米脂质体;药代动力学;大鼠血浆
姜黄素 (Curcumin) 为中药姜黄的主要成分,现代药理研究表明姜黄素有抗炎、抗氧化、抗肿瘤、 利胆、 降血脂、 抑菌 等多种 药 理 作用[1-5], 但由于姜黄素难溶于水,在体内不易吸收,生物利用度低, 且代谢快,半衰期短[6-7], 限制了 其在临床上的广泛应用。 纳米结构脂质载体(Nanostructured lipid carriers, NLC) 是 在固体脂质纳米粒 ( Solid lipid nanoparticles, SLN) 的基础上发展起来的第二代固体脂质纳米粒,也是一种新型的纳米结构给药系统, NLC作为药物载体, 结合了含药微乳和脂质体的特点,通过向固体脂质中加入化学性质差异较大的液态油,使纳米粒以结晶缺陷型或无定型结构存在,增加了辅料对药物的包容性,避免了药物以放置过程中的泄漏和因此导致包封率下 降 的 缺 陷[8-10]。本 研 究 以 姜 黄 素 为 模 型 药物,在制备载药微乳的基础上,进一步通过薄膜分散法,制备了具有较高包封率的姜黄素纳米结构脂质载体,并对其特性和大鼠体内的药代动力学进行了考察,为临床研究具有较高生物利用度的姜黄素制剂提供了依据。
1 材料与仪器
1.1 仪器 Agilent1100 液相色谱仪 (美国 Agilent公司);TGL-16B台式高速离心机 (上海安亭科学仪器厂);DF-101S 集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);AB 204 S 电子分析天秤 ( 瑞士 Mettler Toledo仪器公司);DZF-1型真空干燥箱 (上海跃进医疗器械厂);JEM-1230透射电镜 ( 日本电子株式会社);Nicomp380 ZLS粒径测定仪 (美国 PSS 公司)。
1.2 药品 姜黄素 (纯度 >99%, 南通飞宇生物科技公司)、 单硬脂酸甘油酯 (德国 BASF公司)、卵磷脂 (郑州明欣化工有限公司)、 油酸乙酯 (分析纯, 上海化学试剂二厂)、 聚乙二醇 Polyethylene glycol-400 (分析纯, 天津精细化工有限公司), 聚氧乙烯蓖麻油 (EL-35, 上海士峰生物科技公司)、吐温 -80 (成都市科龙化工试剂厂)、 三棕榈酸甘油酯 (上海紫一试剂厂)、 乙腈 (色谱纯, 美国新天地科技有限公司)、 冰醋酸 (色谱纯, 川东化学试剂厂),其余试剂为分析纯或色谱纯。
1.3 动物 体质量为 200 ~250 g健康的 SD大鼠(重庆医科大学实验动物中心提供, 许可证号: SCXK (渝) 2012-0001; 合格证编号:SCXK (渝)2012-0001。 试验期间自由饮水, 试验前禁食 12 h。
2 方法与结果
2.1 高包封率的姜黄素纳米结构脂质载体的制备称取 50 mg姜黄素、 1.65 g油酸乙酯、0.45 g PEG-400 及 0.60 g EL-35, 40 ℃水浴中避光磁力搅拌3 h后,置于20 ℃的水浴中搅拌, 边搅拌边将水缓慢滴加至制剂中, 避光搅拌 20 min, 即得姜黄素的微乳制剂。再称取处方量的单硬脂酸甘油酯、卵磷脂、 三棕榈酸甘油酯, 置于 250 mL的圆底烧瓶中,加入 20 mL无水乙醇,40 ℃的水浴中, 避光旋干,使圆底烧瓶内壁形成一层均匀分布的薄膜,加入姜黄素的微乳制剂;另称取处方量的吐温 -80, 加入 5.0 m L纯化水, 超声使其充分溶解。 将吐温 -80 溶液加入到圆底烧瓶中,置冰浴中超声,使圆底烧瓶内壁的薄膜脱落,即得姜黄素纳米结构脂质载体黄色乳状混悬液。利用葡聚糖凝胶柱色谱法测定其包封率为 (90.36 ±2.99)%, 载药量为 (1.36 ±0.23)%, 并用粒径测定仪测 定 制 剂 的 粒 径 232.7 nm, Zeta 电 位为 -10.8 mv。
2.2 姜黄素纳米结构脂质载体大鼠体内药动学实验设计 取体质量约 250g的雄性 SD大鼠 12 只,随机分为两组:第1组灌胃给予姜黄素混悬液(50mg/kg), 第 2 组灌胃给予的姜黄素纳米结构脂质载体制剂 (50 mg/kg)。 给药前禁食 12 h, 不禁水。 分 别 在 给 药 后 0.08、 0.17、 0.25、 0.5、0.75、 1、 1.5、 2、 3、 4、 6、 8、 10、 12、 24、 48、72 h 眼底静脉采血0.3mL于肝素浸润过的试管中,6 000 r/min 离心 10 min 后分离血浆, 取 200 μL血浆于洁净试管中, 放入-20 ℃冷冻, 待测。
2.3 血浆样品预处理 吸取血浆样品 200 μL于5 mL离心 管, 加入 尼群地 平内标工作液 (1 μg/mL)20 μL, 再加入乙酸乙酯 1.0 mL, 漩涡2 min后, 12 000 r/min 离 心 10 min, 转 移 上层有机相于另一离心管中,利用氮气吹干仪吹干溶剂后,用 100 μL流动相复溶, 取复溶液 20 μL进样。
2.4 定量测定方法
2.4.1 色 谱 条 件 Chrospher C18色 谱 柱 ( 250 mm×4.6 mm,5 μm); 柱 温 30 ℃; 流 动 相 乙 腈-5%冰 醋 酸 溶 液 (45 ∶55) (V/V); 体 积 流 量1 mL/min; 紫外检测波 长 426 nm。
2.4.2 专属性考察 将供试动物的空白血浆色谱图、空白血浆中加入待测物和内标物后得到的色谱图及给药后大鼠血浆色谱图进行比较,色谱情况见图1。 结果表明, 在本实验选定的色谱条件下, 空白血浆中内源性物质和其他杂质对姜黄素及内标和厚朴酚的测定无干扰,峰型良好;姜黄素及内标的保 留 时间分别 为 11.73 min、 9.50 min。
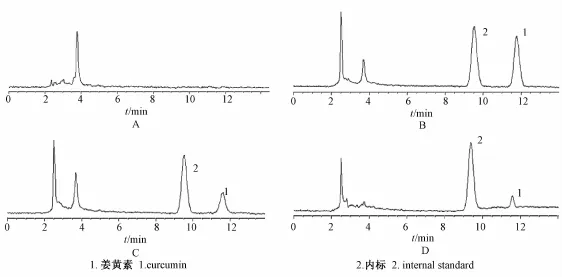
图 1 空白血浆 (A), 空白血浆中加姜黄素 (100 ng/m L) 及内标 (100 ng/m L) (B), 大鼠灌胃给药姜黄素纳米结构脂质载体 60m in后 ( C) 及大鼠灌胃给药姜黄素 60m in后 ( D) 的色谱图Fig.1 Chromatograms of blank rat plasma sample( A) , the rat plasma spiked with curcum in(100 ng/m L) and internal standard solution (100 ng/m L) ( B) , the rat p lasma sam p le collected at60 m in after oral adm inistration of curcum in nanostructu red lipid carriers( C) and the rat p lasma sam p le collected at 60 m in after oral adm inistration of curcum in(D)
2.4.3 标准曲线的制备 精密称量姜黄素 10 mg置于100mL棕色量瓶中, 用甲醇溶液定容至刻度,得质量浓度为 100 μg/mL的姜黄素贮备液; 并配制质量浓度为 1 μg/m L的尼群地平内标工作溶液。吸取不同体积的姜黄素标准溶液,分别置于7个100 mL的棕色量瓶中,甲醇溶液定容至刻度, 得质量浓度分别为 100、500、 1 000、 1 500、 2 000、2 500、 3 000 ng/mL的姜黄素系列标准品溶液,4℃冰箱中保存,备用。
精密吸取各质量浓度的标准溶液20 μL和尼群地平内标溶液 (1 μg/mL) 20 μL至 7 个1.5 mL的离心管中, 氮气吹干溶剂,各离心管中加入 200 μL空白血浆,配制成含有姜黄素的质量浓度分别为10、 50、 100、 150、 200、 250、 300 ng/mL系列血浆样品工作溶液 (内标质量浓度为 100 ng/mL), 按照血浆样品的处理方法处理后,在选择的色谱条件下,进样20 μL, 分别测定各样品中姜黄素和尼群地平的峰面积,以姜黄素和尼群地平的峰面积比为纵坐标,姜黄素质量浓度为横坐标,做线性回归,得回归方程如下 Y=0.012 8X+0.164 4(r=0.999 5),结果表明, 姜黄素在 10 ~300 ng/mL范围内与姜黄素和内标的峰面积比呈良好线性关系。
fQRS组再次行PCI治疗的有8例(13.11%);非fQRS组再次行PCI治疗的有1例(1.64%)。与非fQRS组相比,fQRS组再次行PCI治疗患者占比较高,且差异有统计学意义(χ2=4.319,P=0.015)。
2.4.4 回收率的确定 分别制备姜黄素的低、 中、高 3 个质量浓度 (10、 150、 300 ng/mL) 的血浆样品溶液按照 “2.4” 项下方法处理, 依照色谱条件,测定姜黄素的峰面积和内标峰面积,并分别与空白血浆经相同方法处理后的残渣加入10 μL姜黄素各标 准 溶 液 (100、 1 500、 3 000 ng/mL) 和90 μL流动相制备的 质量浓 度为 10、 150、 300 ng/mL的姜黄素的峰面积比较,测定姜黄素提取回收率和内标回收率,姜黄素 3个质量浓度的平均提取回收率均不小于 75%,内标回收率为(82.13 ± 2.6)%。 结果表明, 姜黄素和内标的绝对回收率符合生物样品分析要求。
2.4.5 精密度和准确度试验 将低、 中、高 3 个质量浓度 (10、 150、 300 ng/m L) 的姜黄素血浆样品溶液,分别依照色谱条件,进样分析,计算精密度和准确度。每一质量浓度1 d内测定5次,计算日内精密度;每一质量浓度1 d测定1次,连续5d, 计算日间精密度; 通过测定, 根据标准曲线计算药物的质量浓度,与血浆样品中实际浓度对比, 计算准确度。 所测得样品的日内精密度 RSD值分别为 1.3%、 0.7%、 0.43% (n=5), 日间精密度 RSD值分别为 1.62%、 0.97%、 0.51% (n= 5); 准确度在 ±5.3%范围内。 测定结果表明, 3个不同质量浓度的姜黄素的精密度和准确度符合生物样品的分析要求。
2.4.6 稳定性考察 分别配制低、 中、 高 3 个质量浓度 (10、 150、 300 ng/mL) 的姜黄素血浆样品溶液, 各质量浓度平行配制3份,室温放置12 h后, 依照 “2.4” 项下方法处理后进样检测, 考察室温放置的稳定性; 冷冻放置 ( -20 ℃) 30 d,考察冷冻放置稳定性。姜黄素的低、中、高3个质量浓度样品放置 12 h后, 测得的质量浓度为标示质量浓度的 98.2%、 98.4%、101.7%, RSD值分别 为 4.97%、 3.17%、 4.02%; 冷 冻 保 存( -20 ℃) 30 d 后, 3 个质量浓度样品测得的质量浓 度 为 标 示 质 量 浓 度 的 98.1%、 101.4%、98.5%, RSD值分别为 4.36%、 3.57%、3.69%,说明姜黄素血浆溶液在 10 ~300 ng/m L质量浓度范围内在室温下保存 12 h 和 -20 ℃冷冻保存 30 d后,血浆中被测物浓度可以准确测定。
2.5 数据处理 对按 “2.4” 项处理所得血浆样品进行分析,同时随行标准曲线和质量控制样品分析,分别计算待测组分峰面积与内标物峰面积比值(A a/A i),用标准曲线计算姜黄素的血药浓度,将血药浓度-时间数据用 DAS 2.0 软件计算药代动力学参数,并将姜黄素与姜黄素纳米结构脂质载体混悬液 的 药 动 学 参 数 AUC(0-∞)、 Tmax、 Cmax、 t1/2、MRT(0-∞)、 CL、V进行方差分析和 q检验, 考察药动学参数差异。
2.6 药动学试验结果
2.6.1 平均血药浓度-时间曲线 大鼠口服灌胃给姜黄素和姜黄素纳米结构脂质载体混悬液后(50 mg/kg) 后, 平均血药浓度-时间曲线见图 2,其符合2 室模型 (权重系数为 1)。

图2 大鼠灌胃给药姜黄素及姜黄素纳米结构脂质载体的LgC-t曲线Fig.2 Plasm a LgC-time profile of curcum in and curcum in nanostructured lipid car riers
2.6.2 药动学参数 姜黄素和姜黄素纳米结构脂质载体混悬液的主要药动学参数见表 1。 结果显示,与姜黄素相比,姜黄素纳米结构脂质载体的体内清除率低, 药时曲线下面积增大, Cmax增大,药物在体内吸收增加明显,消除速率降低;对姜黄素与姜黄素纳米结构脂质载体混悬液药代学参数AUC(0-∞)、 Tmax、 Cmax、 t1/2、 MRT(0-∞)、 CL、 V的方差分析和q检验结果表明,两者的药代学参数两两之间比较, 均有显著性差异 (P<0.05)。
3 讨论
本实验建立了利用 HPLC测定血浆样品中姜黄素的方法,经方法学验证,本方法简便、准确、稳定,回收率和精密度均符合生物样本中药物量测定的要求[11], 经大鼠体内药物动力学实验和 DAS 软件分析进一步证实,可用于姜黄素的 NLC制剂的药代动力学研究。姜黄素纳米结构脂质载体与姜黄素原料药相比,姜黄素纳米结构脂质载体的AUC(0-t)明显大于姜黄素原料药, 约为 8 倍左右,MRT(0-t)延长了约 8 h,CL明显减少, 表明利用NLC为载体制备的姜黄素纳米结构脂质载体制剂,相对于姜黄素原料药,其在动物体内的生物利用度有了明显的提高。
表1 大鼠灌胃给药姜黄素及姜黄素纳米结构脂质载体的主要药动学参数 (, n=6)Tab.1 Pharmacokinetic parameters of curcum in and curcum in nanostructured lipid carriers in rats(,n=6)

表1 大鼠灌胃给药姜黄素及姜黄素纳米结构脂质载体的主要药动学参数 (, n=6)Tab.1 Pharmacokinetic parameters of curcum in and curcum in nanostructured lipid carriers in rats(,n=6)
注:*P<0.05
参数 单位 姜黄素 姜黄素纳米结构脂质载体AUC(0-t) μg·h/L 108.78 ±14.22 930.08 ±18.95 AUC(0-∞) μg·h/L 126.99 ±28.14 971.98 ±47.47*MRT(0-∞) h 5.33 ±1.66 13.61 ±3.06*t1/2z h 4.71 ±1.18 10.71 ±3.30*Tmax h 0.25 ±0.07 1.50 ±0.05*CLz/F L/(h·kg) 406.24 ±85.27 51.53 ±2.58*Vz/F L/kg 2 668.38 ±142.38 788.65 ±215.19*Cmax μg/L 72.46 ±2.66 117.57 ±4.61*
文献报道,有相当数量纳米结构制剂可在较短的时间内 (0.5 h) 被消化道直接吸收[12], 主要途径包括经消化道上皮细胞直接吸收进入血循环,以及通过上皮细胞或派伊尔结 ( Peyer's patches) 吸收进入淋 巴 循环[13-14]。 姜 黄 素纳 米 结 构脂 质 载 体相对生物利用度的提高,可能与姜黄素纳米结构脂质载体导致姜黄素的吸收途径改变有关,由于姜黄素具有溶解性能差,生物利用度低等特点,因而可以利用 NLC可经消化道直接吸收和通过淋巴转运至体循环的吸收特点,将其应用于姜黄素的口服给药,对于减少药物的肝首过效应、提高生物利用度具有潜在的应用价值。
[ 1 ] Siddiqui A M, Cui X, Wu R, et al.The anti-inflammatory effect of curcumin in an experimentalmodel of sepsis ismediated by up-regulation of peroxisome proliferator activated receptor-gamma[ J] .Crit Care Med, 2006, 34(7):1874-1882.
[ 2 ] 张 博, 叶丽红.姜黄素抗癌机制研究进展[J].中医药学报, 2013, 41(1):121-123.
[ 3 ] Aggarwal B B, Shishodia S, Takada Y, et al.Curcumin suppresses the paclitaxel-induced nuclear factor-kappa B pathway in breast cancer cells and inhibits lungmetastasis of human breast cancer in nude mice[ J] .Clin Cancer Res, 2005, 11 (20 ) : 7490-7498.
[ 4 ] Plummer SM, Hill K A, Festing M F, et al.Clinical developmentof leukocyte cyclooxygenase 2 activity as a systemic biomarker for cancer chemopreventive agents[ J] .Cancer Epidemiol, 2010, 10(12) :1295-1299.
[ 5 ] Subash C, Gupta, Sridevi P, et al.Therapeutic roles of curcumin:lessons learned from clinical trials[ J] .AAPSJ, 2013,15(1):195-216.
[ 6 ] Yang K Y, Lin L C, Tseng T Y, et al.Oral bioavailability of curcumin in rat and the herbal analysis from Curcuma longa by LC-MS/MS[J] .JChromatogr B, 2007, 853(1/2):183-189.
[ 7 ] Wang Q, Wang K.Metabolism of curcumin [ J] .Chin Pharmacol Bull, 2003, 19(10) :1097-1101.
[ 8 ] Patricia S, Tatiana A, Ana SM, et al.Current state-of-art and new trends on lipid nanoparticles(SLN and NLC) fororal drug delivery[ J] .JDrug Delivery, 2012 , 10:1-10.
[9] 曹丰亮,郭晨煜,李其禄,等.纳米结构脂质载体的制备与应用研究进展[J].中国生化药物杂志, 2012, 33(1): 93-96.
[10] Wang J J, Liu K S, Sung K C, et al.Lipid nanoparticles with differentoil/fatty ester ratiosas carriersofbuprenorphine and its prodrugs for injection[ J].Eur JPharm Biopharm, 2009, 38(2) :138-146.
[11] Causon R.Validation of chromatographic methods in biomedical analysis.Viewpoint and discussion [ J] .J Chromatogr B,1997, 689(1) :175-180.
[12] Bargoni A, Cavalli R, Caputo O, et al.Solid lipid nanoparticles in lymph and plasma after duodenal administrati on to rats[J] .Pharm Res, 1998, 15(5) :745-750.
[13] Hussain N, Jaitley V, Florence A T.Recent advances in the understanding of uptake ofmicroparticulates across the gastrointestinal lymphatics[ J] .Adv Drug Del Rev, 2001, 50 (1/2 ): 107-142.
[14] Guillaume E, Amaury H, Sophie C, et al.Pharmacokinetics of DTPA entrapped in conventional and long-circulating liposomes of different size for plutonium decorporation[ J] .JControlled Release, 2005, 110(1) :177-l88.
Pharm acokinetics of curcum in nanostructured lipid carriers in rats'plasm a
WAN Kun, SUN Li-li, HU Xue-yuan, YANG Mei, ZHANG Jing-qing
( Medicine Engineering Research Center, Chongqing Medical University, Chongqing 400016, China)
AIM To develop an HPLC method for determining curcumin in rat plasma and to investigate the pharmacokinetic behavior of curcumin nanostructured lipid carriers(CNLC).METHODS Twelve rats were randomly and evenly divided into two groups, the ratswere subject to a single-dose intragastric administration of curcumin and CNLC.The curcumin and CNLC plasma concentrations at predetermined time weremeasured by HPLC,and then the pharmacokinetic parameterswere calculated.RESULTS The HPLCmethod for determining the curcumin concentrations in rat plasmawere established.The results indicated that CNLC was absorbed quickly and the clearance was decreased.The AUC(0-t)was(930.08 ±18.95 )μg/L· h, t1/2was(10.71 ±3.30 ) h, Cmaxwas(117.57 ±4.61 )μg/L, respectively.The bioavailability of CNLC to curcumin was 800%.CONCLUSION The HPLCmethod for determination of plasma curcumin concentration is accurate, simple and reliable, which provides the basis of way for the pharmacokinetic study.CNLC is a promising formulation to deliver curcumin.
curcumin;pharmacokinetics;nanostructured lipid;rat's plasma
R969.1
:A
1001-1528(2014)12-2503-05
10.3969/j.issn.1001-1528.2014.12.013
2013-12-25
重庆市科委基金项目 (CSTC2012JJB10027)
万 坤 (1982—), 男, 硕士生, 研究方向: 药物新剂型与新技术研究。 E-mail:
*通信作者: 张景勍 (1973 —) , 女, 教授, 博 士 生 导师, 研究 方 向: 纳 米药 物 构 建与评 价。 Tel:13308300303, E-mail:zjqrae01@ 163.com
