合并人类巨细胞病毒活动性感染系统性红斑狼疮患者的混合感染及其预后
2014-04-09张奉春曾晓峰唐福林
张 瑾,王 健,张奉春,赵 岩,曾晓峰,张 煊,唐福林,尤 欣
(中国医学科学院 北京协和医学院 北京协和医院风湿免疫科,风湿免疫病学教育部重点实验室,北京 100730)
ChinJAllergyClinImmunol,2014,8(3):174- 180
人类巨细胞病毒(human cytomegalovirus,HCMV)作为侵袭免疫受损人群的主要病原体之一[1],在移植及人类免疫缺陷病毒获得性免疫缺陷综合征领域已得到广泛重视。HCMV感染可出现一系列严重的临床症状,造成住院时间延长,医疗费用增高,死亡风险增加[2]。同时,HCMV通过多种机制在体内长期潜伏并反复激活,对宿主产生短暂而强大的免疫抑制[3],导致其他机会菌感染的风险增加(如细菌、真菌、原虫等)[2,4-5],严重影响患者的生存质量及预后。
近年来,人们也开始关注HCMV感染在系统性红斑狼疮(systemic lupus erythematosus,SLE)中的作用[6],发现其与SLE的发生和发展密切相关。但是,HCMV感染对SLE患者其他不良影响(如混合感染、死亡等)的相关研究并不多。因此,本研究对北京协和医院2006至2012年合并HCMV活动性感染的SLE患者的混合感染发生情况及预后进行分析,以期了解合并HCMV活动性感染的SLE患者的混合感染临床特点及死亡危险因素。
对象和方法
对象
选择2006年1月至2012年1月北京协和医院风湿免疫科住院的合并HCMV活动性感染的SLE病例。SLE诊断符合1997年美国风湿病学会制定的分类标准[7]。HCMV活动性感染诊断至少符合以下3项依据中的1项:HCMV-pp65阳性,HCMV-IgM阳性,HCMV-DNA≥500 copiesml[8-9]。
方法
收集所有患者的临床资料,包括性别、年龄、病程、既往史、临床表现、辅助检查、糖皮质激素及免疫抑制剂使用、抗病毒治疗、结局等。其他各种感染诊断标准参照文献[10],通过病史和体格检查,并结合实验室检查[血、尿、粪便、痰液、肺泡灌洗液、伤口分泌物、脑脊液等细菌及真菌培养,外周血弓形虫、风疹病毒、单纯疱疹病毒(herpes simplex virus,HSV)-1、HSV-2、EB病毒(epstein-barr virus,EBV)IgM抗体,EBV-DNA定量,外周血肺炎支原体、肺炎衣原体IgM抗体,结核菌素试验,痰找抗酸杆菌,肥达氏反应,卡氏肺孢子虫PCR检测等],确立感染情况,记录感染部位、病原菌等。
HCMV-pp65检测
HCMV-pp65抗原检测采用单克隆抗体间接免疫荧光法(HCMV Brite试剂盒,荷兰IQ公司)。阳性判断标准:每张涂片大于10个荧光染色的多形核白细胞(polymorphonuclear leucocyte,PMN),相当于HCMV-pp65抗原阳性细胞数>5.3个105PMN。
HCMV-IgM检测
外周血HCMV特异性IgM抗体检测采用酶联免疫吸附测定法(ETI-CYTOK-M reverse PLUS试剂盒,P002035,意大利DiaSorin公司)。阳性判断标准:标本A值cut-off孔A值>1.1。
HCMV-DNA检测
HCMV-DNA定量检测采用实时荧光定量聚合酶链反应技术(HCMV核酸定量检测试剂盒,中国中山大学达安基因股份有限公司)。阳性判断标准:HCMV-DNA≥500 copiesml。
统计学处理
统计学分析采用SPSS17.0软件。定量资料均为非正态分布数据,采用中位数(全距)来描述,定性资料采用例数或率来描述。采用Logistic回归对死亡危险因素进行单因素及多因素分析,模型参数检验P<0.05认为差异具有统计学意义。
结 果
一般情况
符合标准合并HCMV活动性感染SLE患者105例,男6例,女99例,男女比例1∶16.5;发病年龄中位数(全距)为28(12~75)岁。
混合感染
发生率:全部105例患者中,合并其他病原体感染(即混合感染)56.2%(59/105),合并其他多种病原体混合感染18.1%(19/105),多个部位感染11.4%(12/105)。其中,合并其他病毒感染30.5%(32/105),合并细菌感染23.8%(25/105),合并真菌感染21.9%(23/105)。
发生部位:59例混合感染患者发生65例次感染。其中,呼吸道(26例次)、皮肤黏膜(16例次)、口腔(7例次)为最常见的感染部位(表1)。呼吸道感染以细菌及真菌为主,皮肤黏膜感染以其他病毒为主(如带状疱疹、单纯疱疹等),口腔感染以真菌为主。
病原菌构成情况:合并疱疹病毒科现症感染比例最高(41.4%,36/87),主要包括EBV、HSV-1、HSV-2、水痘-带状疱疹病毒(varicella-zoster virus,VZV)。细菌中革兰阳性菌(G+菌)和革兰阴性菌(G-菌)比例相当(13.8%,12/87);G+菌中以甲氧西林敏感的金黄色葡萄球菌为主(7/12),主要见于败血症;G-菌中常见菌株为鲍曼不动杆菌、肺炎克雷伯菌、铜绿假单胞菌;真菌中曲霉菌属比例最高(13.8%,12/87)。其他检出病原菌包括卡氏肺孢子虫(3.4%,3/87)、肺炎支原体(1.1%,1/87)、肺炎衣原体(2.3%,2/87)(表2)。未见结核杆菌。
死亡情况分析
死亡率及死因:105例患者中死亡14例,总死亡率为13.3%。14例死亡患者原因包括混合感染12例(85.7%),其中合并曲霉菌感染7例(50.0%);SLE活动所致的血栓性血小板减少性紫癜1例(7.1%);SLE脑病1例(7.1%)。
死亡危险因素:单因素Logistic回归分析结果显示,与存活患者比较,死亡患者年龄、淋巴细胞计数、低免疫球蛋白血症、混合感染、合并曲霉菌感染、合并其他基础疾病、未抗HCMV治疗,差异有统计学意义(P<0.05)(表3)。对上述因素进一步行多因素Logistic回归分析,并结合单因素分析及逐步回归结果确定,影响合并HCMV活动性感染的SLE患者死亡的独立危险因素包括低免疫球蛋白血症、混合感染、未抗HCMV治疗(表4)。

表1 59例混合感染患者感染部位构成比
*以65例次感染为总数计算

表2 59例混合感染患者病原菌构成
讨 论
HCMV是一种线状双链DNA病毒,人类对其普遍易感,也是SLE患者最易感的一种病毒[11]。HCMV对宿主免疫系统的影响主要包括两方面,即自身免疫和免疫抑制。HCMV通过分子模拟、表位扩散、刺激多克隆B细胞活化等机制启动自身免疫应答[12],诱导SLE发病,也可加重SLE病情。同时,HCMV是疱疹病毒家族中表达改变人类固有免疫及获得性免疫基因最多的一种病毒[3],发展了多种免疫逃避机制在人体内长期潜伏,这些机制也抑制人体对HCMV本身以及其他病原菌的免疫反应[13]。因此,本研究发现,105例合并HCMV活动性感染的SLE患者中,其他病原体感染发生率高(56.2%),而文献报道普通SLE住院患者的感染发生率为25%~40%[14]。
呼吸道、皮肤黏膜及口腔是主要累及的感染部位。呼吸道感染最常见,与普通SLE患者一致[15]。口腔感染较普通SLE患者多见,主要与口腔真菌感染有关。多部位感染发生率达11.4%,而普通SLE患者多部位感染在既往报道中并不多见(3.8%)[14]。
文献报道,普通SLE伴发感染的病原菌以细菌最常见,占49%~80%[15]。但在合并HCMV活动性感染的SLE患者中,则以合并其他1种或1种以上病毒更常见,占41.4%,主要包括EBV、HSV-1、HSV-2和VZV。这些病毒与HCMV同属疱疹病毒家族,均不同程度参与SLE的发病机制[16];HCMV病毒复制也会增加其他病毒载量[17-18];两者因素可能共同导致这些病毒易在SLE病程中相伴出现。Ramos-casals等[16]总结,SLE患者合并急性病毒感染的病原体包括HCMV、细小病毒B19、EBV、HSV、VZV、甲型肝炎病毒、人类疱疹病毒-6、诺罗病毒、麻疹病毒、腮腺炎病毒,其中最常见的是HCMV、细小病毒B19、EBV、HSV,该研究认为应在发热的SLE患者中常规检测。本研究所见与国外学者的结果基本相符。值得提及的是,细小病毒B19主要见于免疫功能正常及模拟SLE的患者[16],但本研究由于条件受限无法检测,因此未被检出。
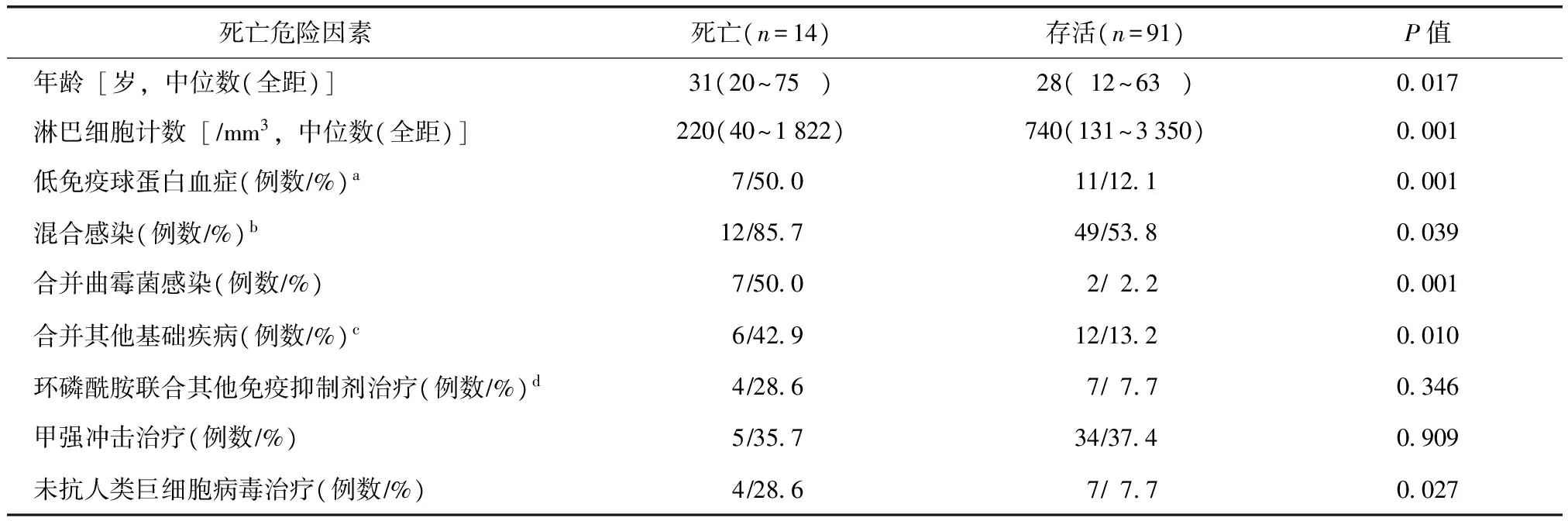
表3 死亡危险因素单因素logistic回归分析
a血浆总球蛋白、IgG、IgM、IgA水平中1项或以上低于正常下限;b包括其他病毒、细菌、真菌、卡氏肺孢子虫等感染;c包括糖尿病、肿瘤;d其他免疫抑制剂包括霉酚酸酯、环孢素、他克莫司、硫唑嘌呤、甲氨蝶呤、来氟米特、雷公藤

表4 死亡危险因素多因素Logistic回归分析
以往报道,普通SLE伴发感染的病原体以G-菌多见,其次为G+菌及真菌。G-菌以大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌最常见,G+菌以金黄色葡萄球菌、链球菌最常见,真菌以念珠菌属最常见[15,19]。本研究患者伴发的细菌感染中G+菌与G-菌检出比例相当,G+菌以金黄色葡萄球菌最常见,主要见于败血症及由此引起的关节及软组织感染,其他G+条件致病菌如屎肠球菌、粪肠球菌等均可见;G-菌以鲍曼不动杆菌、肺炎克雷伯菌、铜绿假单胞菌常见,其他包括浅金黄色单胞菌、阴沟杆菌、伤寒沙门菌、洋葱伯克霍尔德菌等。真菌中曲霉菌比例突出(13.8%),超过了念珠菌(9.2%)。移植领域一项研究[4]发现,HCMV感染的肝移植受体中侵袭性真菌病发生率高(38%),HCMV是侵袭性真菌感染的独立危险因素,本研究所见与其相似。曲霉菌与HCMV混合感染的SLE患者死亡率极高,本研究资料示9例中7例死亡,应当引起重视。合并HCMV活动性感染的SLE患者中,G+菌感染比例升高,机会性细菌感染比例升高,曲霉菌感染比例升高,符合近年来免疫缺陷患者病原体变迁的特点。此外,其他多种病原体混合感染的发生率高(18.1%),也是本研究患者特点。其中,1例22岁合并HCMV活动性感染的女性SLE患者,伴发严重的肺部感染,通过痰液及肺泡灌洗液培养检出肺部病原菌多达7种(烟曲霉、构巢曲霉、土曲霉、白色念珠菌、屎肠球菌、鲍曼不动杆菌、铜绿假单胞菌)。
SLE患者存在多种形式的免疫功能失调,糖皮质激素和免疫抑制剂会增加对感染的易感性,HCMV则进一步影响机体的固有免疫和获得性免疫。机制主要包括以下3点:(1)HCMV直接感染骨髓造血干细胞,抑制淋巴细胞产生,诱导活化淋巴细胞凋亡,使淋巴细胞数量减少[20-21]。(2)HCMV抑制抗原呈递细胞的数量及功能,干扰HCMV抗原有效呈递[3]。(3)HCMV抑制CD8+细胞毒性T细胞和自然杀伤细胞活性[3,6]。这些因素相互作用,导致机体抗感染免疫显著受抑。因此,合并HCMV活动性感染的SLE患者易感细菌、真菌(尤其是曲霉菌)、病毒等多种病原体,并使死亡风险进一步增加。
105例合并HCMV活动性感染的SLE患者中死亡14例,总体死亡率为13.3%,高于费允云和张奉春[22]统计的近20年北京协和医院SLE患者总体死亡率(7.6%)。主要死亡原因为混合感染(12/14,85.7%),尤其是曲霉菌感染(7/14,50.0%)。本研究logistic回归分析发现,低免疫球蛋白血症、混合感染、未抗HCMV治疗是合并HCMV活动性感染的SLE患者死亡的独立危险因素。Takizawa等[23]分析151例合并HCMV感染的风湿病患者资料发现,淋巴细胞减少也是死亡的独立危险因素,这在本研究结果中并未得出。然而,Tsai等[24]发现,淋巴细胞减少只是HCMV激活的预测因素。本研究回归分析显示,低免疫球蛋白血症使死亡风险增加12.113倍,混合感染使死亡风险增加20.288倍,未抗HCMV治疗使死亡风险增加45.590倍。因此,积极控制各种感染、使用静脉丙种球蛋白、抗HCMV治疗,对改善预后是有利的。尤其是未抗HCMV治疗增加死亡风险的比值比最高,达45.590,支持HCMV活动性感染对SLE不良临床结局的影响。但是,由于样本量较小,可能导致参数估计不稳定,统计误差较大,成为本研究的局限。
在移植领域中,预防性抗HCMV治疗可使其他多种病原菌的感染机率降低51%,移植受体的死亡率降低38%[2]。在人类免疫缺陷病毒/获得性免疫缺陷综合征患者中,CD4+T细胞<100/mm3应警惕HCMV视网膜炎并常规筛查眼底,以及时启动抗HCMV治疗[25]。对于难治性或激素抵抗型的炎症肠病,研究发现HCMV感染加剧其临床结局,抗HCMV治疗是有益的[3]。有学者认为,SLE患者淋巴细胞计数<783/mm3预示HCMV激活[24];也有学者认为,HCMV-pp65阳性细胞数≥5.6/105PMN预示HCMV相关临床症状的出现,应当开始抢先抗病毒治疗[23]。如何制定合理的HCMV感染防治方案,以改善SLE预后,是一个值得进一步研究的问题。
综上所述,合并HCMV活动性感染的SLE患者易感染病毒、细菌、真菌(尤其是曲霉菌)等多种病原体,且死亡率高,混合感染、低免疫球蛋白血症、未抗病毒治疗是预后不良的主要危险因素。
[1]Bendiksen S, Van Ghelue M, Rekvig OP, et al. A longitudinal study of human cytomegalovirus serology and viruria fails to detect active viral infection in 20 systemic lupus erythematosus Patients[J].Lupus, 2000, 9:120-126.
[2]Kalil AC, Levitsky J, Lyden E, et al. Meta-analysis:the efficacy of strategies to prevent organ disease by cytomegalovirus in solid organ transplant recipients[J].Ann Intern Med, 2005,143:870-880.
[3]Varani S,Landini MP. Cytomegalovirus-induced immunopathology and its clinical consequences[J].Herpesviridae, 2011, 2:6.
[4]George MJ, Snydman DR, Werner BG, et al. The independent role of cytomegalovirus as a risk factor for invasive fungal disease in orthotopic liver transplant recipients. Boston Center for Liver Transplantation CMVIG-Study Group. Cytogam, MedImmune, Inc. Gaithersburg, Maryland[J].Am J Med,1997,103:106-113.
[5]Hodson EM, Jones CA, Webster AC, et al. Antiviral medications to prevent cytomegalovirus disease and early death in recipients of solid-organ transplants:a systematic review of randomised controlled trials[J].Lancet, 2005, 365:2105-2115.
[6]Sekigawa I, Nawata M, Seta N,et al. Cytomegalovirus infection in patients with systemic lupus erythematosus[J].Clin Exp Rheumatol, 2002, 20:559-564.
[7]Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus[J].Arthritis Rheum, 1997, 40:1725.
[8]单曙光, 李向培.巨细胞病毒感染和系统性红斑狼疮等结缔组织病.中华临床免疫与变态反应杂志, 2008, 2:50-54.
[9]Tang W, Elmore SH, Fan H, et al. Cytomegalovirus DNA measurement in blood and plasma using Roche LightCycler CMV quantification reagents[J].Diagn Mol Pathol, 2008, 17:166-173.
[10] 杨慧芬, 朱宁, 刘德梦, 等.常见感染综合征[M]宋诗铎.临床感染病学. 天津:天津科学技术出版社, 2004, 159- 478.
[11] Ramos-casals M, Cuadrado MJ, Alba P, et al. Clinical guidelines for the management of acute viral infections in patients with systemic lupus erythematosus[J].Minerva Med, 2009, 100:437- 446.
[12] Söderberg-Nauclér C. Autoimmunity induced by human cytomegalovirus in patients with systemic lupus erythematosus[J].Arthritis Res Ther, 2012, 14:101.
[13] Naniche D, Oldstone MB. Generalized immunosuppression:how viruses undermine the immune response[J].Cell Mol Life Sci, 2000, 57:1399-1407.
[14] 裘昊旻,宣丹旦,邹和建. 系统性红斑狼疮合并感染130例回顾性分析[J].中华风湿病学杂志,2009,6:390-393.
[15] 陈钦,朱芸芸,钟瑜,等.系统性红斑狼疮患者感染临床特点及危险因素分析[J].中国中西医结合肾病杂志,2012,5:420- 422.
[16] Ramos-casals M, Cuadrado MJ, Alba P, et al. Acute viral infections in patients with systemic lupus erythematosus.Description of 23 cases and review of the literature[J].Medicine, 2008, 9:311-318.
[17] Razonable RR, Paya CV. The impact of human herpesvirus-6 and-7 infection on the outcome of liver transplantation[J].Liver Transpl, 2002, 8:651-658.
[18] Razonable RR, Burak KW, van Cruijsen H, et al. The pathogenesis of hepatitis C virus is influenced by cytomegalovirus[J].Clin Infect Dis, 2002, 35:974-981.
[19] 朱小平,周静芸.系统性红斑狼疮并发感染的临床特征分析[J].检验医学与临床, 2009, 9:664-665.
[20] Raftery MJ, Schwab M, Eibert SM, et al. Targeting the function of mature dendritic cells by human cytomegalovirus:a multilayered viral defense strategy[J].Immunity, 2001,15:997-1009.
[21] Chen W, Frank ME, Jin W, et al. TGF-beta released by apoptotic T cells contributes to an immunosuppressive milieu[J].Immunity,2001,14:715-725.
[22] 费允云,张奉春. 系统性红斑狼疮患者死亡原因分析[J].中华风湿病学杂志, 2008, 12:187-191.
[23] Takizawa Y, Inokuma S, Tanaka Y, et al. Clinical characteristics of cytomegalovirus infection in rheumatic diseases:multicentre survey in a large patient population[J].Rheumatology, 2008, 47:1373-1378.
[24] Tsai WP, Chen MH, Lee MH, et al. Cytomegalovirus infection causes morbidity and mortality in patients with autoimmune diseases, particularly systemic lupus:in a Chinese population in Taiwan[J].Rheumatol Int, 2012, 32:2901-2908.
[25] Tun N, London N, Kyaw MK, et al. CMV retinitis screening and treatment in a resource-poor setting:three-year experience from a primary care HIVAIDS programme in Myanmar[J].J Int AIDS Soc, 2011, 14:14.
