RNA恒温扩增联合熔解曲线分析鉴定胞内分枝杆菌的应用研究
2014-04-02李园园陆俊梅胡忠义崔振玲
李园园,程 松,陆俊梅,胡忠义,崔振玲
胞内分枝杆菌(Mycobacteriumintracellulare)是鸟-胞内分枝杆菌复合群(Mycobacteriumavium-intracellularecomplex,MAC)中一类重要的病原菌亚种,可以导致人肺部、淋巴结、皮肤等多器官的感染,也可导致动物的感染和传播[1-3],是一类重要的人兽共患病传染源。胞内分枝杆菌与MAC内其他亚种感染的宿主存在差异[2-3],对治疗药物的药物敏感性也存在差异[4],因此对胞内分枝杆菌进行准确鉴定对于MAC病的流行病学研究和临床治疗具有重要意义。本研究建立了RNA恒温扩增实时检测联合熔解曲线分析技术(RNA isothermal transcription-mediated amplification and real-time detection combined melt curve analysis,RIARD-MCA)快速鉴定胞内分枝杆菌的方法,并初步评价其对临床分离株的鉴定效果。
1 材料和方法
1.1材料
1.1.121种分枝杆菌标准株,来自国家菌种保存中心,分别为:结核分枝杆菌标准株H37Rv(M.tuberculosis,ATCC27294)、堪萨斯分枝杆菌(M.kansassi,ATCC12478)、胞内分枝杆菌(M.intracellulare,ATCC13950)、龟分枝杆菌(M.chelonae,ATCC14472)、草分枝杆菌(M.phlei,ATCC11758)、偶发分枝杆菌(M.fortuitum,ATCC6481)、戈登分枝杆菌(M.gordonae,ATCC14470)、金色分枝杆菌(M.aurum,ATCC23366)、淡黄分枝杆菌(M.gilvum,ATCC43909)、副偶发分枝杆菌(M.parafortuitum,ATCC19686)、耻垢分枝杆菌(M.smegmatis, ATCC19420)、海分枝杆菌(M.marinum,ATCC927)、爱知分枝杆菌(M.aichiense,ATCC27280)、新金色分枝杆菌(M.neoaurum, ATCC25795)、土分枝杆菌(M.terra,ATCC19619)、不产色分枝杆菌(M.nonchromogenicum,ATCC19530)、母牛分枝杆菌(M.vaccae,ATCC15483)、田鼠分枝杆菌(M.microti,ATCC19422)、鸟分枝杆菌(M.avium,ATCC25291)、瘰疬分枝杆菌(M.scrofulaceum,ATCC19981)、玛尔摩分枝杆菌(M.malmoense,ATCC29571)。
1.1.25种呼吸道常见非分枝杆菌致病菌,由上海市肺科医院检验科普通微生物实验室分离并经过16S rRNA测序鉴定[5],分别为:肺炎克雷伯菌(Klebsiellapneumoniae)、铜绿假单胞菌(Pseudomonasaeruginosa)、溶血性链球菌(Hemolyticstreptococcus)、绿脓假单胞菌(Pseudomonaspyocyaneum)、鲍曼不动杆菌(Acinetobacterbaumannii)。
1.1.3180株NTM临床分离株和49株MTB临床分离株,来自上海市肺科医院结核病(肺)重点实验室菌株库。
1.2方法
1.2.1RIARD-MCA鉴定胞内分枝杆菌方法 以胞内分枝杆菌的16S rRNA的特异序列为检测靶标设计RNA探针和带有T7启动子的逆转录扩增引物,建立胞内分枝杆菌RNA恒温扩增体系。将待检菌株13 000 r/min离心5 min,弃上清,加入50 μL样本稀释液(10 mmol/L柠檬酸钠,pH8.0,DEPC处理过的无菌H2O配制)重悬后放入超声清洗器中进行超声处理15 min,超声功率300 W。阳性对照、阴性对照与待检菌株同步进行,阳性对照为活的胞内分枝杆菌,阴性对照为无菌水。超声结束后,取2 μL处理物加入预先混合好的30 μL扩增检测液(40 mmol/L Tris-HCl缓冲液 pH 8.1, 8 mmol/L 氯化镁, 25 mmol/L 氯化钠, 2 mmol/L 亚精胺, 5 mmol/L 二硫苏糖醇, 80 μg/mL 牛血清白蛋白,dATP、dTTP、dGTP和 dCTP各200 μmmol/L, ATP、GTP、CTP和 UTP各1 mmol/L,引物浓度和探针浓度均为0.5 mmol/L)中。将反应管置于干热恒温器上60 ℃保温10 min后,再置于42 ℃保温5 min,同时将酶液预热至42 ℃。预热后,向每支反应管中加入10 μL酶液(含M-MLV和T7 RNA转录酶各2000 U),混匀后将反应管快速转至实时荧光定量PCR仪(ABI 7500,购自美国Applied Biosystems公司)中启动反应程序。反应程序为:荧光通道设定为FAM,每个循环为42 ℃ 1 min,共40个循环;荧光信号收集每分钟进行1次,共检测40次。样本曲线与阈值线交叉点的横坐标读数为dt值,dt<40的样本为扩增阳性样本。RNA恒温扩增结束后立即进行40 ℃~95℃熔解曲线分析。RNA恒温扩增曲线阳性且熔解曲线与胞内分枝杆菌阳性对照一致的判定为胞内分枝杆菌;仅扩增曲线阳性,但熔解曲线与胞内分枝杆菌不一致,或者扩增曲线阴性则判定为非胞内分枝杆菌。引物序列5′-TTCTAAGCCTGGGAAA-3′和5′-AATTTAATACGACTCACGGGATATAGGGAGACCACCAACAAGCTGATAGGC-3′,探针序列为5′-CGUGGACCUUUAGGCGCACCACG-3′,5′端FAM标记,3′端DABCYL标记。检测全程操作及检测时间约2 h。引物由上海生物工程公司合成,RNA探针由上海吉玛制药技术有限公司合成,其他检测试剂购自上海仁度生物科技有限公司。
1.2.2RIARD-MCA鉴定胞内分枝杆菌特异度 将21种分枝杆菌标准株在米氏7H10培养基(购自美国Becton,Dickinson)上的阳性培养物和5种呼吸道常见致病非分枝杆菌在血平板培养基(溶血性链球菌)和麦康凯培养基(铜绿假单胞菌、肺炎克雷伯菌、鲍曼不动杆菌、绿脓假单胞菌)上的阳性培养物,用生理盐水磨菌比浊至1 mg/mL,各取1 mL菌悬液进行RIARD-MCA检测。
1.2.3RIARD-MCA鉴定胞内分枝杆菌灵敏度 将胞内分枝杆菌在米氏7H10上培养的阳性培养物,用生理盐水磨菌比浊至1 mg/mL(相当于1×107条细菌/mL),再用生理盐水作1×10-1~1×10-9稀释。从每个稀释度取1 mL菌悬液进行RIARD-MCA检测,同时每个稀释度取100 μL菌悬液接种于米氏7H10培养基上,培养2~3周后进行克隆计数。
1.2.4RIARD-MCA鉴定分枝杆菌临床分离株 将229株分枝杆菌临床分离株的阳性培养物,每份阳性培养物等分为3份,一份用于RIARD-MCA检测,一份用于测序检测,一份冻存备用。
1.2.5PCR基因测序菌种鉴定 用测序法对所有菌株的16S rRNA及hsp65基因进行扩增测序,16S rRNA基因PCR扩增引物序列为:F1:5’- TGGAGAGTTTGATCCTGGCTCAG -3’,R1:5’- TACCGCGGCTGCTGGCAC-3’,片段大小为500 bp[5]。hsp65基因扩增引物为:F2:5’-ATCGCCAAGGAGATCGAGCT-3’,R2:5’-AAGGTGCCGCGGATCTTGTT-3’,片段大小为644 bp[6]。PCR扩增试剂使用PrimeSTAR®HS DNA 聚合酶及配套缓冲液(购自大连宝生物公司),测序送华大基因测序部完成。测序结果通过http://blast.ncbi.nlm.nih.gov/网站的核酸blast在线比对软件进行同源性分析,以鉴定菌种。
1.3统计学分析 以PCR基因测序菌种鉴定结果为参考方法,评价RIARD-MCA法鉴定胞内分枝杆菌的灵敏度、特异度、阳性预测值、阴性预测值和kappa检验值。
2 结 果
2.1RIARD-MCA鉴定胞内分枝杆菌特异度 21种分枝杆菌标准株和5种呼吸道常见致病非分枝杆菌检测结果显示:RNA恒温扩增实时检测时胞内、鸟分枝杆菌均为阳性(图1a),熔解曲线可有效区分胞内与鸟分枝杆菌(图1b),RNA恒温扩增阳性且熔解曲线起峰位置与胞内分枝杆菌标准株一致为胞内分枝杆菌。
2.2RIARD-MCA鉴定胞内分枝杆菌灵敏度 RIARD-MCA可以检测至10-5mg/mL检测管,根据米氏7H10培养基菌落计数结果,10-5mg/mL检测管对应100 CFU/mL浓度,RIARD-MCA灵敏度可达100 CFU/mL(图2)。

图1RIARD-MCA鉴定胞内分枝杆菌检测图中英文对照
Fig.1SpecificityofRIARD-MCAonidentificationanddetectionforM.intracellulare
a: Amplification curve of RIARD-MAC; b: Melting curve of RIARD-MCA;
1, 5:M.intracellulare; 2, 4:M.avium; 3, 6: Othermycobacterium, 5 common bacteria of respiratory tract and negative control.
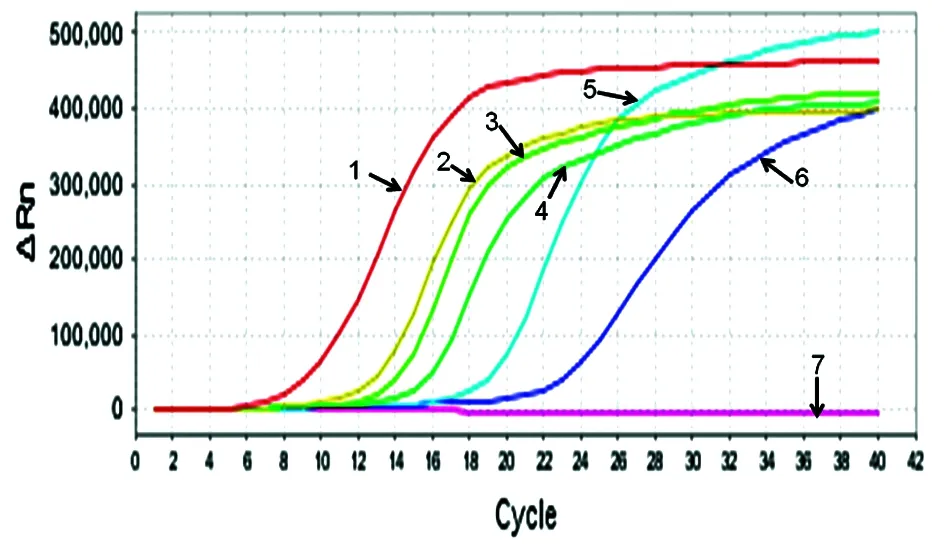
图2RIARD-MCA鉴定胞内分枝杆菌灵敏度检测图
Fig.2SensitivityofRIARD-MCAonidentificationanddetectionforM.intracellulare
1: 107CFU/mL; 2: 106CFU/mL; 3: 105CFU/mL; 4: 104CFU/mL; 5: 103CFU/mL; 6: 102CFU/mL; 7: 101CFU/mL, 100CFU/mL, 10-1, 10-2, 10-3CFU/mL and negative control.
2.3RIARD-MCA鉴定胞内分枝杆菌临床分离株结果 229株分枝杆菌临床分离株中,RIARD-MCA鉴定胞内分枝杆菌63株;PCR测序63株全为胞内分枝杆菌。
166株RIARD-MCA判定为非胞内分枝杆菌,PCR测序全为非胞内分枝杆菌。其中鸟分枝杆菌7株,偶发分枝杆菌5株,堪萨斯分枝杆菌3株,脓肿分枝杆菌36株,龟分枝杆菌1株,M.massiliense21株,M.bolletii2株,海分枝杆菌5株,戈登分枝杆菌7株,金色分枝杆菌13株,瘰疬分枝杆菌1株,副瘰疬分枝杆菌2株,MTB 49株,M.colombiense2株,M.marseillense3株,其余9株blast没找到完全匹配的菌种,分别接近慢性黄分枝杆菌(M.lentiflavum),戈登分枝杆菌、耻垢分枝杆菌、土分枝杆菌、M.algericum、M.engbekii、M.kumamotonense、M.peregrinum、M.interjectum。以PCR测序结果为标准,RIARD-MCA法鉴定胞内分枝杆菌的灵敏度、特异度、阳性预测值、阴性预测值分别为100%、100%,100%、100%,kappa值为1(表1)。
表1229株分枝杆菌RIARD-MCA鉴定结果
Tab.1RIARD-MCAidentificationanddetectionof229mycobacteria

RIARD-MCA基因测序Gene sequencing胞内分枝杆菌M. intracellular其他分枝杆菌Other mycobacteria胞内分枝杆菌M. intracellular630其他分枝杆菌Other mycobacteria0166
3 讨 论
近年来,非结核分枝杆菌(Nontuberculousmycobacteria,NTM)病在世界范围内呈上升趋势,已成为威胁人类健康的重要公共卫生问题[7]。胞内分枝杆菌时一种可导致人类感染发病的病原体,其感染率在MAC感染中可达45%~81%[7-9]。胞内分枝杆菌和鸟分枝杆菌是MAC中两个重要的亚种,均可侵犯人和动物的肺脏、淋巴结、骨骼、皮肤、胃肠道及泌尿生殖道等并造成全身散播[1-4],但其致病宿主、发病过程及治疗均存在一定差异。MAC亚种的准确区分鉴定,对于明确传染源,了解病原体的传播,制定更加准确有针对性的治疗方案具有重要的意义,因此,有效区分鸟、胞内分枝杆菌至关重要。胞内分枝杆菌和鸟分枝杆菌均属于缓慢生长分枝杆菌,培养周期长,通过传统的生化方法很难区分,在无菌种鉴定的情况下易被误诊为结核分枝杆菌感染[10]。近年来,随着分子生物学检测技术发展和对菌种基因序列研究的深入,国内外学者均通过引入新的分子鉴定方法使分枝杆菌菌种鉴定从表型和生化水平转入基因水平,并开始应用于分枝杆菌感染的分子诊断[4,11-13]。
Richardson等[11]以16S rRNA为检测靶标采用多重荧光定量PCR技术,检测MAC的灵敏度为99%,但尚无法区分鸟、胞内分枝杆菌。Park等[12]以ITS为检测靶标采用DNA探针杂交只能鉴定到MAC,也无法区分鸟、胞分枝杆菌。Kim等[13]以hsp65为鉴定靶标采用多探针荧光定量PCR联合熔解曲线分析可以准确鉴定胞内分枝杆菌。上述基于DNA靶标的检测,多数菌种鉴定仅限于MAC水平,且以DNA为靶标的检测无法区分死菌活菌,还易受到DNA气溶胶的污染,出现假阳性结果。法国生物梅里埃公司的Accuprobe胞内分枝杆菌检测试剂盒[4],以胞内分枝杆菌核糖体RNA为检测靶标,通过RNA探针与临床分离株菌体释放出的RNA直接杂交检测胞内分枝杆菌,从而实现较高的特异度,但该试剂盒需要较大的菌量。
本实验室前期已经成功建立基于RNA恒温扩增实时荧光检测技术检测结核分枝杆菌的方法[14],根据研究报道16S rRNA序列可以区分鉴定鸟分枝杆菌和胞内分枝杆菌[15],本研究以胞内分枝杆菌的16S rRNA的特异序列为检测靶标,利用带有T7启动子的引物,在恒温条件下大量扩增靶标RNA,通过胞内分枝杆菌特异的RNA探针与靶标RNA的特异杂交,释放出荧光信号,从而实现对胞内分枝杆菌的检测。与其他以16S rDNA为靶标的研究相似,由于胞内分枝杆菌与鸟胞复合群内其他亚种的16S rRNA靶标序列仅有1~3个碱基的差异,仅通过RNA探针杂交难以准确区分胞内分枝杆菌与其他鸟胞内分枝杆菌亚种[11],本研究为了进一步提高胞内分枝杆菌检测的特异度,将RNA恒温扩增检测与熔解曲线分析联合使用,可大幅提高检测胞内分枝杆菌的特异度。
本研究以16s rDNA和hsp65基因测序为分子菌种鉴定为参考方法[5-6],对RIARD-MCA鉴定胞内分枝杆菌临床分离株进行初步评价。结果显示RIARD-MCA鉴定胞内分枝杆菌具有较高的特异度,与结核分枝杆菌、18种非结核分枝杆菌及呼吸道常见的非分枝杆菌无交叉反应,且能在229株23种分枝杆菌临床分离株中准确的鉴定胞内分枝杆菌,其特异度可达100%,与Kim等[13]以hsp65 DNA为靶标的检测研究结果相同。RIARD-MCA扩增产物为RNA,极易降解,相比较DNA扩增可减少实验室的交叉污染,且16S rRNA在活菌内的拷贝数高于hsp65 DNA的拷贝数,可以提高检测的灵敏度。RIARD-MCA法检测胞内分枝杆菌与Accuprobe胞内分枝杆菌检测试剂盒的特异度相似,检测临床分离株的灵敏度也均为100%[4],但是RIARD-MCA检测胞内分枝杆菌临床分枝株方法学灵敏度为100 CFU/mL,其方法学检测灵敏度高于Accuprobe胞内分枝杆菌检测试剂盒,具有直接检测临床标本中胞内分枝杆菌的潜力。
本研究建立的RIARD-MCA鉴定胞内分枝杆菌方法,RNA提取仅需要15 min超声裂解,不需要复杂的提取过程,操作简单,用一般实验室常规配备的实时定量PCR仪即可进行检测,检测时间仅约2 h,具有简便、快速、准确的优势,可以作为一种新型胞内分枝杆菌分子鉴定方法用于临床分离株的鉴定。
参考文献:
[1]Karakousis PC, Moore RD, Chaisson RE.Mycobacteriumaviumcomplex in patients with HIV infection in the era of highly active antiretroviral therapy[J]. Lancet Infect Dis, 2004, 4(9): 557-565.
[2]Aravindhan V, Sulochana S, Narayanan S, et al. Identification & differentiation ofMycobacteriumaviumandM.intracellulareby PCR-RFLP assay using the groES gene[J]. Indian J Med Res, 2007, 126(6): 575-579.
[3]Shin SJ, Anklam K, Manning EJ, et al. Rapid mycobacterial liquid culture-screening method forMycobacteriumaviumcomplex based on secreted antigen-capture enzyme-linked immunosorbent assay[J]. Clin Vaccine Immunol, 2009, 16(5): 613-620. DOI:10.1128/CVI. 00461-08
[4]Saito H, Tomioka H, Sato K, et al. Identification and partial characterization ofMycobacteriumaviumandMycobacteriumintracellulareby using DNA probes[J]. J Clin Microbiol, 1989, 27(5): 994-997.
[5]Hall L, Doerr KA, Wohlfiel SL, et al. Evaluation of the MicroSeq system for identification of mycobacteria by 16S ribosomal DNA sequencing and its integration into a routine clinical mycobacteriology laboratory[J]. J Clin Microbiol, 2003, 41(4): 1447-1453.
[6]McNabb A, Eisler D, Adie K, et al. Assessment of partial sequencing of the 65-kilodalton heat shock protein gene (hsp65) for routine identification ofMycobacteriumspecies isolated from clinical source[J]. J Clin Micmbiol, 2004, 42(7): 3000-3011.
[7]Thomson RM, NTM working group at Queensland TB Control Centre and Queensland Mycobacterial Reference Laboratory. Changing epidemiology of pulmonarynontuberculousmycobacteriainfections[J]. Emerg Infect Dis, 2010, 16(10): 1576-1583. DOI:10. 3201/eid1610. 091201
[8]Simons S, van Ingen J, Hsueh PR, et al. Nontuberculous mycobacteria in respiratory tract infections, eastern Asia[J]. Emerg Infect Dis, 2011, 17(3): 343-349. DOI:10. 3201/eid1703. 100604
[9]Koh WJ, Jeong BH, Jeon K, et al. Clinical significance of the differentiation betweenMycobacteriumaviumandMycobacteriumintracellulareinMaviumcomplex lung disease[J]. Chest, 2012, 142(6): 1482-1488. DOI:10. 1378/chest. 12-0494
[10]Chinese Anti-tuberculosis Association Professional Committee Compile. Laboratory test procedures of Tuberculosis diagnostic [M]. Beijing: Chinese Education Culture Press, 2006: 1. (in Chinese)
中国防痨协会基础专业委员会. 结核病诊断实验室检验规程[M].北京:中国教育文化出版社,2006:1.
[11]Richardson ET, Samson D, Banaei N. Rapid identification ofMycobacteriumtuberculosisandNontuberculousmycobacteriaby multiplex, real-time PCR[J]. J Clin Microbiol, 2009, 47(5): 1497-1502. DOI:10. 1128/JCM. 01868-08
[12]Park H, Jang H, Song E, et al. Detection and genotyping ofMycobacteriumspecies from clinical isolates and specimens by oligonucleotide array[J]. J Clin Microbiol, 2005, 43(4): 1782-1788.
[13]Kim K, Lee H, Lee MK, et al. Development and application of multiprobe real-time PCR method targeting thehsp65 gene for differentiation ofMycobacteriumspecies from isolates and sputum specimens[J]. J Clin Microbiol, 2010, 48(9): 3073-3080. DOI:10. 1128/JCM. 00939-10
[14]Cui Z, Wang Y, Fang L, et al. Novel real-time simultaneous amplification and testing method to accurately and rapidly detectMycobacteriumtuberculosiscomplex[J]. J Clin Microbiol, 2012, 50(3): 646-650. DOI:10. 1128/JCM. 05853-11
[15]Foongladda S, Phplwat S, Eampokalap B, et al. Multi-probe real-time PCR identification of commonMycobacteriumspecies in blood culture broth[J]. J Mol Diagn, 2009, 11(1): 42-48. DOI:10. 2353/jmoldx. 2009. 080081
