鉴定单增李斯特菌4b血清型亚型的多重PCR方法的建立
2014-04-02叶正兴王天殊贺春月许华青叶长芸
王 毅,王 艳,叶正兴,代 航,王天殊,贺春月,许华青,叶长芸
单增李斯特菌是一种兼性厌氧的革兰氏阳性短杆菌,广泛分布于环境、食品、人和动物宿主体内[1-2]。自20世纪80年代以来,由单增李斯特菌引起的单增李斯特菌病逐渐成为一种重要的食源性疾病[1]。食入被单增李斯特菌污染的食品是引起人类李斯特菌病暴发和散发病例的主要原因[4-5]。孕妇感染后容易导致流产、早产,甚至是胎儿死产;免疫力低下人群则出现发热性胃肠炎、败血症、脑膜炎等严重的侵袭性病症;免疫力正常个体常出现与其它食源性的致病菌感染相似的症状,如腹泻、发热、呕吐[6-7]。
在单增李斯特菌的13种血清型(1/2a、1/2b、1/2c、3a、3b、3c、4a、4ab、4b、4c、4d、4e、7)中,血清型1/2a、1/2b、4b菌株导致了人类绝大多数的李斯特菌病临床病例[2],而4b为优势致病血清型,其致病率和死亡率远高于1/2a和1/2b,且绝大多数的暴发菌株为4b[2,10-11]。各种分子分型方法显示4b血清型的单增李斯特菌具有遗传多态性,它同属于3个不同的遗传家系(Lineage I、Lineage III和Lineage IV),而3个家系中只有Lineage I的4b菌株与暴发和散发病例有较强的相关性,Lineage III和Lineage IV中的4b型菌株具有截然不同的分子特征[12-14]。目前很多研究根据流行病学和分子生物学特征将4b菌株分为3种流行克隆群ECI、ECII和ECIV(Lineage I)和一种非流行克隆群non-EC(Lineage III和Lineage IV),ECI、ECII和ECIV主要引起暴发和散发的人类李斯特菌病,non-EC 4b主要分离自动物病例和污染的动物食品[12-15]。
虽然区分部分血清型4b亚型的方法已逐步被建立[16-18],但这些方法只能检测出常见的ECI和ECII型,无法将ECIV和non-EC鉴别开。迄今还没有一个方法能够同时将单增李斯特菌4b血清型的四个亚型进行有效的区分。本研究的目的在于建立一个多重PCR方法,该方法能够快速、准确地将流行克隆群的4b菌株和非流行菌株区分开,并同时将流行菌株准确定位到亚型,为单增李斯特菌病的诊断、食品安全评估及可能的感染暴发的病原溯源提供技术支持。
1 材料与方法
1.1菌株 16株单增李斯特菌4b血清型菌株和384株其他血清型(1/2a、1/2b、1/2c、3a、3b、3c、4a、4c、4d、4e、7)单增李斯特菌株来自本实验室,4b血清型菌株的亚型确定参照Liu, D.和Martin, W.等人的分型方法[13,18]。菌株使用前在脑心浸液(BHI)琼脂平板上37 ℃过夜生长。
1.2试剂与仪器 Mix和细菌基因组提取试剂盒(Bacteria Gene DNA kit)购自北京康为世纪生物科技有限公司;DL100 DNA Marker购自大连宝生物公司。PCR仪(SensoQuest Labcycler)购自德国Senso公司;凝胶成像系统(GEL Doc2000)购自美国Bio-rad公司;引物合成由上海生物工程有限公司完成。
1.3DNA模板制备 细菌基因组提取按试剂盒说明书进行,所制备的菌株DNA模板均保存于-20 ℃备用。
1.4引物设计 本研究包括4个特异目的基因LMOf2365_2798、LMOh7858_0487、ORF2110和gtcA(LMOf2365_2522)。LMOf2365_2798、LMOh7858_0487和ORF2110引物序列来自参考文献[11,14-15,17]。gtcA引物序列设计根据clustalw2(http://www.ebi.ac.uk/Tools/msa/clustalw2/)多序列比对,选择4b菌株的特异序列部分见图1。目的基因的引物序列及其特异性见表1。

图1运用多序列比对目的基因gtcA进行引物设计
Fig.1DevelopmentoftheprimersetforL.monocytogenesserotype4bidentificationbymultiple-sequencecomparisonofgtcAsequence
The boxes indicate the regions of forward and reverse primers. Left column are isolate identification numbers followed the serotype designations.
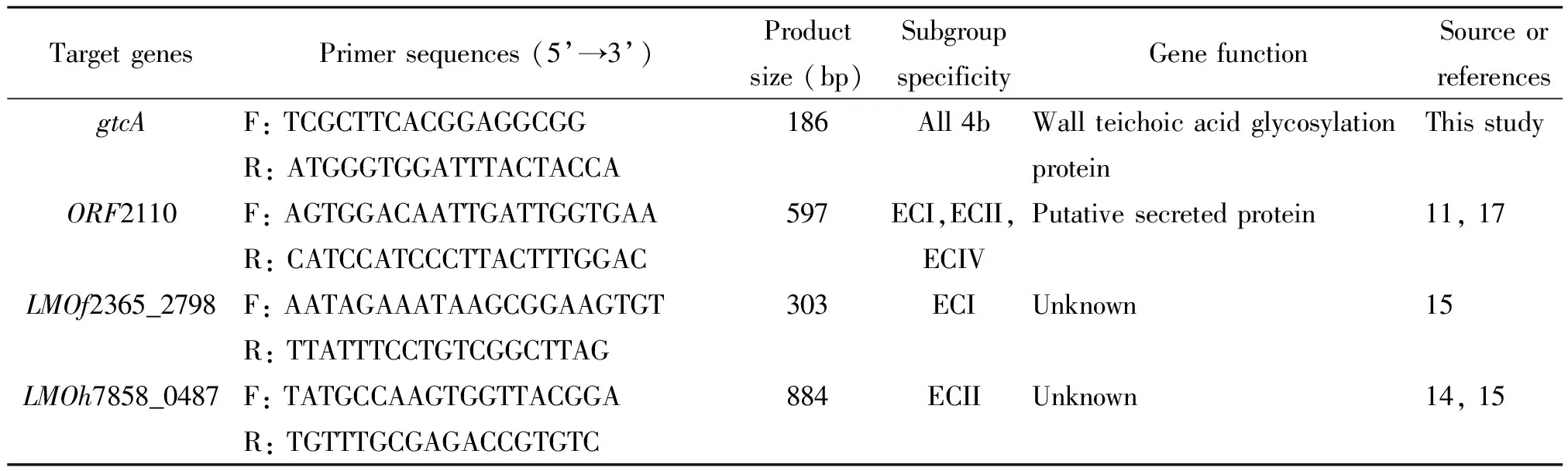
表1 实验用引物序列
1.5gtcA特异性验证 PCR反应体系(20 μL):Mix 10 μL、蒸馏水7 μL、gtcA-F和gtcA-R各1μL、模板DNA 1.0 μL。95 ℃变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸40 s,共30循环;最后72 ℃延伸5 min。结束后取8 μL PCR扩增产物上样于1.0%琼脂糖凝胶,150 V电压条件下电泳30 min后在凝胶图像分析系统下观察结果并拍摄图像。
1.6多重PCR扩增 PCR反应体系(30 μL):Mix 26 μL、模板DNA1.5 μL、4对引物浓度分别为:LMOf2365_2798 0.1 μmol/L、LMOh7858_0487 0.17 μmol/L、ORF2110 0.1 μmol/L、gtcA 0.13 μmol/L)。95 ℃变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min,共35循环;最后72 ℃延伸5 min。反应结束后取8 μL PCR扩增产物上样于2.5%琼脂糖凝胶,130 V电压条件下电泳80 min后在凝胶图像分析系统下观察结果并拍摄图像。
2 结 果
为了得到预期大小的扩增产物,分别在不同引物浓度下测试4对引物的扩增效率。4对引物的最佳浓度见材料与方法,在此条件下能够得到高质量的特异性扩增片段。
在所建立的最佳反应条件下,单增李斯特菌4b血清型不同亚型的多重PCR扩增结果良好(图2)。所有4b血清型实验菌株都扩增gtcA片段(186 bp),该基因的特异性使用400株单增李斯特菌加以证实,包括12个血清型(1/2a、1/2b、1/2c、3a、3b、3c、4a、4b、4c、4d、4e、7)。其中non-EC亚型菌株仅扩增出gtcA片段;ECI亚型菌株扩增出gtcA、ORF2110和LMOf2365_2798片段;ECII亚型菌株扩增gtcA、ORF2110和LMOh7858_0487;ECIV亚型菌株扩增gtcA和ORF2110片段。
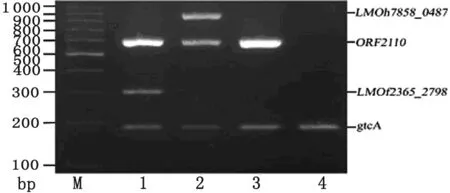
图2单增李斯特菌4b血清型不同亚型菌株的PCR扩增结果
Fig.2AgarosegelelectrophoresisofthePCRproductsobtainedfrommultiplexPCR
M: 100-bp DNA ladder marker; 1: The ECI strain ofL.monocytogenesserotype 4b; 2: The ECII strain ofL.monocytogenesserotype 4b; 3: The ECIV strain ofL.monocytogenesserotype 4b;
4: The non-EC strain ofL.monocytogenesserotype 4b.
Molecular sizes of ladder marker are given at the left. Genes corresponding to the amplified fragments are listed on the right.
运用本研究建立的多重PCR方法,16株4b血清型单增李斯特菌的4个亚型菌株得到了很好的区分(见表2)。
3 讨 论
在单增李斯特菌4b血清型菌株中,ECI、ECII、ECIV菌株主要导致人类李斯特菌病的暴发,欧美国家的几次主要暴发都是由ECI、ECII、ECIV菌株引起[20-22]。同时这些菌株也经常引起散发病例[23]。而流行病学研究显示Non-EC很少引起人类李斯特菌病,主要分离自动物病例标本和污染的动物食品[3]。研究表明这些菌株分子流行病学特征与克隆群的划分具有一致性,Martin Wiedmann等人的多毒力序列位点分型(MVLST)研究发现ECI主要为序列型(Sequence type, ST)ST1和ST93,ECII为ST17,ECIV为ST8和ST29,且ECIV(ST29)为优势流行克隆群[4]。然而我们研究发现,中国单增李斯特菌4b血清型菌株中,ECI菌株主要为ST1、ECII菌株为ST218、ECIV菌株为ST8,ECI(ST1)菌株为优势流行克隆群[1]。但通过分子流行病学方法鉴定4b菌株亚型,耗时、耗力且价格昂贵,不适用于食品安全筛查和暴发疫情的应急检测。基于多重PCR技术的单增李斯特菌4b血清型菌株亚型的鉴定方法快速准确,且能够实现高通量,对食品安全中病原菌的检测、流行菌株的监测及暴发菌株的溯源具有重要的应用意义。

表2 多重PCR对单增李斯特菌4b亚型的检测结果
Note:a--According to the typing methods described by Liu D. and Martin W. et al, the identification ofL.monocytogenesserotype 4b subgroups was achieved.
gtcA为单增李斯特表面抗原相关基因,其产物参与单增李斯特菌胞壁酸的糖基化修饰[24]。通过序列比对发现,该基因存在于所有的单增李斯特血清型中,然而在血清型4b、4d和4e中具有相同的序列。本研究针对gtcA设计的特异性引物(gtcA-F和gtcA-R)作为4b血清型的基因标记,因为血清型4b、4d和4e能够通过血清凝集进行鉴别。Doumith, M.等发现的ORF2110曾经作为血清型4b、4d和4e的特异性诊断标志[17,19],然而Liu, D.等研究发现该基因在non-EC 4b菌株中特异性的缺失[12-13],因此本研究中利用该基因用于鉴别non-EC与ECI、ECII、ECIV亚型。目的基因LMOf2365和LMOh7858在一些研究中证实是ECI、ECII亚型的基因标记[16-17],其特异性在本研究中得到进一步的证实。
本研究建立的多重PCR方法能够在一个反应体系中同时鉴别单增李斯特菌4b血清型的4个亚型,实现对ECI、ECII、ECIV和non-EC菌株的快速、准确的诊断。与传统鉴别单增李斯特菌4b血清型亚型的分子分型方法相比较,我们建立的多重PCR方法结果可靠、操作简单、适用性广,在单增李斯特菌流行株的监测、食品安全性评估及暴发疫情的病原学溯源中具有重要的应用价值。
参考文献:
[1]Schlech WF,Acheson D,Editor S, et al. Foodborne listeriosis[J]. Clin Infect Dis, 2000, 31(3): 770-775. DOI:10. 1086/314008
[2]Vazquez-Boland JA, Kuhn M, Berche P, et al.Listeriapathogenesis and molecular virulence determinants[J]. Clin Microbiol Rev, 2001, 14(3): 584-640. DOI:10. 1128/CMR. 14. 3. 584-640. 2001
[3]Wang Y, Zhao AL, Ye CY, et al. Genetic diversity and molecular typing ofListeriamonocytogenesin China[J]. BMC Microbiol, 2012, 12: 119. DOI:10. 1186/1471-2180-12-119
[4]Hoelzer K, Pouillot R, Dennis S, et al.Listeriamonocytogenesgrowth dynamics on produce: a review of the available data for predictive modeling[J]. Foodborne Pathog Dis, 2012, 9(7): 661-673. DOI:10. 1089/fpd. 2011. 1087
[5]Viswanath P, Murugesan L, Knabel SJ, et al. Incidence ofListeriamonocytogenesandListeriaspp. in a Small-Scale Mushroom Production Facility[J]. J Food Prot, 2013, 76(4): 608-615. DOI:10. 4315/0362-028X. JFP-12-292
[6]Poulsen KP, Czuprynski CJ. Pathogenesis of listeriosis during pregnancy[J]. Anim Health Res Rev, 2013,14(1):30-39.
[7]Bodro M, Paterson DL. Listeriosis in patients receiving biologic therapies[J]. Eur J Clin Microbiol Infect Dis, 2013: 4491-4497. DOI:10. 1007/s10096-013-1873-1
[8]Huang B, Eglezos S, Heron BA, et al. Comparison of multiplex PCR with conventional biochemical methods for the identification ofListeriaspp. isolates from food and clinical samples in Queensland, Australia[J]. J Food Prot, 2007, 70(8): 1874-1880.
[9]Swaminathan B, Gerner-Smidt P. The epidemiology of human listeriosis[J]. Microbes Infect, 2007, 9(10): 1236-1243.
[10]Gerner-Smidt P, Ethelberg S, Schiellerup P, et al. Invasive listeriosis in Denmark 1994-2003: a review of 299 cases with special emphasis on risk factors for mortality[J]. Clin Microbiol Infect, 2005, 11(8): 618-624. DOI:10. 1111/j. 1469-0691. 2005. 01171. x
[11]Ronholm J, Van FH, MacKenzie R, et al. Monoclonal antibodies recognizing the surface autolysin IspC ofListeriamonocytogenesserotype 4b: epitope localization, kinetic characterization, and cross-reaction studies[J]. PLoS One, 2013, 8(2): e55098. DOI:10.1371/journal. pone. 0055098
[12]Orsi RH, Den-Bakker HC, Wiedmann M, et al.Listeriamonocytogeneslineages: Genomics, evolution, ecology and phenotypic characteristics[J]. Int J Med Microbiol, 2011, 301(2): 79-96. DOI:10. 1128/AEM. 01127-08
[13]Liu D, Lawrence ML, Gorski L, et al.Listeriamonocytogenesserotype 4b strains belonging to lineages I and III possess distinct molecular features[J]. J Clin Microbiol, 2006, 44(1): 214-217. DOI:10. 1128/JCM. 44. 1. 214-217. 2006
[14]Vasconcelos RM, Almeida AE, Hofer E, et al. Multiplex-PCR serotyping ofListeriamonocytogenesisolated from human clinical specimens[J]. Mem Inst Oswaldo Cruz, 2008, 103(8): 836-838.
[15]Liu D, Lawrence ML, Wiedmann M, et al.Listeriamonocytogenessubgroups IIIA, IIIB, and IIIC delineate genetically distinct populations with varied pathogenic potential[J]. J Clin Microbiol, 2006, 44(11): 4229-4233. DOI:10. 1128/JCM. 01032-06
[16]Evans MR, Swaminathan B, Graves LM, et al. Genetic markers unique toListeriamonocytogenesserotype 4b differentiate epidemic clone II (hot dog outbreak strains) from other lineages[J]. Appl Environ Microbiol, 2004, 70(4): 2383-2390. DOI:10. 1128/AEM. 70. 4. 2383-2390. 2004
[17]Chen Y, Knabel SJ. Multiplex PCR for simultaneous detection of bacteria of the genusListeria,Listeriamonocytogenes, and major serotypes and epidemic clones ofL.monocytogenes[J]. Appl Environ Microbiol, 2007, 73(19): 6299-6304. DOI:10. 1128/AEM. 00961-07
[18]Den-Bakker HC, Fortes ED, Wiedmann M, et al. Multilocus sequence typing of outbreak-associatedListeriamonocytogenesisolates to identify epidemic clones[J]. Foodborne Pathog Dis, 2010, 7(3): 257-265. DOI:10. 1089/fpd. 2009. 0342
[19]Doumith M, Buchrieser C, Glaser P, et al. Differentiation of the majorListeriamonocytogenesserovars by multiplex PCR[J]. J Clin Microbiol, 2004, 42(8): 3819-3822. DOI:10. 1128/JCM. 42. 8. 3819-3822. 2004
[20]Kathariou S.Listeriamonocytogenesvirulence and pathogenicity, a food safety perspective[J]. J Food Prot, 2002, 65(11): 1811-1829.
[21]Chen Y, Zhang W, Knabel SJ, et al. Multi-virulence-locus sequence typing identifies single nucleotide polymorphisms which differentiate epidemic clones and outbreak strains ofListeriamonocytogenes[J]. J Clin Microbiol, 2007, 45(3): 835-846. DOI:10. 1128/JCM. 01575-06
[22]Goulet V, King LA, Vaillant V, et al. What is the incubation period for listeriosis[J]. BMC Infect Dis, 2013, 13: 11.
[23]Sauders BD, Schukken Y, Kornstein L, et al. Molecular epidemiology and cluster analysis of human listeriosis cases in three U. S. states[J]. J Food Prot, 2006, 69(7): 1680-1689.
[24]Promadej N, Fiedler F, Cossart P, et al. Cell wall teichoic acid glycosylation inListeriamonocytogenesserotype 4b requiresgtcA, a novel serogroup-specific gene[J]. J Bacteriol, 1999, 181(2): 418-425.
