不同施氮水平对烟富3/M26/平邑甜茶幼树当年及翌年氮素吸收、 利用、 分配的影响
2014-03-30姜远茂魏绍冲王富林李洪娜
李 晶, 姜远茂, 魏绍冲, 王富林, 周 乐, 李洪娜
(山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,山东泰安 271018)
苹果矮化密植栽培的矮化性、 一致性、 早果性、 安全化、 机械化等优点[1]使苹果矮化密植栽培成为现代苹果产业的主要发展趋势,目前主要有自根砧和中间砧两种应用形式。我国65%的果树种植在土壤瘠薄的丘陵地[2],土壤有机质普遍较低[3],短期内全面提高较困难,决定了对肥水条件要求较高的矮化自根砧适宜栽植区域有限,这是目前我国苹果矮化密植仍以矮化中间砧为主的主要原因。氮作为果树生长所必需的矿质元素之一,氮素营养的吸收、 利用和分配直接或间接影响树体的器官分化、 形成及建造,与树体的生长发育、 果实产量和品质形成密切相关。目前苹果栽培过程中偏施氮肥,施肥不足和超量并存,肥料利用率低,施肥时期不合理,后期脱肥,贮藏营养不足等问题严重[2]。根系作为果树养分和水分的主要吸收器官,植物通过根系形态与生理学反应来适应土壤环境中氮素供应强度的变化[4],作物在生长前期较强的根系生长势利于快速建立起较大的根系以提高氮素吸收利用效率[5],进而促进作物生长,协调的根系与地上部生长是保障果树对养分高效吸收,构建丰产、 稳产、 优质树体结构的根本措施[2]。因此,通过研究施氮不足、 适量施氮肥和过量施氮肥对苹果矮化中间砧幼树的生长及氮素营养吸收、 利用、 分配规律的影响,可明确不同氮肥施用量栽培条件下不同生长阶段树体各器官对氮的需求及利用特点,以采取相应措施对树体各器官的生长节奏加以调节,协调树体根系与地上部的生长以促进幼树快速生长缩短营养期,协调营养生长与生殖生长以早果稳产丰产。因此,通过研究不同施氮量对苹果幼树矮化中间砧的生长及氮素营养吸收、 利用、 分配规律的影响,可为苹果矮化中间砧高产高效栽培配套技术提供理论依据。
1 试验材料与方法
1.1 试材与处理
试验于2011年在山东农业大学园艺试验站进行。试材为定植在园艺试验站的2年生烟富3/M26/平邑甜茶幼树,不同处理间设置隔离树。供试土壤为粘壤土,有机质10.13 g/kg,碱解氮76.63 mg/kg,速效磷27.28 mg/kg,速效钾184.99 mg/kg,硝态氮37.95 mg/kg,铵态氮16.17 mg/kg,pH 6.7。于2011年4月15日各选取9株生长势基本一致、 无病虫害的植株,试验设氮肥施用量: 0 kg/hm2、 100 kg/hm2、 200 kg/hm2(以下简称N0、 N100、 N200)三个水平。供试氮肥为尿素(46%),每株幼树土施1 g15N-尿素(上海化工研究院生产,丰度10.22%),过磷酸钙43.13 g、 硫酸钾12.7 g。N0不另施氮肥,N100、 N200分别施用尿素15 g、 30 g,至翌年春梢旺长期不再施肥。施肥后立即浇水,进行常规管理,各处理生长条件和其他栽培管理保持一致。
1.2 取样与测定
分别于2011年6月1日(春梢旺长期)、 7月1日(春梢停长期)、 8月15日(秋梢旺长期)和2012年6月10日(翌年春梢旺长期)破坏性采样。每次取样各处理均取3株。整株解析为叶、 一年生枝条、 接穗韧皮部、 接穗木质部、 中间砧韧皮部、 中间砧木质部、 根砧韧皮部、 根砧木质部。样品按清水→洗涤剂→清水→1%盐酸→3次去离子水顺序冲洗后,80℃下烘干至恒重,粉碎后过0.25 mm目筛,混匀后装袋备用。15N丰度在DELTAplusXP型质谱仪中测定。
1.3 计算及统计方法
计算公式如下:
Ndff% =[样品中的15N丰度%-自然丰度(0.365%)]/[肥料中15N的丰度%-自然丰度(0.365%)]×100;
总N量(g)=干物重(g)×N%;
15N吸收量(mg)=总N量(g)×Ndff%×1000;
氮肥分配率(%)=[各器官从15N吸收N量(mg)/15N总吸收N量(mg)]×100;
氮肥利用率(%)=15N吸收量(g)/施氮量(g)×100。
所有数据均采用DPS7.05软件进行单因素方差法分析,LSD法进行差异显著性比较,应用Microsoft Excel 2003进行图表绘制。
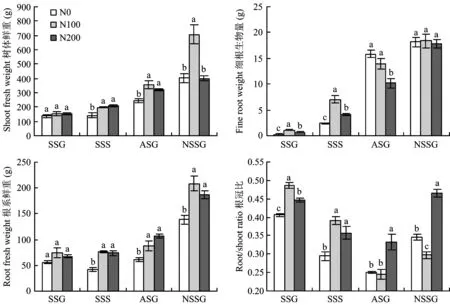
图1 施氮水平对树体生长的影响Fig.1 Effects of different N rates on growth of apple tree [注(Note): SSC—春梢生长期 Spring shoot growing; SSS—春梢停止生长期Spring shoot stop growing;ASG—秋梢旺长期Autumn shoot growing; NSSG—翌年春梢生长期Next spring shoot growing. 图中不同字母表示同一时期处理间差异达到5%显著水平 Different letters mean significant difference at the same stage at the 5% level.]
2 结果与分析
2.1 施氮水平对树体生长的影响
施氮水平对树体生长影响显著。图1可见,在春梢旺长期,随着施氮肥量增加树体生物量有增加趋势,但差异不显著;随着生长期的延长至春梢停长期,N100和N200处理对树体生长的促进作用逐渐显著,N100处理(196.23 g)和N200处理(209.82 g)树体生物量比N0处理(151.63 g)显著提高了25.17%和33.84%,表明N100和N200施氮水平均对树体生长有显著促进作用;至秋梢旺长期,N100处理(351.38 g)和N200处理(322.94 g)仍保持较高树体生物量,比N0处理分别提高了44.00%和32.34%,且N100比N200处理对树体生长有明显促进作用;至翌年春梢旺长期,N100树体生物量升高至N0的175.83%和N200的176.41%,N0和N200树体生物量无显著差异,表明对树体生长抑制作用较强的M26中间砧苹果幼树的生长没有随着施氮水平增加而提高,而是在适宜氮肥水平下表现出较大生物量,这一结果在年周期中是逐渐显现出来,且适宜施氮对树体翌年生长的促进作用较当年更为显著,与宇万太[6]和韩振海[7]等的研究结果一致。 在春梢旺长期和春梢停长期,N100处理细根生长量最高,其次是N200处理,N0处理最低,三者之间差异显著,表明氮肥施入在较长时间内对细根生长量的增加有一定促进作用,且N100施氮水平相对于N200处理更利于细根生长。至秋梢旺长期,N0处理细根生物量迅速升高至最高且显著高于N200处理,与N100处理无显著差异,这与长期低氮条件下苹果幼树产生低氮胁迫响应,诱导细根大量发生有关。N200处理细根生长呈现先高后低趋势,与罗雪华[8]等人在巴西橡胶树上的研究结果一致。已往研究发现低氮条件下植物可刺激根的伸长[9],高氮抑制细根生长[10, 11],从试验结果来看,到秋梢旺长期才在细根数量上与这个结论吻合,表明苹果作为多年生植物由于贮藏营养等的影响,施氮水平对根系生长的影响有一定滞后性和特殊性。
氮肥施入初期,即春梢旺长期施氮水平对根系总量的影响由高到低表现为: N100>N200>N0,但差异不显著。随着氮肥施入时间和生长期的延长,施氮对根系总量的影响逐渐显著,至春梢停长期N100和N200处理根系鲜重均显著高于N0,N100和N200处理无显著差异,而翌年以适宜施氮处理最高,表明适宜施氮肥对根系总量有促进作用。
在春梢旺长期,N100和N200处理根冠比升高至N0处理的119.04%和119.66%;至春梢停长期,各处理根冠比逐渐降低,但N100和N200施氮处理根冠比仍显著高于N0,表明适宜施氮肥N100和过量施氮肥N200处理在前期对根冠比有显著的促进作用;至秋梢旺长期,随着N100处理地上部生物量的显著升高,根冠比持续降低至与N0无显著差异,N200处理仍保持较高根冠比;至翌年春梢旺长期,各施氮处理树体根冠比均显著高于其秋梢旺长期,且N0、 N100和N200根冠比分别升高至秋梢旺长期的137.62%、 121.22%和139.71%,由高到低为N200>N0>N100,与秋梢旺长期变化趋势一致。
2.2 施氮水平对15N利用率的影响
图2可见,春梢旺长期至秋梢旺长期,不同施氮水平树体15N利用率均随着施肥时间的延长而提高,与赵林[12]等人的研究结果认为春季土施氮肥利用率随物候期的推移而提高的结论一致。不同施氮水平对树体在不同生长期15N利用率的影响存在显著差异,春梢旺长期N200和N100处理15N利用率差异不显著,由高到低为N0(1.29%)>N100(0.34%)>N200(0.25%),与巨晓堂[13]、 钟茜[14]等人的研究认为氮肥利用率随着氮肥施用量的增加而降低的结论一致。随着氮肥施入时间和生长期的延长,春梢停长期至秋梢旺长期N100处理15N利用率均显著高于N0和N200,氮肥利用率并未随着氮肥施用量的增加呈现直线下降的趋势,与刘新宇[15]等在冬小麦上的研究结果一致。至翌年春梢旺长期,各处理15N利用率由高到低仍表现为 N100>N0>N200,表明氮肥适量施用不仅利于树体当年氮肥利用率的提高,更利于翌年氮肥再利用率的提高。
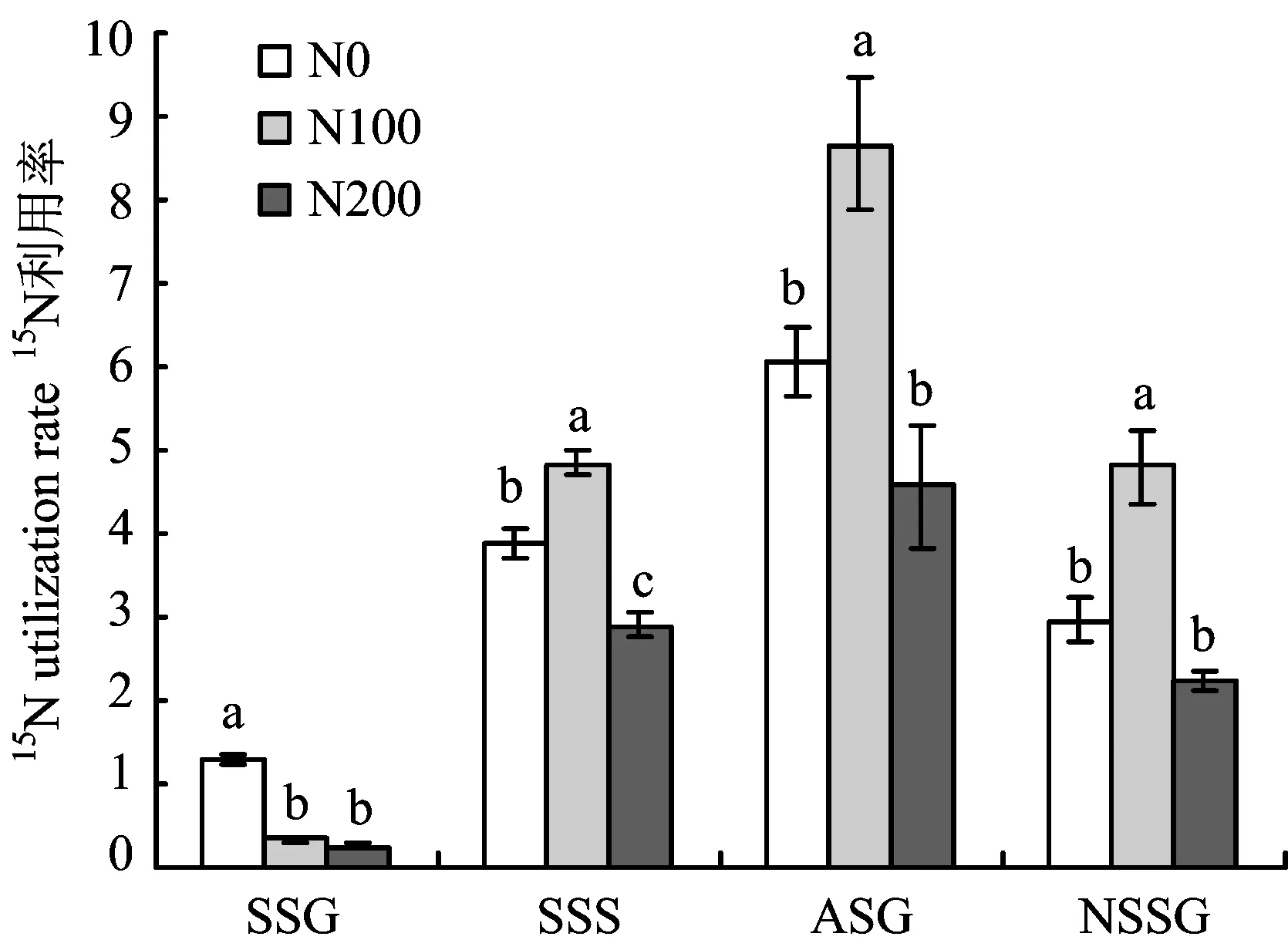
图2 施氮水平对不同生长期15N利用率的影响Fig.2 Effects of different N rates on15N utilization rate[注(Note): SSC—春梢生长期Spring shoot growing; SSS—春梢停止生长期Spring shoot stop growing;ASG—秋梢旺长期Autumn shoot growing; NSSG—翌年春梢生长期Next spring shoot growing. 图中不同字母表示同一时期处理间差异达到5%显著水平Different letters mean significant difference at the same stage at the 5% level.]
2.3 施氮水平对15N分配率的影响
器官中15N占全株15N总量的百分率反映了肥料在树体内的分布及在各器官迁移的规律[16]。本次试验结果表明,不同氮肥施用量条件下苹果幼树均表现为春梢旺长期至秋梢旺长期地上部15N分配率的逐渐升高和根系15N分配率的逐渐降低,但各物候期不同处理的叶片和根系15N分配率均存在显著差异,与赵营[17]等认为不同施氮量只影响夏玉米不同生育时期养分的阶段积累量,但对累积趋势基本无影响的结论一致。
氮肥施入至春梢旺长期,叶片15N分配率由高到低为: N0>N200>N100,根系15N分配率由高到低为: N100>N200>N0。不施氮肥N0处理树体叶片15N分配率为根系15N分配率的113.49%,叶片为最大的15N利用器官;适宜施氮肥N100处理树体叶片15N分配率为根系15N分配率的为49.15%,N200树体为74.37%,最大的15N利用器官为根系,表明低氮条件下树体新吸收的氮素营养可更为快速的运转至地上部用于新生叶片的构建,而N100和N200施氮条件下,氮肥施入初期树体生长中心为根系,新吸收的氮素营养更多分配至根系,用于根系生长和根冠比的提高。春梢停长期各施氮处理叶片均成为树体最大的15N利用器官,根系15N分配率显著降低,表明至春梢停长期,树体的生长中心均转移至地上部,吸收的氮素营养多转运至叶片用于新生器官建造。根系15N分配率由高到低分别为: N100>N200>N0,表明N100和N200树体根系仍为较强的生长中心,且N100处理对根系生长的促进作用仍显著高于N200。至秋梢旺长期,N200树体叶片15N分配率显著低于N0和N100,根系15N分配率显著高于N0和N100,表明N200施氮水平对根系生长的促进作用较N100处理更为显著,N100和N0树体各器官15N分配率未表现出显著差异。至翌年春梢旺长期,不同施氮处理树体的叶片均为最大的氮利用器官,其次为根系和枝条。N200树体叶片15N分配率低于N100和N0,根系15N分配率由高到低为: N200>N0> N100,与根冠比变化规律一致,表明至树体氮素营养在翌年各器官的再利用与分配亦表现为随着生长中心的转移而转移。各处理翌年春梢旺长期叶片15N分配率均显著高于当年春梢旺长期叶片15N分配率的结果表明,回流的氮素营养相对于当年吸收的氮素营养更优先用于春梢叶片生长,与曾骧[18]的研究认为回流的15N在翌年优先用于叶、 花和新梢生长的结论一致。
不同施氮水平对树体在氮肥施入当年和翌年不同生长期各器官的15N分配率变化规律的影响表明,施氮水平只改变树体各器官的15N分配率大小,对不同生长期15N在各器官的分配趋势无显著影响,均表现为随着生长点的转移而转移,随着生长期由春梢旺长期延长至秋梢旺长期,地上部生长势逐渐增强,地上部15N分配率逐渐提高,根系15N分配率逐渐降低,翌年春梢旺长期根冠比显著高于氮肥施入当年秋梢旺长期。
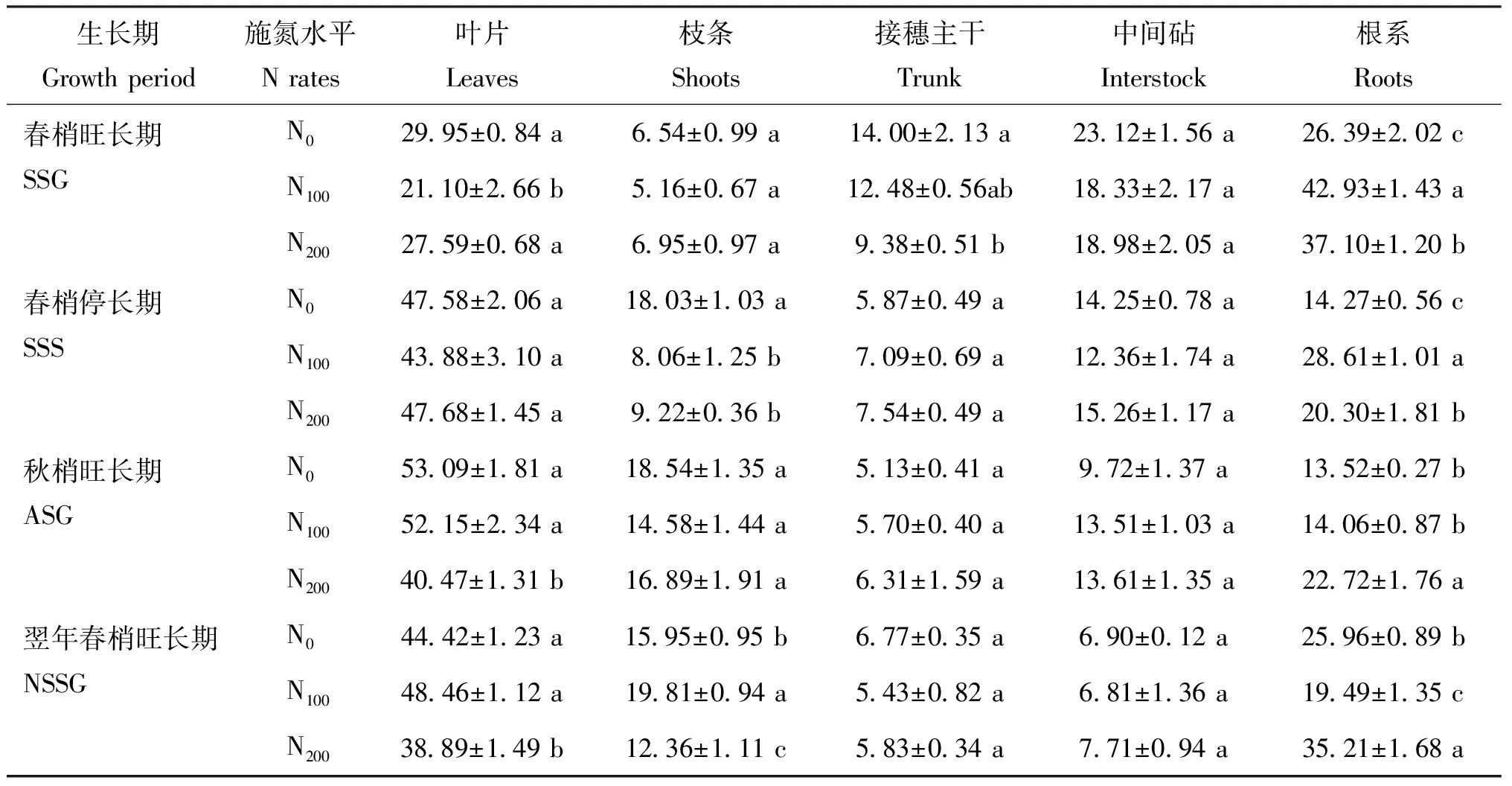
表1 施氮水平对不同生长期各器官15N分配率的影响Table 1 Effects of different N rates on ratio of15N-urea partition of different organs
注(Note): SSC—春梢生长期Spring shoot growing; SSS—春梢停止生长期Spring shoot stop growing; ASG—秋梢旺长期Autumn shoot growing; NSSG—翌年春梢生长期Next spring shoot growing. 不同小写字母表示同一列中不同施氮处理在同一时期处理间差异达到5%显著水平Different letters mean significant difference at the same stage at the 5% level.
3 讨论
氮肥施入至春梢旺长期适宜施氮肥N100处理和过量施氮肥N200处理根冠比显著升高,树体生物量有增加趋势但未表现出显著差异,随着氮肥施入时间的延长,至春梢停长期施氮对树体生长的促进作用逐渐显著,至翌年春梢旺长期方表现为适宜施氮肥对树体的促进作用较过量施氮肥更为显著,表明施氮水平对苹果矮化中间砧幼树生长的影响有一定滞后性,可能与苹果中间砧树体作为多年生植物具有贮藏营养可循环供给特性和春梢旺长期新生器官的生长主要依靠贮藏营养有关,还可能与植物氮吸收系统对氮胁迫的主要适应性响应为根冠比变化,在不同氮水平下首先通过调节根系生长及其生理学反应(如养分转运蛋白的表达及活性等)去应对环境养分供应强度的变化[4],进而促进地上部生长有关。
对树体生长抑制作用较强的M26中间砧苹果幼树的生长并不随着施氮水平增加而提高,只在适宜施氮水平下表现出较大生物量和较高氮肥利用率可能与适宜施氮肥对根系生长的促进作用有关。施氮并不会迅速促进中间砧苹果幼树地上部快速生长,而是通过促进根系Zr的大量合成[19,20,21],对氮素营养的运输和分配产生加速和定向作用,促使树体将更多的同化氮分配到根部(表1)用于根系生长[22](图1),较大根系的快速建立和细根的大量分生,有效提高了氮吸收效率可能是适宜施氮肥N100处理对树体生长的促进作用较过量施氮肥N200处理更为显著的最主要原因之一。过量施氮肥N200处理在氮肥施入初期根系15N分配率的显著升高(表1)对根系生长也产生一定促进作用(图1),但过量施氮肥条件下土壤中氮素营养超出苹果幼树生长需要量,至生长后期大量盈余氮素除以有机态、 生物态氮形式存在以外,还有较高比例以NO3--N形式存在[13],对主根生长仍有显著促进作用,但高浓度的NO3--N长期持续刺激细胞分裂素含量增加,拮抗生长素,显著降低根中3-吲哚乙酸(IAA)含量[23,24]和促进乙烯的产生,抑制细根生长[10,11](图1),虽未对树体当年生长产生显著影响,但生长后期较低的细根生物量可能是N200处理翌年春梢旺长期15N再利用率和树体生物量低于适宜施氮肥N100处理的主要原因之一。不施氮肥N0处理在秋梢旺长期新生器官生长转为依靠当年吸收氮素营养,土壤中氮素耗竭,诱导根中生长素含量增高,且通过一氧化氮介导的信号途径刺激根的伸长[9],促使树体将更多的同化氮分配到根部用于根系生长[22],因此表现为生长后期不施氮肥N0处理逐渐升高的根系15N分配率和根冠比,以及细根的大量分生,但土壤中较低的有效氮浓度仍限制了树体的快速生长。

本次试验表明,施氮对树体生长抑制作用较强的M26中间砧幼树生长的促进较为缓慢,且低氮和高氮均不利于树体矮化中间砧苹果幼树生长,而传统肥料一次性大量施用和氮素营养容易淋失、 挥发和反硝化大量损失、 肥效期短的特点容易导致施氮前期形成高氮环境而施氮后期脱肥,已不适应矮砧苹果对施氮浓度要求较高、 氮浓度过低或过高均不利于其生长的特点,可能也是矮砧苹果易早衰的主要原因,因此应根据中间砧对树体生长和氮响应影响的显著性,改变其栽培过程中的氮肥施用方式。而缓控释肥料逐渐缓慢释放养分、 使土壤速效养分的浓度可保持相对稳定,一次施用可满足植物整个生长期需要和水肥一体化可按照作物生长需求,进行全生育期的水分和养分需求实现水分和养分定量、 定时、 按比例直接提供给作物的优点,可保证苹果矮化密植集约化栽培中氮肥的充足和均衡供应,对于维持矮化中间砧苹果健壮树势、 提高产量和改善品质,实现丰产、 稳产将具有重要意义。
4 结论
1)不同供氮水平对矮化中间砧苹果生长及氮素利用率影响显著,适宜供氮促进矮化中间砧苹果生长以及氮素利用率提高,这种促进作用是随着氮肥施入时间的延长,至春稍停长期以后逐渐显现出来。
2)氮肥对幼树生长的促进作用与其可有效促进细根的发生有关。
参考文献:
[1] 陈学森, 韩明玉, 苏桂林, 等. 当今世界苹果产业发展趋势及我国苹果产业优质高效发展意见[J]. 果树学报, 2010, 27(4): 598-604.
Chen X S, Han M Y, Su G Letal. Discussion on today’s world apple industry trends and the suggestions on sustainable and efficient development of apple industry in China[J]. J. Fruit Sci., 2010, 27(4): 598-604.
[2] 姜远茂, 张宏彦, 张福锁. 北方落叶果树养分资源综合管理理论与实践[M]. 北京: 中国农业大学出版社, 2007.
Jiang Y M, Zhang H Y, Zhang F S. Concepts & practice of integrate nutrient resource management in northern deciduous fruit[M]. Beijing: China Agricultural Press, 2007.
[3] 姜远茂, 彭福田, 张宏彦. 山东省苹果园土壤有机质及养分状况研究[J]. 土壤通报, 2001, 32(4): 167-169.
Jiang Y M, Peng F T, Zhang H Y. Status of organic matter and nutrients in Shandong orchard soils[J]. Chin.J. Soil Sci., 2001, 32(4): 167-169.
[4] 米国华, 陈范骏, 张福锁. 作物养分高效的生理基础与遗传改良[M]. 北京: 中国农业大学出版社, 2012.
Mi G H, Chen F J, Zhang F S. Physiological basis and genetic improvement of nutrient use efficiency in crops[M]. Beijing: China Agricultural Press, 2012.
[5] Liao M T, Palta J A, Fillery I R. Root characteristics of vigorous wheat improve early nitrogen uptake[J]. Australian J. Agric. Res., 2006, 57: 1097-1107.
[6] 宇万太, 周 桦, 徐永刚, 等. 追施氮肥当年与翌年对桉树生长及各部位氮贮量的影响[J]. 生态学杂志, 2010, 29(9): 1703-1708.
Yu W T, Zhou H, Xu Y Getal. Eucalypt growth and nitrogen storage in the current year and next year of nitrogen top dressing[J]. Chin. J. Ecol., 2010, 29(9): 1703- 1708.
[7] 韩振海, 曾 骧, 王福钧. 晚秋叶施尿素和生长调节剂对富士苹果幼树贮藏氮素的影响[J]. 园艺学报, 1992, 19(1): 15-21.
Han Z H, Zheng X, Wang F J. Effects of autumn foliar application of 15N-urea and several pgr on N storage and reuse in apple[J]. Acta Hort. Sin., 1992, 19(1): 15-21.
[8] 罗雪华, 邹碧霞, 吴菊群, 等. 氮水平和形态配比对巴西橡胶树花药苗生长及氮代谢、 光合作用的影响[J]. 植物营养与肥料学报, 2011, 17(3): 693-701.
Luo X H, Zou B X, Wu J Qetal. Effects of different nitrogen levels and NH4+/NO3-ratios on the growth, nitrogen metabolism and photosynthesis of anther-derived somatic seedlings ofHeveabrasiliensis[J]. Plant Nutr. Fert. Sci., 2011, 17(3): 693-701.
[9] Zhao D Y, Tian Q Y, Li L H, Zhang W H. Nitric oxide is involved in nitrate-induced inhibition of root elongation in Zea mays L[J]. Ann Bot, 2007(100): 497-503.
[10] Tian Q Y, Chen F J, Liu J Xetal. Inhibition of maize root growth by high nitrate supply is correlated with reduced IAA levels in roots[J]. J. Plant Physiol, 2008 (165): 942-951.
[11] Tian Q Y, Sun P, Zhang W H. Ethylene is involved in nitrate-dependent root growth and branching in Arabidopsis thaliana[J]. New Phytol, 2009 (184): 918-931.
[12] 赵 林, 姜远茂, 彭福田, 等. 嘎拉苹果对春施15N-尿素的吸收、 利用与分配特性[J]. 植物营养与肥料学报, 2009, 15(6): 1439- 1443.
Zhao L, Jiang Y M, Peng F Tetal. Characteristics of absorption, utilization and distribution of spring soil15N-urea application for Gala/Malushupehensis[J]. Plant Nutr. Fert. Sci., 2009, 15 (6): 1439-1443.
[13] 巨晓棠, 潘家荣, 刘学军, 等. 北京郊区冬小麦/夏玉米轮作体系中氮肥去向研究[J].植物营养与肥料学报, 2003, 9(3): 264-270.
Ju X T, Pan J R, Liu X Jetal. Study on the fate of nitrogen fertilizer in winter wheat/summer maize rotation system in Beijing suburban[J]. Plant Nutr. Fert. Sci., 2003, 9(3): 264- 270.
[14] 钟茜, 巨晓棠, 张福锁. 华北平原冬小麦/夏玉米轮作体系对氮素环境承受力分析[J]. 植物营养与肥料学报, 2006, 12(3): 285-293.
Zhong Q, Ju X T, Zhang F S. Analysis of environmental endurance of winter wheat/summer maize rotation system to nitrogen in North China Plain[J]. Plant Nutr. Fert. Sci., 2006, 12 (3): 285-293.
[15] 刘新宇, 巨晓棠, 张丽娟, 等. 不同施氮水平对冬小麦季化肥氮去向及土壤氮素平衡的影响[J]. 植物营养与肥料学报, 2010, 16(2): 296-303.
Liu X Y, Ju X T, Zhang L Jetal. Effects of different N rates on fate of N fertilizer and balance of soil N of winter wheat[J]. Plant Nutr. Fert. Sci., 2010, 16 (2): 296-303.
[16] 顾曼如, 束怀瑞, 周宏伟. 苹果氮素营养研究Ⅳ贮藏15N的运转、 分配特性[J].园艺学报, 1986, 13 (1): 25-30.
Gu M R, Shu H R, Zhou H W. A study on the nitrogen nutrition of apple trees IV. The characters of translocation and distribution of the reserved15N[J]. Acta Hort. Sin., 1986, 13 (1): 25-30.
[17] 赵营, 同延安, 赵护兵.不同供氮水平对夏玉米养分积累、 转运及产量的影响[J]. 植物营养与肥料学报, 2006, 12(5): 622-627.
Zhao Y, Tong Y A, Zhao H B. Effects of different N rates on nutrients accumulation, transformation and yield of summer maize[J]. Plant Nutr. Fert. Sci., 2006, 12(5): 622-627.
[18] 曾骧. 枣树叶片内氮素贮藏和循环利用的研究[J]. 核农学报, 1991, 5(1): 37-43.
Zeng X. Storage and recycling utilization of leaf-nitrogen of jujube tree[J]. J. Nucl. Agric. Sci., 1991, 5(1): 37-43.
[19] Beck E H. Regulation of shoot/root ratio by cytokinins from roots in Urtica dioica: opinion[J]. Plant Soil, 1996(185): 3-12.
[20] Takei K, Sakakibara H, Sugiyama T. Identification of genes encoding adenylate isopentenyltransferase, a cytokinin biosynthesis enzyme, in Arabidopsis thaliana[J]. J. Biol. Chem., 2001, 276(28): 26405-26410.
[21] 周鹏, 彭福田, 魏绍冲, 等. 氮素形态对平邑甜茶细胞分裂素水平和叶片生长的影响[J]. 园艺学报, 2007, 34(2): 269-274.
Zhou P, Peng F T, Wei S Cetal. Effects of rhizosphere nitrate and ammonium on the level of cytokinins and leaf growth ofMalushupenensisRehd[J]. Acta Hort. Sin., 2007, 34(2): 269-274.
[22] 李燕婷, 米国华, 陈范骏, 等. 玉米幼苗地上部/根间氮的循环及其基因差异[J].植物生理学报, 2001, 27(3): 226-230.
Li Y T, Mi G H, Chen F Jetal. Genotypic difference of nitrogen recycling between root and shoot of maize seedlings[J]. Acta Phytoph. Sin., 2001, 27(3): 226-230.
[23] Walch L P, Ivanov, I I, Filleur Setal. Nitrogen regulation of root branching[J]. Ann. Bot., 2006, 97: 875-881.
[24] Caba J M, Centeno M L, Fernandez Betal.Inoculation and nitrate alter phytohormone levels in soybean roots: differences between a supernodulating mutant and the wild type[J]. Planta, 2000, 211: 98-104.
