生草对渭北旱地苹果园土壤有机碳组分及微生物的影响
2014-03-30刘富庭张林森李雪薇李丙智韩明玉王晓琳
刘富庭, 张林森*, 李雪薇, 李丙智, 韩明玉, 谷 洁, 王晓琳
(1 西北农林科技大学园艺学院,陕西杨凌 712100; 2 西北农林科技大学资源环境学院,陕西杨凌 712100)
diversity of soil microbial community
黄土高原是中国苹果两大优产区之一,以渭北地区为代表的黄土高原苹果产业已成为促进区域经济发展、改善生态环境的支柱产业。本地区苹果生产中存在的一个突出问题是果园土壤干旱和有机质含量偏低,对果实品质影响较大。因此,在大部分没有灌溉条件的旱地果园,如何提高果园的土壤有机质含量、加速有机质的转化是重点关注的问题。近几年,由于果园生草具有蓄水保墒、培肥地力、调节果园小气候等作用[1-3],因此得到试验推广。但是,生草对苹果园土壤有机质的含量及其组分转化和土壤微生物群落的影响还不十分清楚。特别是土壤微生物往往有累积效应或长期效应,短时间内不容易观察到,需要长期实施农业管理措施后才能显现。因此,研究生草对苹果园土壤有机质及微生物的影响对于本地区苹果产业持续健康发展具有重要意义。
土壤有机质中所含的碳称为土壤有机碳(soil organic carbon,SOC),是评价土壤质量的一个重要指标[4]。土壤活性有机碳(labile organic carbon,LOC)较总有机碳对农业管理措施改变而导致的变化反应更迅速[5-6]。因此,其更可能作为反映土壤质量变化的敏感性指标。土壤活性有机碳通常包括颗粒有机碳、热水提取有机碳、微生物量碳和易氧化有机碳等[7]。而土壤微生物是土壤有机物转化的执行者,又是植物营养元素的活性库[8-9]。微生物群落结构或微生物多样性,与土壤可持续利用的关系可能更密切,更能敏感地反映土壤质量的变化[10],并具有较好的时效性,作为土壤质量的生物活性指标已被广泛接受。目前我国对果园生草的研究大多是关于土壤理化性状、果园生态环境及果实品质等方面,关于果园生草条件下对土壤碳库影响的研究较少,已有的研究工作也多集中在土壤总碳的变化,而对活性有机碳的关注甚少,有关土壤微生物群落多样性的研究主要侧重于不同土壤类型、施肥措施、植被根系等[11-14],生草方式对土壤微生物群落多样性的影响缺乏系统的研究。本研究将生草技术引入旱作果园土壤管理中,对比分析生草条件下对苹果园土壤有机碳各组分及微生物的影响,为生草措施在果园中的进一步推广应用提供技术支撑。
1 材料与方法
1.1 试验地概况


1.2 试验设计
试验于2009年3月进行。行间种草,宽度为3 m。试验设毛苕子(Viciavillosa)、白三叶(Trifoliumrepens)、黑麦草(Loliumperenne)和早熟禾(Poapratensis)及清耕(CK)5个处理。重复3次,随机区组设计,每小区面积为12 m×14 m。四种牧草播种量均为7.5 kg/hm2,连续生草4年,各小区除试验处理外其它管理措施一致,施肥均在果树根部,行间不施肥。生草区每年刈割3次,覆盖于果树行间。
1.3 土样的采集和预处理
2012年10月初每个处理小区内随机选取10个点,分别采集0—20 cm、20—40 cm、40—60 cm、60—80 cm、80—100 cm土层土壤,同一小区的同层土样均匀混合作为一个单独样本,剔除土壤样品中石砾等杂物。然后将采集土样分成两份,其中一份田间刚采集的湿润土样混匀过2 mm 筛,装入塑封袋中,冰盒中保存,12 h内运回实验室放入4℃冰柜中,次日开始分析; 另一部分土壤样品风干后过2 mm筛,保存。对采集土样及时进行土壤有机碳组分和土壤微生物碳源利用多样性的测定分析。
1.4 测定项目和方法
1.4.1 土壤轻质有机碳(LFOC)的测定 称取风干土样25 g 于100 mL 离心管中,然后加入比重为1.7 g/cm3的NaI 溶液50 mL,于200 r/min 条件下振荡1 h。然后以1000×g转速下离心20 min,将浮在NaI 表层的轻质部分倾倒于装有0.45 μm 纤维滤膜的过滤器中进行抽滤。然后用蒸馏水将滤膜表面附着的轻质有机质转移至烧杯。随后向该离心管中再加入50 mL 质量浓度为1.70 g/mL 的NaI 溶液进行第二次浸提,方法同上。将2 次取得的轻质有机质合并,依次再用0.01 mol/L CaCl2和蒸馏水抽滤冲洗,转移至烧杯,在60℃下烘干、称质量。烘干的轻质有机质用玛瑙研钵研细过0.15 mm 筛后保存,用岛津TOC-SSM-5000A 碳分析仪测定。
1.4.2 土壤颗粒有机碳(POC)测定 取25.00 g 风干土,过2 mm 孔径土壤筛,放入250 mL 塑料瓶,加100 mL质量浓度为5 g/L 的( NaPO3)6溶液,先手摇3 min,再用往复式振荡器(90 r/min 转速) 振荡18 h。把土壤悬液过53 μm 筛,反复用蒸馏水冲洗,取所有留在筛子上的物质,在60℃烘48 h 至恒重,用岛津TOC-SSM-5000A 碳分析仪测定。


1.4.5 可溶性有机碳(DOC)测定 取10 g 新鲜土样,按照土 ∶水为1 ∶5的比例混匀,在25℃条件下,以250 r/min 的速度振荡1 h,接着在转速为15000 r/min离心10 min,上部悬浮液过0.45 μm薄滤膜,过滤液用Liquic TOC II有机碳分析仪测定。

1.4.7 土壤微生物群落功能多样性分析 土壤微生物碳源利用多样性应用BIOLOG 生态测试板(ECO MicroPlate,美国Matrix Technologies Corporation 生产)测定。BIOLOG 分析在采样后48 h内进行。称取相当于5 g烘干土重的新鲜土样加入内有45 mL 无菌水的三角瓶中,加无菌棉花塞,振荡30 min 后,按逐步稀释法,依次稀释为10-2、10-3梯度液。用10-3稀释液接种ECO生态测试板,接种量为150 μL,每样1板,每板3 次重复。将接种好的测试板加盖,在(25±1)℃下连续培养10 d,每隔24 h 用BIOLOG 自动读数装置在590 nm 下读数。
1.5 数据处理
1.5.1 孔平均颜色变化率(average well-color development,AWCD)
AWCD = Σ(Ci - R)/31
式中,Ci 为各反应孔在590 nm 下的光密度值;R 为ECO 板对照孔A1 的光密度值;Ci-R<0 的孔均在计算中记为零,即Ci-R的值均≥0。采用孔平均颜色变化率法测定土壤微生物利用单一碳源的能力。
1.5.2 群落Shannon 指数(H)
H = -ΣPi×lnPi
式中,Pi =(Ci - R)/Σ(Ci - R),表示有碳源的孔与对照孔A1 的光密度值之差与整板总差的比值。
1.5.3 群落丰富度指数(S) 用碳源代谢孔的数目(AWCD>0.2 则代表该孔碳源被利用,该孔即为反应孔)表示群落丰富度指数。
采用丰富度指数和多样性指数表征土壤微生物群落功能多样性。本试验采用BIOLOG 微平板培养96 h的数据进行统计分析。
1.5.4 数据统计分析 经Excel整理后,采用SPSS17.0软件包进行统计方差分析,用SigmaPlot10.0软件完成绘图。
2 结果与分析
2.1 不同生草处理对土壤有机碳各组分的影响


图1 生草对土壤总有机碳含量的影响Fig.1 Effects of planting grasses on total organic carbon (TOC) content in soil
2.1.2 土壤颗粒有机碳 图2表明,处理区和对照区土壤颗粒有机碳(POC)含量亦随土壤深度增加而降低。与清耕相比,苹果树行间种草使0—40 cm土层土壤POC含量显著升高。在0—20 cm 表层土壤中,毛苕子和白三叶处理区的土壤POC含量增幅较大,与CK相比,分别增加了0.33 g/kg和0.28 g/kg,而黑麦草和早熟禾处理增幅较小,只增加了0.20 g/kg和0.14 g/kg,而同一科属的处理间没有显著性差异。在20—40 cm土层中,种植毛苕子处理的POC含量最高,黑麦草和早熟禾处理次之,白三叶的POC含量最小。与CK相比,四种生草处理的POC含量分别增加了54%、37%、32%和30%。毛苕子的POC含量显著高于其他三种牧草,而白三叶、黑麦草和早熟禾处理间差异不显著。40—100 cm土层中,各处理间POC含量没有显著差异。这表明牧草丰富的根系对表层土壤土粒的缠绕、串连固结以及根际沉积物对土粒的团聚胶结十分有利,促进了颗粒有机碳的形成。

图2 生草对土壤颗粒有机碳含量的影响Fig. 2 Effects of planting grasses on particulate organic carbon (POC) content in soil
2.1.3 土壤轻质有机碳 从图3可以看出,各生草处理中,土壤轻质有机碳(LFOC)含量亦随土层深度的增加而呈现降低趋势。在0—40 cm土层中生草处理的土壤LFOC含量与清耕处理差异明显。表层土壤中,豆科牧草毛苕子和白三叶的LFOC含量显著高于禾本科牧草黑麦草和早熟禾,但同一科属的处理间差异不显著。而在亚表层土壤中,毛苕子的LFOC含量显著高于其他三种生草处理,其中,黑麦草和早熟禾的LFOC含量略高于白三叶,但差异不明显。这与四种生草处理对土壤POC含量的影响结果一致。40cm以下土层中各生草处理后的LFOC含量与CK相比差异不明显。上述结果表明,生草可以显著增加果园0—40 cm土层土壤的LFOC含量。

图3 生草对土壤轻质有机碳含量的影响 Fig.3 Effects of planting grasses on soil light fraction organic carbon (LFOC) content
2.1.4 土壤易氧化有机碳 由图4可见,与土壤TOC情况一致,土壤易氧化有机碳(ROC)含量随土壤深度的增加而降低。在0—20 cm 表层土壤中,毛苕子ROC含量最高,白三叶次之,黑麦草和早熟禾最小。土壤ROC含量大小排序依然是豆科牧草>禾本科牧草。而在亚表层土壤中,土壤ROC含量大小排序为:毛苕子>黑麦草>早熟禾>白三叶>清耕,这与前面研究的POC、LFOC变化趋势一致。同样,在40—100 cm土层中,各处理没有显著性差异。

图4 生草对土壤易氧化有机碳含量的影响Fig.4 Effects of planting grasses on soil readily oxidizable organic carbon (ROC) content
2.1.5 土壤可溶性有机碳 从图5可以看出,生草显著增加了土壤0—40 cm土层的土壤可溶性有机碳(DOC)含量。0—20 cm土层中,种植豆科牧草的土壤DOC含量明显高于禾本科牧草,最高含量可达286.4 mg/kg。同样在0—40 cm土层中,种植毛苕子处理的土壤DOC含量显著高于其他三种生草处理,与清耕相比,提高了27%。由此可见,豆科类牧草较禾本科牧草更加有利于提高土壤DOC的含量。40 cm以下土层中,各处理间的土壤DOC含量差异不明显。

图5 生草对土壤可溶性有机碳含量的影响Fig.5 Effects of planting grasses on soil dissolved organic carbon (DOC) content


图6 生草对土壤微生物碳含量的影响Fig. 6 Effects of planting grasses on soil microbial biomass organic carbon (MBC) content
2.2 不同生草处理对土壤微生物群落功能多样性的影响
2.2.1 ELISA 反应平均颜色变化率(AWCD) AWCD表征微生物群落碳源利用率,是土壤微生物群落利用单一碳源能力的一个重要指标,反映了土壤微生物活性、微生物群落生理功能多样性。土壤连续培育10 d,每隔24 h 测得的ELISA(酶联免疫吸附测定法,Enzyme-Linked Immunosorbent Assay)反应AWCD 值变化(图7),分析发现AWCD随培养时间的延长而提高,各处理的AWCD 在24 h之前很小,说明在24 h之内碳源基本未被利用;培养24 h 后AWCD 快速升高,反映出此后碳源被大幅度利用,其中毛苕子处理的增长斜率最大。由图7可知,在培养结束时,生草处理的AWCD 均高于清耕(CK)处理,与CK处理差异显著(P<0.05),这表明生草能显著提高AWCD 值,而豆科牧草提高AWCD值更加明显。

图7 生草处理的平均颜色变化率 Fig.7 AWCD of planting grasses treatments
2.2.2 土壤微生物群落多样性指数分析 土壤微生物群落功能多样性是土壤微生物群落状态与功能的指标,反映土壤中微生物的生态特征。从表1可以看出,BIOLOG 微平板培养96 h 时,毛苕子、白三叶、黑麦草和早熟禾处理的AWCD分别是清耕(CK)的3倍、 2.74倍、 2.02倍和1.85倍(P<0.05)。其中,毛苕子和白三叶豆科牧草处理区的AWCD值显著高于禾本科牧草(P<0.05)。
不同生草处理的微生物群落Shannon 指数(H)进行比较,毛苕子、白三叶、黑麦草和早熟禾处理较清耕(CK)处理均显著提高(P<0.05)。其中,毛苕子处理的微生物群落Shannon 指数(H)最高,与黑麦草、早熟禾处理相比,差异显著(P<0.05)。而与白三叶处理的微生物群落Shannon 指数(H)没有显著差异。
从不同处理的微生物群落丰富度指数(S)看,豆科植物和禾本科植物处理区的微生物群落丰富度指数(S)均高于清耕(CK)处理。其中毛苕子处理较高,与清耕(CK)差异显著(P<0.05),白三叶次之,黑麦草和早熟禾最低。这表明种植豆科牧草毛苕子和白三叶与禾本科牧草黑麦草和早熟禾都可以提高土壤微生物群落的丰富度和功能多样性,而毛苕子对土壤微生物群落的丰富度和功能多样性效果更好一些,与黑麦草和早熟禾相比差异明显(P<0.05)。
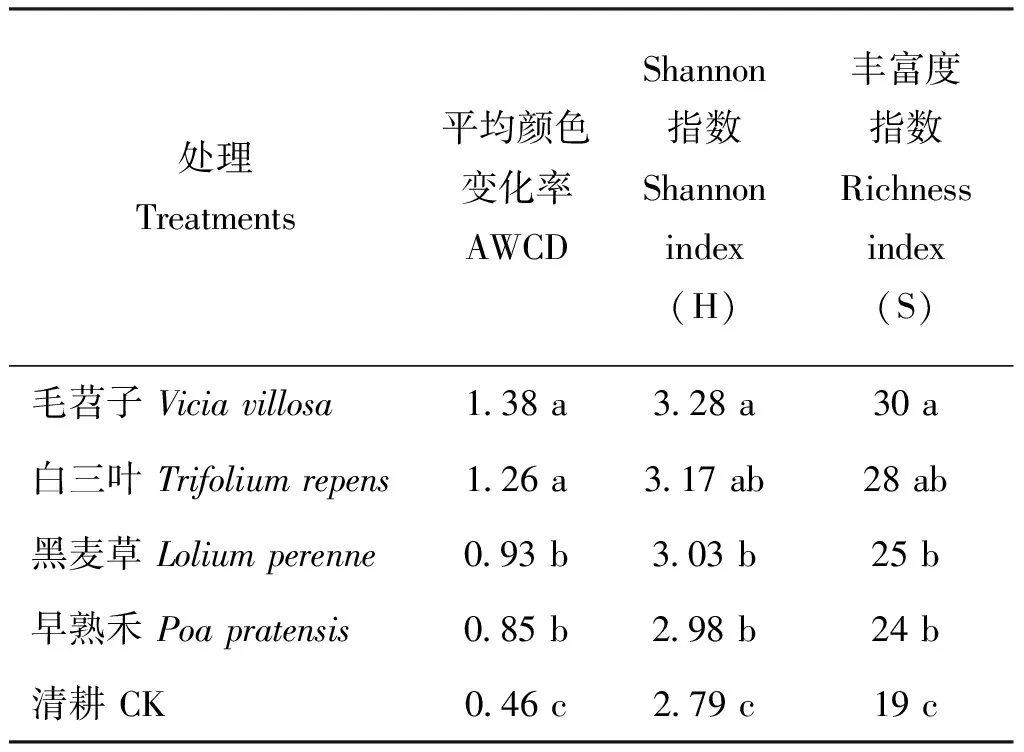
表1 土壤微生物群落多样性指数分析Table 1 Analyses of soil microbial communities diversity index
注(Note): 同列数据后不同字母表示差异显著(P<0.05)Values followed by different letters in the same column are significantly different (P<0.05).


图8 31种主成分方差贡献率Fig.8 Variance percent of 31 principal components

图9 生草处理土壤微生物群落的主成分分析Fig.9 Principal component analysis of soil microbial community in planting grasses treatments
3 讨论与结论
果园生草是指在果树行间或全园(树盘除外)种植草本植物作为地表覆盖的一种土壤管理模式,是人工构建的具有多物种、多层次、多时序的复合系统[1]。本研究结果表明,生草处理增加了0—40 cm土壤TOC、POC、LFOC、ROC、DOC和MBC的含量。生草处理中,主要是生草产生的大量枯落物和根系等有机物料的添加,提供了可供降解的有机碳源,从而保证了有机物质的充分供应。此外,生草可以有效地覆盖土壤表层,减少了对土壤表层的扰动,避免了有机碳因长期暴露在空气中而被氧化和风蚀,这也有助于减少土壤表层有机碳的损失[15]。而且,在干旱半干旱地区,降水的季节分布差异很大,由此导致频繁的土壤干湿交替对有机碳在土壤中的累积也有重要影响。干湿交替容易使土壤团聚体破裂,使土壤有机碳的矿化分解量增加[16]。而生草可以蓄水保墒,减小土壤温、湿度的变化幅度[3],从而起到提高土壤有机碳的作用。
土壤有机碳各组分含量随着土壤深度的增加而降低的特点与果树、牧草等的枯落物、牧草的地上地下物质分配、根系深度和根生物量密切相关。土壤有机碳主要来源于枯落物和根系分解所产生的有机质,因此它们的分布变化将影响土壤有机碳输入的模式、速度、质量和数量[17]。果园-牧草生态系统中,枯落物集中在土壤表层,植被根系也主要集中在0—40 cm土层,所以在0—40 cm的土壤枯落物和根系被微生物分解产生的各种有机碳组分相对集中,尤其集中在表层(0—20 cm)土壤,相应的有机碳含量就会高于下层。因此有机碳各组分表现出随土层深度的增加而递减的趋势,这与前人大部分研究结果相一致[18-20]。
土壤微生物是土壤有机质的活性库,在土壤有机质的分解和养分循环中起重要作用,是反映土壤微生物活性的直接指标[21]。已有研究[22]表明,行间生草可以增加黄土高原地区果园土壤微生物的数量。这与本研究结果基本一致,果园生草处理后,显著增加了土壤微生物的活性和微生物群落生理功能多样性(P<0.05),与土壤微生物量碳显著增加相一致。由于生草处理改善了土壤的温度和水分条件,为微生物的生长营造了良好的生存环境,减少了对土壤的扰动,果园及牧草根茎系统的分泌物和枝叶残体为土壤中微生物的活动提供了必需的营养物质[1],有利于微生物的生长繁殖。
由本研究结果可以看出,豆科牧草白三叶和毛苕子处理的土壤微生物活性和微生物群落生理功能多样性显著高于禾本科牧草黑麦草和早熟禾。豆科牧草根系共生的根瘤菌固氮能力强于禾本科牧草,前人的大量研究表明,果园种植的豆科作物的固氮作用可以提高土壤N的净输入,使土壤氮含量升高[23-25]。惠竹梅等[26]通过土壤微生物量与土壤养分的通径分析表明,土壤全氮和碱解氮是影响微生物量碳的直接因子,从而得出土壤中氮素含量较高、有机质含量适当时,有利于土壤微生物量积累和微生物活性提高的结论。齐雁冰等[27]研究同样指出,在土壤有机质和全氮提高的同时,C/N的降低可以提高微生物活性,加快有机质的分解矿化。另外,赵政阳等[28]研究表明,禾本科牧草黑麦草的土壤有效磷含量显著高于豆科牧草白三叶,而黎宁等[29]研究指出,偏高的有效磷/碱解氮比例对微生物生长不利,土壤养分比例会对土壤微生物产生影响。这可能是豆科牧草的微生物量和微生物活性显著高于禾本科牧草的原因。
在生草处理0—20 cm的表层土壤中,豆科牧草白三叶和毛苕子的土壤有机碳含量显著高于禾本科牧草黑麦草和早熟禾,原因可能是豆科牧草提供的养分环境更加适合土壤微生物的生长。土壤微生物量升高,促进土壤有机质的更新与活化,进而使土壤活性有机碳含量也会随之升高。禾本科植株的C/N值大于豆科植物,而有研究结果指出,有机残体的碳氮比较大时会限制微生物的生长繁殖及有机残体的分解[30]。本研究在豆科与禾本科植株的碳含量测定中,豆科牧草毛苕子、白三叶的干物质含碳量分别为35.18%和34.72%,禾本科牧草黑麦草和早熟禾的干物质含碳量分别为33.51%和31.64%,而四种牧草的干草年产量分别为8350、7200、6940、6230 kg/hm2,这说明虽然豆科牧草植株C/N值小于禾本科植物,但豆科牧草的总碳量明显高于禾本科,从而为微生物提供更多的碳源。在20—40 cm土层土壤中,表现出白三叶处理的活性有机碳含量低于禾本科牧草黑麦草和早熟禾。白三叶根系较浅,而毛苕子、黑麦草及早熟禾的根系相对较深,在20—40 cm土层中的根系分布前者要小于后三种牧草。于寒青等[31]研究认为,较为发达的根系可为土壤微生物栖息提供更好的场所,并产生更多根系分泌物促进土壤微生物活动,使得有机残体分解更强烈。Vepsalainen等[32]研究同样表明,根系残体和根系分泌物有利于微生物生长繁殖,促进微生物活性提高,而微生物量的提高反过来影响土壤活性有机碳的含量升高。
李会科等[33]指出,在西北干旱半干旱的果园区选择根系浅的三叶草作为果园生草品种为宜。而霍颖等[34]的研究表明,在北京地区种植黑麦草比种三叶草效果要好。出现这两种截然不同的研究结果的原因可能与地域环境有关。选用生草品种应根据不同地区的环境气候等因素而定。本研究结果表明,豆科牧草毛苕子提高有机碳和微生物含量明显,所以在无灌溉条件的渭北旱地苹果园种植产草量较大的毛苕子效果较好,其次为白三叶。但是,生草在我国果园应用的时间较短,相关研究也处于起步阶段,许多问题还亟待解决,不同草种地上地下部生物干物质降解对有机碳各组分的贡献以及微生物的具体转化机理还需要进一步深入研究。
参考文献:
[1] 李会科, 李金玲, 王雷存, 等. 种间互作对苹果/白三叶复合系统根系生长及分布的影响[J]. 草地学报, 2011, 19(6): 960-968.
Li H K, Li J L, Wang L Cetal. Effects of interspecific interaction on the growth and distribution of roots in apple-white clover intercropping system[J]. Acta. Agrestia. Sin., 2011, 19(6): 960-968.
[2] 寇建村, 杨文权, 韩明玉, 等. 我国果园生草研究进展[J]. 草业科学, 2010, 27(7): 154-158.
Kou J C, Yang W Q, Han M Yetal. Research progress on interplanting grass in orchard in China[J]. Pratac. Sci., 2010,27(7): 154-158.
[3] 梅立新, 李会科. 渭北旱地苹果园生草小气候效应研究[J].干旱区农业研究, 2010, 28(1): 187-192.
Mei L X, Li H K. Effects of interplanting different herbage on microclimate in apple orchards in the area of Weibei plateau[J].Agric. Res. Arid Areas, 2010, 28(1): 187-192.
[4] Wu T Y, Schoenau J J, Li F M. Effect of tillage and rotation on organic forms of chernozemic soils in Saskachewan[J]. J. Plant Nutr. Soil Sci. 2003, 166: 328-335.
[5] 张海林, 高旺盛, 陈阜, 等. 保护性耕作研究现状、发展趋势及对策[J]. 中国农业大学学报, 2005, 10(1): 16-20.
Zhang H L, Gao W S, Chen Fetal. Prospects and present situation of conservation tillage[J]. J. China. Agric. Univ., 2005,10(1): 16-20.
[6] 邵月红, 潘剑君, 孙波. 不同森林植被下土壤有机碳的分解特征及碳库研究[J]. 水土保持学报, 2005, 19(3): 24-28.
Shao Y H, Pan J J, Sun B. Study on characteristics of soil organic carbon decompositions and carbon pool under different vegetations[J]. J. Soil Water. Conserv., 2005, 19(3): 24-28.
[7] Von L M, Kogel K I, Ekschmitt Ketal. SOM fractions methods: Relevance to functional pools and to stabilization mechanisms[J]. Soil Biol. Biochem., 2007, 39: 2183-2207.
[8] Riffaldi R, Saviozzi A, Levi M Retal. Biochemical properties of a Mediterranean soil as affected by long-term crop management systems[J].Soil Till. Res., 2002, 67: 109-114.
[9] Srivastava S C, Singh J S. Microbial C, N and P in dry tropical forest soils: Effects of alternate land-uses and nutrient flux[J].Soil Biol. Biochem., 1991,23(2): 117-124.
[10] Young I M, Crawford J W. Interactions and self-organization in the soil-microbe complex[J]. Science, 2004, (3/4): 1634-1637.
[11] Rogers B F, Tate R L. Temporal analysis of the soil microbial community along a toposequence in pine land soils[J]. Soil Biol.Biochem., 2001, 33(10): 1389-1401.
[12] Bossio D A, Scow K M. Impact of carbon and flooding on the metabolic diversity of microbial communities in soils[J]. Appl.Environ. Microbial., 1995, 61: 4043-4050.
[13] Buyer J S, Drinkwater L E. Comparison of substrate utilization assay and fatty acid analysis of soil microbial communities[J]. J. Microbiol. Methods, 1997, 30: 3-11.
[14] Zabinski C A, Gannon J E. Effects of recreational impacts on soil microbial communities[J]. Environ. Manage., 1997, 21(2): 233-238.
[15] 秦红灵, 高旺盛, 马月存, 等. 免耕对农牧交错带农田休闲期土壤风蚀及其相关土壤理化性状的影响[J]. 生态学报, 2007,(27): 3378-3384.
Qin H L, Gao W S, Ma Y Cetal. Effects of no-tillage on soil properties affecting wind erosion during fallow in Ectone of north China[J]. Acta Ecol. Sin., 2007, (27): 3378-3384.
[16] 黄昌勇. 土壤学[M]. 北京: 中国农业出版社. 2000.
Huang C Y. Soil[M]. Beijing: China Agricultural Press. 2000
[17] IGBP Terrestrial Carbon Working Group. The terrestrial carbon cycle: Implications for the Kyoto Protocol[J]. Science, 1998, 280: 1393-1394.
[18] 解宪丽, 孙波, 周慧珍, 等. 中国土壤有机碳密度和储量的估算与空间分布分析[J]. 土壤学报, 2004, 41(1): 35-43.
Xie X L, Sun B, Zhou H Zetal. Organic carbon density and storage in soils of China and spatial analysis[J]. Acta Pedol. Sin., 2004, 41(1): 35-43.
[19] 方运霆, 莫江明, Brown S. 鼎湖山自然保护区土壤有机碳贮量和分配特征[J]. 生态学报, 2004, 24(1): 135-142.
Fang Y T, Mo J M, Brown S. Storage and distribution of soil organic carbon in Dinghushan Biosphere Reserve[J]. Acta Ecol.Sin., 2004, 24(1): 135-142.
[20] 赵锦梅, 高超, 张德罡. 祁连山东段不同退化高寒草旬土壤有机碳密度研究[J]. 草地学报, 2010, 18(1): 21-26.
Zhao J M, Gao C, Zhang D G. Study on the soil organic carbon density of alpine meadow with different degradation degrees in eastern Qilian Mountains[J]. Acta. Agrestia Sin., 2010, 18(1): 21-26.
[21] Alvarez C R, Alvarez R. Short-term effects of tillage systems on active soil microbial biomass[J]. Biol. Fert. Soils, 2000, 31: 157-161.
[22] 惠竹梅, 岳泰新, 张瑾, 等. 西北半干旱区葡萄园生草体系中土壤生物学特性与土壤养分的关系[J]. 中国农业科学,2011, 44(11): 2310-2317.
Hui Z M, Yue T X, Zhang Jetal. Relationship between soil biological characteristics and nutrient content under grass inter- cropping system of vineyard in northwestern semiarid area[J]. Sci. Agric. Sin., 2011, 44(11): 2310-2317.
[23] Steenwerth K, Belina K M. Cover crops and cultivation: Impacts on soil N dynamics and microbiological function in a Mediterranean vineyard agroecosystem[J]. Appl. Soil Ecol., 2008, 40: 370-380.
[24] King A P, Berry A M. Vineyard δ15N, nitrogen and water status in perennial clover and bunch grass cover crop systems of California’s central valley[J]. Agric. Ecos. Environ., 2005, 109: 262-272.
[25] Drinkwater L E, Wagoner P, Sarrantonio M. Legume-based cropping systems have reduced carbon and nitrogen losses[J].Nature, 1998, 396: 262-265.
[26] 惠竹梅, 岳泰新, 张振文, 等. 行间生草葡萄园土壤微生物量与土壤养分的通径分析[J]. 草地学报, 2011, 19(6): 969-974.
Hui Z M, Yue T X, Zhang Z Wetal. Path analysis between soil microbial biomass and soil nutrient contents in cover cropping system of vineyard[J]. Acta. Agrestia Sin., 2011, 19(6): 969-974.
[27] 齐雁冰, 黄标, 顾志权, 等. 长江三角洲典型区农田土壤碳氮比值的演变趋势及其环境意义[J]. 矿物岩石地球化学通报,2008, 27(1): 50-56.
Qi Y B, Huang B, Gu Z Qetal. Spatial and temporal variation of C/N ratios of agricultural soils in typical area of Yangtze delta region and its environmental significance[J]. Bull. Min. Pet., 2008, 27(1): 50-56.
[28] 李会科, 张广军, 赵政阳, 等. 黄土高原旱地苹果园生草对土壤养分的影响[J]. 园艺学报, 2007, 34(2): 447-480.
Li H K, Zhang G J, Zhao Z Yetal. Effects of interplanting of herbage on soil nutrient of non-irrigated apple orchard in the Loess Plateau[J]. Acta Hortic. Sin., 2007, 34(2): 447-480.
[29] 黎宁, 李华兴, 朱凤娇, 等. 菜园土壤微生物生态特征与土壤理化性质的关系[J]. 应用生态学报, 2006, 17(2): 285-290.
Li N, Li H X, Zhu F Jetal. Relationships between soil microbial ecological characteristics and physical-chemical properties of vegetable soil[J]. Chin. J. Appl. Ecol., 2006, 17(2): 285-290.
[30] 史央, 蒋爱芹, 戴传超, 等. 秸秆降解的微生物学机理研究及应用进展[J]. 微生物学杂志, 2002, 22(1): 47-50.
Shi Y, Jiang A Q, Dai C Cetal. Advances in microbiological mechanism and application of straw degradation[J]. J. Microbiol., 2002, 22(1): 47-50.
[31] 于寒青, 李勇, 金发会, 等. 黄土高原植被恢复提高大于0.25mm 粒级水稳性团聚体在土壤增碳中的作用[J]. 植物营养与肥料学报, 2012, 18(4): 876-883.
Yu H Q, Li Y, Jin F Hetal. The role of increasing soil water-stable aggregates with diameter > 0.25 mm by vegetation restoration in the enhancement of soil organic carbon in the Loess Plateau[J]. Plant Nutr. Fert. Sci., 2012, 18(4): 876-883.
[32] Vepsalainen M, Erkomaa K, Kukkonen Setal. The impact of crop plant cultivation and peat amendment on soil microbial activity and structure[J]. Plant Soil, 2004, 264: 273-286.
[33] 李会科, 郑秋玲, 赵政阳. 黄土高原果园种植牧草根系特征的研究[J]. 草业学报, 2008, 17(2): 92-96.
Li H K, Zheng Q L, Zhao Z Y. Study on the root system distribution characteristics of several herbage species growing in apple orchard in Loess Plateau[J]. Acta Pratac. Sin., 2008, 17(2): 92-96.
[34] 霍颖, 张杰, 王美超, 等. 梨园行间种草对土壤有机质和矿质元素变化及相互关系的影响[J]. 中国农业科学, 2011, 44(7): 1415-1424.
Huo Y, Zhang J, Wang M Cetal. Effects of inter-row planting grasses on variations and relationships of soil organic matter and soil nutrients in pear orchard[J]. Sci. Agric. Sin., 2011, 44(7): 1415-1424.
