大豆球蛋白间接竞争ELISA 检测方法的建立
2014-03-27布冠好朱婷伟陈复生刘昆仑张丽芬
布冠好,朱婷伟,陈复生,张 楠,刘昆仑,张丽芬
(河南工业大学 粮油食品学院,河南 郑州 450001)
0 引言
大豆和大豆副产品因为其较高的营养价值和良好的物理化学性质,被广泛应用于食品和饲料工业中.然而,大豆蛋白长期以来也被认为是食物过敏原之一.此外,由于大豆蛋白过敏原可能在幼龄动物及人体内引起潜在的过敏反应,随着大豆蛋白产品在食品工业中使用量的增加,大豆蛋白致敏性的研究也越来越多[1].在大豆中,至少检测到21 种致敏蛋白,大豆球蛋白(Glycinin)是其中之一,它已被确定为主要的大豆变应原[2].大豆球蛋白是由酸性(A1a、A1b、A2、A3、A4、A5)和碱性(B1a、B1b、B2、B3、B4)多肽链通过二硫键连接组成,其中每条酸性链和碱性链的分子质量分别为34~44 ku和20 ku[3],它为11S 的主要成分,占总大豆蛋白的19.5%~23.1%,分子质量为300~380 ku[4].据报道,大豆球蛋白过敏反应会产生腹泻、肠道损害、免疫功能紊乱等现象[5],而免疫反应的严重程度取决于大豆球蛋白的剂量.
过敏原在食物制品中的检测是非常困难的,因为变应原通常是很微量的,且可以由食物基质屏蔽[1].大豆球蛋白的定量测定可以通过高效液相色谱法进行[4],但该方法耗时,且需要昂贵的设备.免疫分析方法因其操作简单、廉价、处理样品量大等优点已经被广泛应用.其中,酶免疫法(ELISA)现已应用于牛乳蛋白、大豆蛋白的快速检测分析中[6].布冠好等[7]已建立了测定牛乳球蛋白的间接竞争ELISA 方法.Liu 等[8]建立了竞争ELISA 方法来检测大豆中β-伴大豆球蛋白的α 亚基,得到的方法灵敏度较高.Cucu 等[9]基于竞争ELISA 法来测定食物中大豆过敏原蛋白.本研究意在建立一种间接竞争ELISA 法用于检测大豆中主要过敏原大豆球蛋白,为低敏性大豆制品的开发提供检测方法.
1 材料与方法
1.1 试验材料
大豆球蛋白(Glycinin,G3171),β-conglycinin(C5868),酶标二抗(HRP 标记的羊抗兔IgG,A6154),弗氏完全佐剂和弗式不完全佐剂:Sigma公司;新西兰大白兔:郑州大学实验动物中心提供;兔抗Glycinin 血清(自制);牛血清蛋白(BSA),TMB 单组份显色液:北京索莱宝科技有限公司;其他试剂均为分析纯.
1.2 仪器与设备
96 孔酶标板:Corning Costar 公司;FC 型酶标仪:赛默飞世尔仪器有限公司;LRH-150F 型恒温生化培养箱:上海一恒科技有限公司.
1.3 试验方法
1.3.1 兔抗大豆球蛋白多克隆抗体的制备[10]
选取2 只成年健康雄性新西兰大白兔,平均体质量2.5 kg,随机编号,饲养于郑州大学实验动物中心.喂养3 d 后,观察无异样,即进行免疫处理.将免疫抗原大豆球蛋白(Glycinin)分别用无菌去离子水稀释至浓度为1 mg/mL,分装,-20 ℃保存;第1 次免疫前耳缘静脉采血,收集阴性对照血清;免疫时每次取合适剂量的抗原用无菌去离子水稀释至600 μL,再与等体积的弗氏完全或不完全佐剂充分乳化后,颈背部皮下多点注射成年雄性家兔,免疫6 次.第1 次取抗原300 μL 与等量弗氏完全佐剂充分乳化后,颈背部皮下多点注射;第2~5 次,每隔10 d 进行一次免疫,每次取200 μL 抗原与等量弗氏不完全佐剂充分乳化后,颈背部皮下多点注射;最后一次不含佐剂加倍的抗原耳缘静脉注射,3 d 后心脏采血,收集血清、分装后-20 ℃保存.5 免后第7 天耳缘静脉采血,分离血清,由间接ELISA 方法检测多抗血清效价.然后第6 次免疫,3 d 后大量采血,先于37 ℃放置1 h,然后于4 ℃放置过夜,使血清充分析出,以3 000 r/min 离心10 min,分离血清,用小管分装后于-20℃保存.
1.3.2 间接竞争ELISA 方法的建立
1.3.2.1 间接ELISA程序[7]
包被抗原:以一定质量浓度的抗原包被96 孔酶标板,每孔100 μL,4 ℃过夜.次日倾去孔内液体,PBST(pH 7.4,0.01 mol/L 磷酸盐缓冲液,0.05%Tween-20)洗涤4 次,每孔250 μL,每次3 min,然后用吸水纸拍干,用封闭液(pH 7.4,0.01 mol/L 磷酸盐缓冲液,1% BSA,0.1% Tween-20)进行封闭,每孔100 μL,37 ℃孵育1 h;之后,PBST 洗涤4次,拍干.抗原抗体反应:加入系列稀释的被测抗原和一定稀释度的抗血清1∶1 进行预混合,每孔100 μL,37 ℃孵育1 h,PBST 洗涤4 次,拍干;加入一定稀释度的酶标二抗,37 ℃孵育1 h,PBST 洗涤4 次,拍干;加入TMB 单组分显色液,每孔100 μL,37 ℃显色10 min 后,每孔加入50 μL 2 mol/L H2SO4终止反应.利用酶标仪双波长测定各孔的OD 值,实际OD 值=OD450-OD620.
1.3.2.2 抗血清工作浓度和抗原最佳包被浓度的确定
利用方阵滴定法,将抗原Glycinin 用包被液(pH 9.6,50 mmol/L 碳酸盐缓冲液)稀释为0.1、0.05、0.025、0.012 5 μg/mL,每行一个稀释度加入到酶标板中,4 ℃过夜.抗血清用封闭液稀释成1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600、1∶51 200,每列一个稀释度加入到酶标板中,37 ℃孵育1 h.然后按照1.3.2.1 的步骤进行OD 值的测定,选择OD 值在1.0 左右的抗原和抗血清浓度为最佳工作浓度.
1.3.2.3 酶标二抗稀释度的选择
在优化出的最佳抗原包被浓度和最佳抗血清稀释度下,将酶标二抗用封闭液稀释为1∶5 000、1∶10 000、1∶20 000、1∶40 000,每行一个稀释度,每孔100 μL,分别加入到酶标孔中.然后按照1.3.2.1 的步骤进行OD 值的测定,选择OD 值在
1.0 左右的酶标二抗浓度为最佳工作浓度.
1.3.2.4 抗原最佳包被时间的确定
以最佳的抗原包被浓度包被酶标板,分别在4℃过夜,37 ℃孵育2 h 后4 ℃过夜,37 ℃孵育2 h,37 ℃孵育4 h 条件下放置,抗血清和酶标二抗浓度均为最佳工作浓度,然后按照1.3.2.1 的步骤进行OD 值的测定,确定最佳的抗原包被时间.
1.3.2.5 抗原抗体最佳反应条件的选择
用最佳抗原浓度和最适包被条件来包被酶标板,并选择最佳的抗血清和酶标二抗稀释度加入,抗原抗体分别在37 ℃和25 ℃下反应0.5、1、2 h,测定OD 值来确定最佳的抗原抗体反应条件.
1.3.2.6 底物最佳反应条件的确定
在其他条件为最佳条件的情况下,底物显色反应分别在37 ℃温育5、10、20 min 及25 ℃温育5、10、20 min 进行,然后按照1.3.2.1 步骤,测定各组OD 值以确定最佳底物反应条件.
1.3.2.7 标准曲线的建立
将Glycinin 用包被液分别稀释成0.001~0.1 μg/mL 的浓度系列,在上述步骤得到的最佳条件下,进行间接竞争ELISA 测定.最后将Glycinin 各浓度对应的OD 值转换成(B/B0)%值为纵坐标,并以对应的Glycinin 浓度的常用对数值为横坐标,制作标准曲线.其中,B 为Glycinin 竞争时各对应浓度的OD 测量值,B0为无抑制时的OD 值.
选择标准曲线上呈明显相关区段的(B/B0)%和lg[Glycinin],根据公式Logit((B/B0)%)=ln(B/(B0-B)),计算各标准点的Logit((B/B0)%),最后做对应于lg[Glycinin]的Logit((B/B0)%)的回归分析,得出线性回归方程及相关系数.
1.3.2.8 方法的精密度
对建立ELISA 检测方法进行精密度测试,分别以板内变异系数和板间变异系数表示.板内误差:每一个样品浓度做4 次重复,计算标准差,以板内变异系数(CV)表示板内误差.板间误差:在不同的酶标板上分别做3 次重复,测定OD 值,计算出各浓度的标准差及变异系数,以板间变异系数表示板间误差.
1.3.2.9 抗体特异性鉴定[11]
将兔抗Glycinin 抗体与大豆蛋白中的伴大豆球蛋白(β-conglycinin)进行免疫交叉试验.
2 结果与讨论
2.1 抗血清效价的测定
在免疫过程中对兔子进行定期采血,对抗血清的效价进行检测,并对抗体特异性进行考察,以此为依据选择较好的抗体进行下一步的试验.由ELISA 方法测定兔抗Glycinin 血清的最高效价均达到了1∶10 000,所制备的抗血清效价较高[12],可用于下一步的酶联免疫试验.
2.2 间接竞争ELISA 最佳条件的确定
2.2.1 抗血清最佳稀释度和抗原最佳包被浓度
建立ELISA 方法时,应对包被抗原及抗体的浓度进行优化,以达到最适合的测定条件,并且节省测定的费用.采用方阵滴定法来确定抗原最适包被浓度和抗血清最佳稀释度,结果如表1 所示.
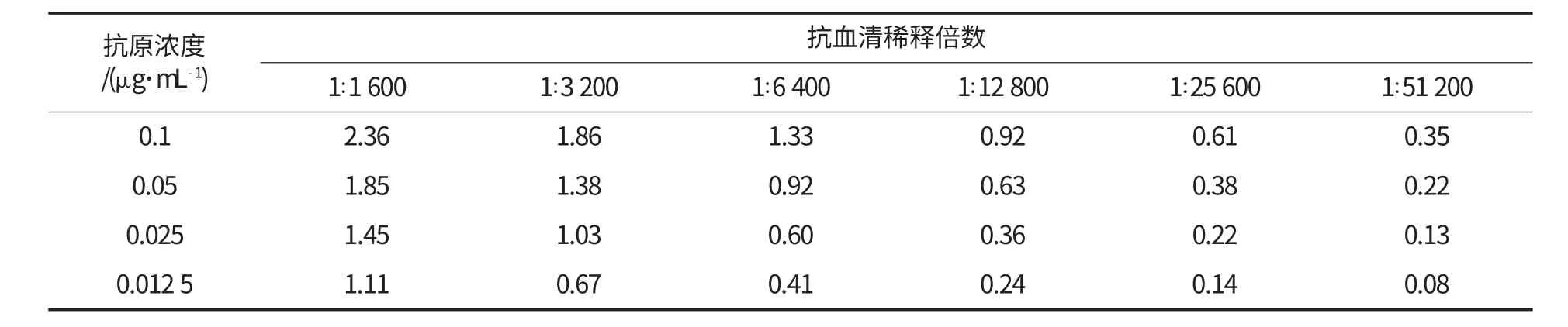
表1 Glycinin 包被抗原和抗血清工作浓度的确定
当包被抗原Glycinin 的最佳包被浓度为0.025 μg/mL、对应的抗血清最适稀释倍数为1∶3 200 时,测定的OD 值在1.0 左右,说明Glycinin 抗原、抗体最佳工作条件分别为0.025 μg/mL 和1∶3 200.
2.2.2 酶标二抗最适工作浓度
在ELISA 方法中,酶标记物浓度的变化会对试验结果产生很大的影响.浓度过高,可使非特异性反应增加,浓度过低又影响测定结果的敏感性[12].试验中将HRP-羊抗兔IgG 做不同的稀释度,结果如表2 所示.
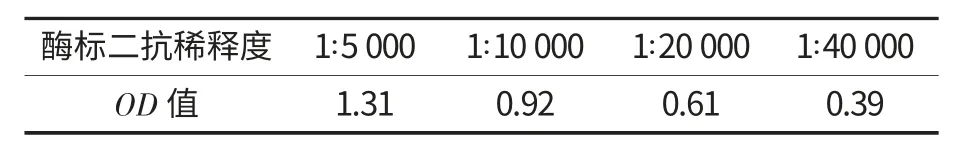
表2 HRP-羊抗兔IgG 最适工作浓度的确定
从表2 可以看出,随着稀释度的增大,OD 值逐渐减小;当酶标二抗以1:10 000 稀释时,测定的OD 值接近1.0,为酶标二抗的最佳工作稀释度.
2.2.3 抗原最适包被条件
将抗原固相化的过程称为包被.试验中,在不同条件下包被抗原结果如表3 所示.
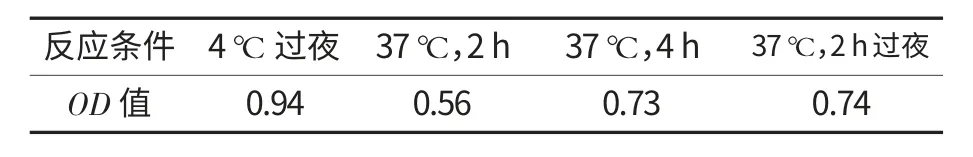
表3 抗原包被条件的确定
由表3 可知,37 ℃包被2 h、4 h 及37 ℃温育2 h 过夜所测得的OD 值结果偏小,且所需时间较长;而4 ℃过夜包被抗原条件下所测得的OD 值在1.0 左右,为本试验得到的抗原包被的最佳条件.
2.2.4 抗原抗体最佳竞争反应条件
抗原抗体进行结合需要一定的时间和温度,此时反应的时间应严格控制.保温容器最好可使温度迅速平衡[13].本试验采用恒温箱,将酶标板置于底部垫有纱布的带盖金属湿盒中,放于恒温箱中进行反应.不同温度不同时间下抗原抗体反应测定结果见表4.

表4 抗原抗体反应温度和时间确定
从表4 可以看出,抗原抗体反应的最佳条件为37 ℃、1 h,此时,测定的OD 值接近1.0.
2.2.5 底物最佳反应条件
在ELISA 方法中,辣根过氧化物(HRP)为最常用的酶,它具有价格低廉和性质比较稳定的特点.本试验采用TMB 作为HRP 的底物,TMB 经HRP 作用后产物显蓝色,从而探究底物反应条件对显色反应的影响,结果见表5.

表5 底物反应温度和时间的确定
由表5 可知,在一定的温度下随着反应时间的增加,OD 值逐渐增大,在37 ℃温育10 min 时OD 值在1.0 左右,37 ℃反应10 min 之前,OD 值偏小,说明显色不完全.25 ℃下反应测得的OD 值均偏小.综合考虑选择37 ℃反应10 min 作为底物的最佳反应条件.
2.2.6 标准曲线的制作
将Glycinin 标 准 品 按0.001、0.01、0.012 5、0.015、0.02、0.025、0.03、0.04、0.05、0.1 μg/mL 稀释,在确定的大豆蛋白Glycinin 间接竞争ELISA 最佳试验条件下进行测定,以Glycinin 浓度的常用对数为横坐标,以抑制率(B/B0)%为纵坐标绘制得到标准曲线如图1 所示.
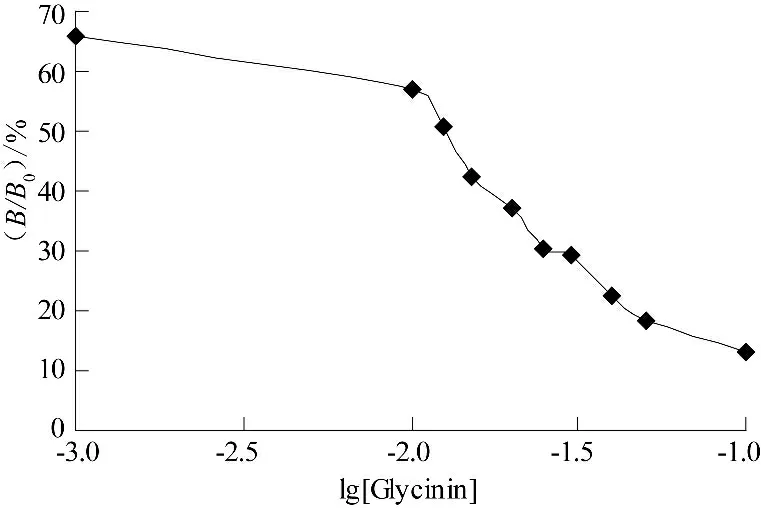
图1 Glycinin 间接竞争ELISA 法的标准曲线
由图1 可以得出,在0.01~0.05 μg/mL 范围内,标准曲线线性关系良好且曲线斜率也较大,故选取该区域进行回归直线方程拟合.线性回归转换后的回归分析结果见图2.
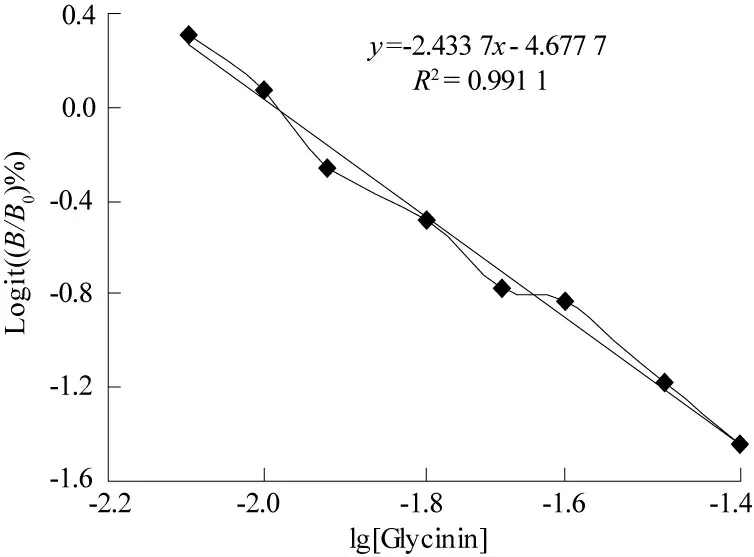
图2 Logit 回归的线性拟合曲线
在图2 中,回归方程中y 为Logit((B/B0)%),x 为lg[Glycinin],拟合的线性回归直线方程为y=-2.433 7x-4.677 7,相关系数R2=0.991 1,符合线性关系的判定标准.故最佳检测范围为0.01~0.05 μg/mL.
2.2.7 方法的精密度
Glycinin 间接竞争ELISA 精密度的测定结果如表6 所示.
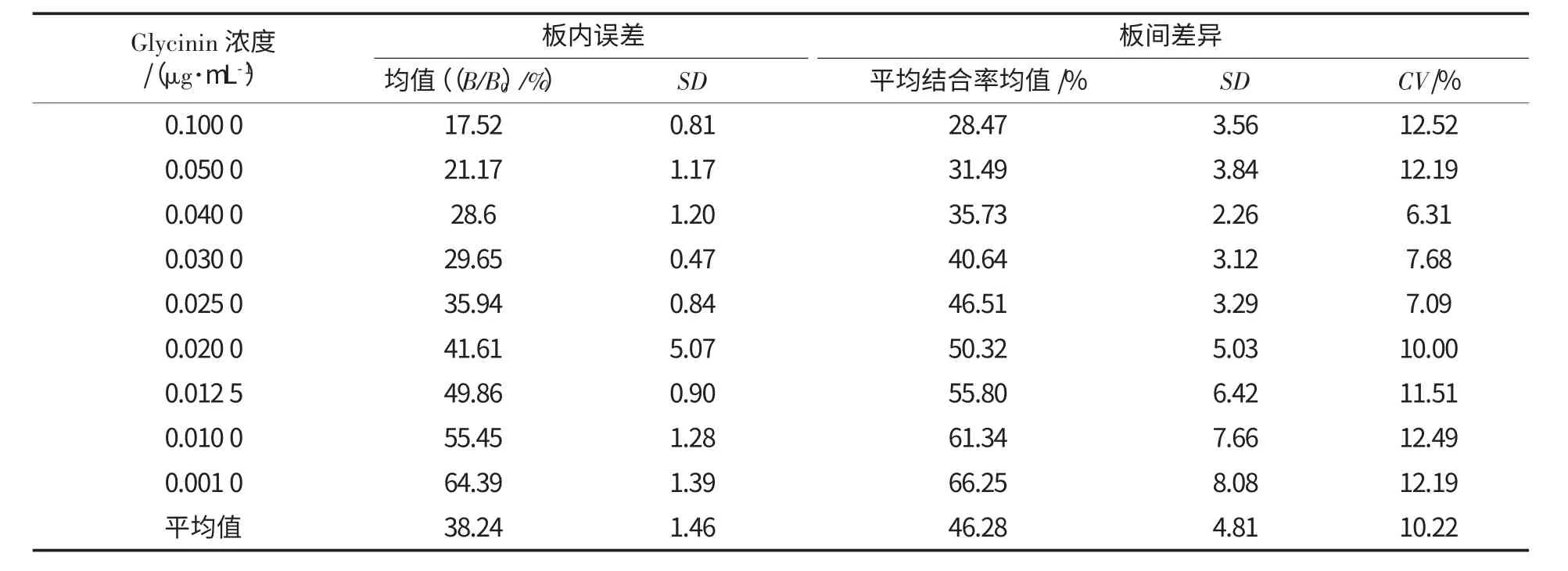
表6 间接竞争ELISA 标准曲线的板内误差和板间误差
板内误差以标准曲线的板内平均变异系数(CV)来表示,其中,CV=SD 均值/平均孔间结合率×100%=1.46/38.24×100%=3.82%.
板间误差以3 次测定平均的板间变异系数(CV)表示,由表6 可得,各浓度的板间变异系数在6.31%~12.52%,平均为10.22%.ELISA 方法板内变异系数一般要求要低于10%,板间变异系数的允许值一般要求低于15%[12],故由板内误差和板间误差可知,本试验方法重复性较好.
2.2.8 交叉反应
兔抗Glycinin 抗体的特异性检测结果如图3所示.

图3 兔抗Glycinin 抗体和β-conglycinin 的免疫交叉曲线
从图3 可以看出,Glycinin 在某一区域出现下降趋势,而β-conglycinin 的(B/B0)%值基本不受浓度的影响,曲线趋势始终保持平稳.这说明βconglycinin 与所制备的Glycinin 抗体之间不存在免疫交叉现象,Glycinin抗体特异性良好.
3 结论
本研究首先成功制备了兔抗Glycinin的多克隆抗体,并在此基础上对间接竞争ELISA 法的条件进行摸索,确定了最佳的反应条件为:抗原Glycinin 最佳包被浓度为0.025 μg/mL,包被4 ℃过夜,抗血清的最适稀释度为1∶3 200,抗原抗体最佳反应条件37 ℃孵育1 h,酶标二抗的最佳稀释度为1 ∶10 000.拟合线性回归直线方程为y=-2.433 7x-4.677 7,相关系数R2=0.991 1,其检测的线性范围为0.01~0.05 μg/mL,检测的板内误差3.82%,板间误差10.22%.结果表明该方法具有一定的重复性和灵敏度,并且操作较为简单.大豆蛋白中Glycinin 抗原的间接ELISA 检测方法的建立,为大豆过敏原及低敏性大豆蛋白产品的开发提供了有效的检测手段.
[1]Ma X,Sun P,Han P F,et al.Development of monoclonal antibodies and a competitive ELISA detection method for glycinin,an allergen in soybean[J].Food Chemistry,2010,121(2):546-551.
[2]Wilson S,Blaschek K,Mejia E G.Allergenic proteins in soybean:processing and reduction of P34 allergenicity[J].Nutrition Reviews,2005,63(2):47-48.
[3]Maruyama N,Krisna P,Motoyama S,et al.Structure -physicochemical function relationships of soybean Glycinin at subunit levels assessed by using mutant lines[J].Journal of Agricultur e and Food Chemistry,2004,52(26):8197-8201.
[4]Mujoo R,Trinh D T,Ng Perry K W.Characterization of storage proteins in different soybean varieties and their relationship to tofu yield and texture[J].Food Chemistry,2003,82(2):265-273.
[5]Liu X,Feng J,Xu Z R,et al.Oral allergy syndrome and anaphylactic reactions in BALB/c mice caused by soybean glycinin and β-conglycinin[J].Clinical and Experimental Allergy,2008,38(2):350-356.
[6]肖海龙,赵凯,林赛君,等.牛奶β-酪蛋白和大豆β-伴球蛋白双抗制备及夹心ELISA 快速定性检测技术的建立[J].浙江大学学报:农业与生命科学版,2012,39(2):222-226.
[7]布冠好,郑喆,郑海,等.牛乳过敏原β-乳球蛋白间接竞争ELISA 检测方法的建立[J].中国农业大学学报,2008,13(6):71-76.
[8]Liu B,Teng D,Yang Y L,et al.Development of a competitive ELISA for the detection of soybean α subunit of β-conglycinin[J].Process Biochemistry,2012,47:280-287.
[9]Cucu T,Devreese B,Kerkaert B,et al.ELISABased detection of soybean proteins:a comparative study using antibodies against modified and native proteins[J].Food Analytical Methods,2012,5:1121-1130.
[10]郭鑫.动物免疫学实验教程[M].北京:中国农业大学出版社,2007:12-16.
[11]林成招,张彦明,邹思湘,等.牛乳铁蛋白的酶联免疫吸附分析(ELISA)方法的建立[J].中国乳品工业,2003,31(4):44-46.
[12]王硕,张鸿雁,王俊平.酶联免疫吸附分析方法:基本原理及其在食品化学污染物检测中的应用[M].北京:科学出版社,2011:25-41.
[13]李志勇.食品安全ELISA 快速检测技术[M].北京:中国标准出版社,2009:10-17.
