苯酚降解菌的分离及其降解特性研究
2014-03-26颜家保余永登
颜家保,余永登
(武汉科技大学化学工程与技术学院,湖北 武汉,430081)
苯酚及其衍生物是一种常见的有毒有机污染物,且具有致癌性。含苯酚的工业废水在直接排放到水体前必须经过适当处理,否则会对生态系统造成不可估量的破坏[1-2]。微生物降解方法在苯酚污染治理中起着重要作用,为了强化生物处理效果,可以向生化反应池中投加人工筛选出的高效菌,提高目标污染物的去除率[3]。目前,运用生物降解法降解苯酚的研究文献较多,研究人员从污染土壤、污水等环境中分离得到各种各样的苯酚降解菌[4-9]。笔者从某焦化厂活性污泥中驯化分离得到一株苯酚降解菌,通过革兰氏染色和一系列生理生化特征实验对该菌株进行初步鉴定,考察多项生长降解条件对其苯酚降解特性的影响,并研究该菌株的苯酚降解动力学方程,以期为工业化处理酚类废水提供参考。
1 实验
1.1 实验材料
1.1.1 菌种
菌种取自武汉钢铁集团公司某焦化厂曝气池活性污泥。
1.1.2 培养基
(1)液体LB培养基:10 g蛋白胨,5 g酵母浸粉,10 g NaCl,加蒸馏水定容至1000 mL。
(2)微量元素溶液:0.1 g FeSO4,0.1 g ZnSO4,0.01 g KAl(SO4)2,0.01 g NaMo2O4, 0.1 g CoCl2,0.01 g CuSO4,0.01 g H3BO3,加蒸馏水定容至1000 mL。
(3)苯酚无机盐培养基:1.0 g NaCl,0.1 gCaCl2, 0.5gKH2PO4,0.5gMgSO4·7H2O,0.5 g K2HPO4,1.0 g NH4NO3,2 mL微量元素溶液,加蒸馏水定容至1000 mL,pH值为7.0~7.2。
(4)选择性固体培养基:在苯酚无机盐培养基中按20 g/L加入琼脂,再分别加入一定浓度的苯酚。
1.2 实验方法
1.2.1 苯酚降解菌的富集、分离和纯化
在盛有100 mL LB培养基的锥形瓶中接种污泥样本,将培养基在150 r/min、30 ℃的恒温摇床上培养24 h,取3 mL培养液转接到100 mL苯酚无机盐培养基中,向其中加入浓度为500 mg/L的苯酚,在相同条件下培养1~2 d,再从中取3 mL培养液接至新鲜苯酚无机盐液体培养基中,使苯酚浓度为600 mg/L,在相同条件下培养2~3 d,以梯度浓度方式驯化筛选菌株(苯酚浓度逐步由500 mg/L上升至1200 mg/L)。最后将苯酚浓度为1200 mg/L的培养液稀释,按照涂布平板法在苯酚无机盐平板上涂布,并在30 ℃恒温箱中培养1~2 d,挑选清晰的菌落,经2~3次平板划线直至获得单一菌落,分别考察苯酚在各单一菌落下的降解率,选取其中一株效果最优的菌株于4 ℃保存备用。
1.2.2 菌株鉴定
通过光学显微镜观察菌体形态,并通过革兰氏染色和一系列生理生化特征实验对经分离纯化得到的菌株进行初步鉴定。
1.2.3 苯酚降解实验
将菌株加入盛有100 mL无机盐培养基的锥形瓶中,在恒温摇床中进行苯酚降解实验。改变菌株接种量、培养基初始pH值、培养温度、摇床转速、金属离子种类等降解条件,考察苯酚降解效果。
1.2.4 苯酚浓度的测定和菌株生长曲线的绘制
按照《水质 挥发酚的测定 4-氨基安替比林分光光度法》(HJ503—2009)测定苯酚浓度。以不加菌种的培养基做空白对照。
将4 ℃保存的菌株加到含苯酚的无机盐培养基中,在一定条件下培养,每隔2 h采用UV-2000型紫外可见分光光度计测定培养液在600 nm处吸光度值OD600,以评价细菌的生长情况。
2 结果与讨论
2.1 菌株的分离与初步鉴定结果
经过驯化筛选等系列实验挑选出9株单菌,分别将其接种到含苯酚的无机盐培养基中,测定苯酚浓度,其中有1株单菌的生长情况明显优于其他菌株,命名为P1。
菌株P1在苯酚无机盐平板上置于30 ℃恒温培养箱培养24 h后,长出的菌落外形呈圆形,不透明,为乳白色,表面湿润黏稠。对P1进行革兰氏染色,呈阳性,通过细菌鉴定手册[10]及生理生化特征实验初步鉴定为微球菌属(Micrococcussp.),其部分生理生化特征见表1。
表1菌株P1的生理生化特征
Table1PhysiologicalandbiochemicalcharacteristicsofStrainP1
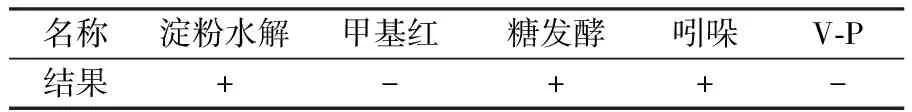
名称淀粉水解甲基红糖发酵吲哚V-P结果+-++-
注:“+”为阳性,“-”为阴性。
2.2 菌株P1苯酚降解特性的影响因素分析
2.2.1 培养基初始pH值
在37 ℃、170 r/min、接种量为3%、苯酚浓度为500 mg/L的条件下,考察培养基初始pH值不同时菌株P1对苯酚的降解效果,如图1所示,其中空白组pH值约为7.0。由图1可见,最适合菌株降解苯酚的培养基初始pH值为7.0,此条件下经过24 h,苯酚降解率基本可达100%。当培养基初始pH值为7.0~9.0时,溶液呈中性或弱碱性,这时菌株P1对苯酚的降解效果明显优于pH值为5.0时的降解效果,表明菌株P1对苯酚的降解更适合在中性或弱碱性环境下进行。这是由于在苯酚的降解过程中产生了偏酸性的中间代谢产物邻苯二酚[11],使弱酸性培养基进一步酸化,抑制了菌株的代谢,而在偏碱性的培养基中,苯酚代谢产生的偏酸性邻苯二酚恰好使培养基得到了中和。
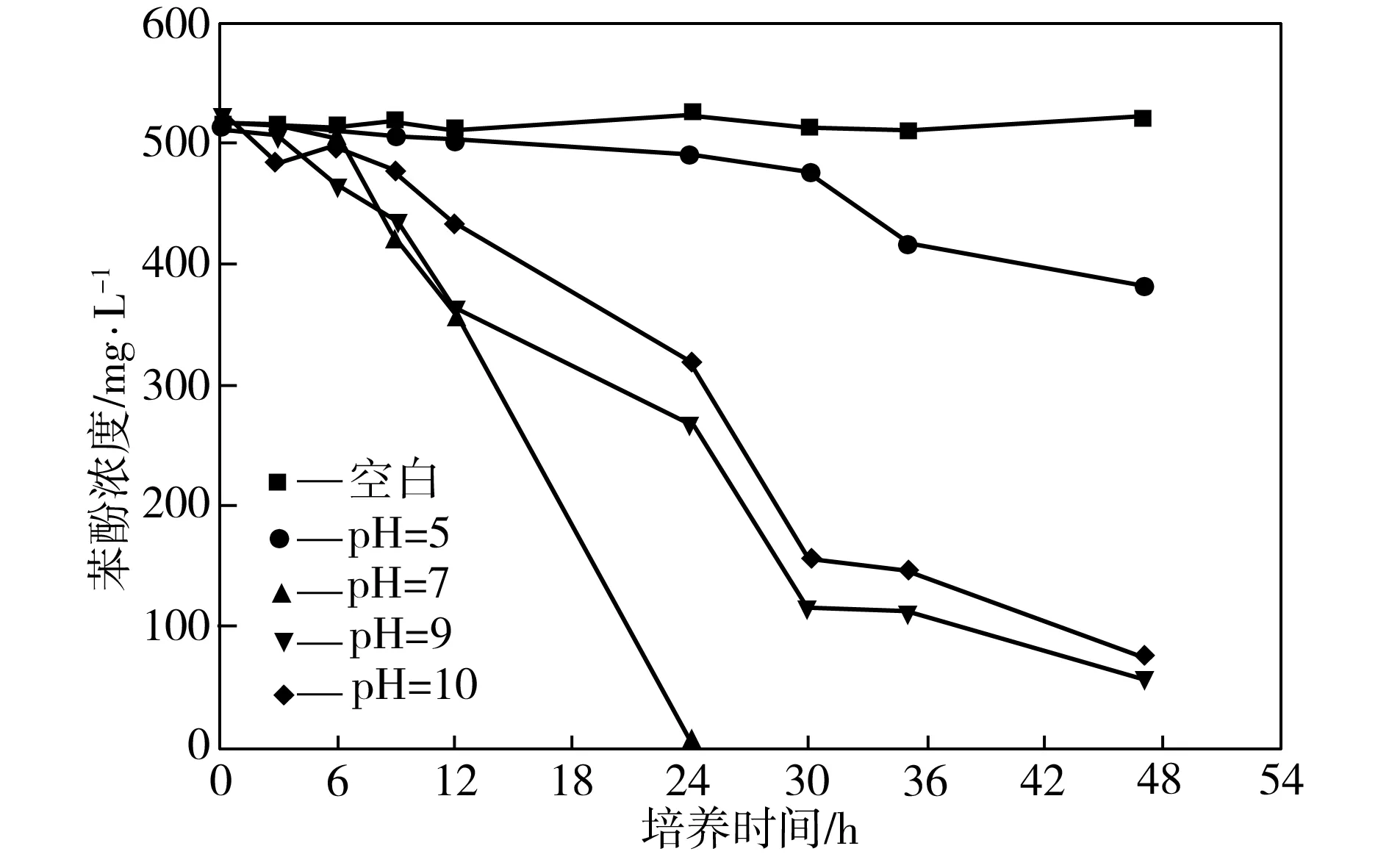
图1 不同初始pH值下菌株P1对苯酚的降解效果
Fig.1Phenol-degradingeffectofStrainP1atdifferentpHvalues
2.2.2 培养温度
在初始pH值为7.0、170 r/min、接种量为3%、苯酚浓度为500 mg/L的条件下,考察培养温度不同时菌株P1对苯酚的降解效果,如图2所示,其中空白组培养温度为30 ℃。由图2可见,在0~5 h内,温度对P1的降解能力影响不大,但随着培养时间的延长,不同温度下P1的降酚能力就有了明显区别,且35 ℃时P1对苯酚的降解效果最好。
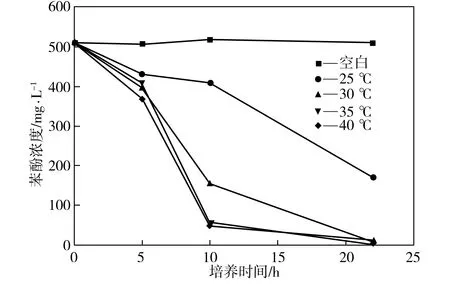
图2 不同培养温度下菌株P1对苯酚的降解效果
Fig.2Phenol-degradingeffectofStrainP1atdifferenttemperatures
2.2.3 摇床转速
在35 ℃、初始pH值为7.0、接种量为3%、苯酚浓度为500 mg/L的条件下,考察摇床转速不同时菌株P1对苯酚的降解效果,如图3所示,其中空白组摇床转速为100 r/min。由图3可见,0~8 h内,摇床转速对菌株的降解效果没有明显影响,但随着时间的延长,可以观察到150~200 r/min为P1降解苯酚的最佳摇床转速区间。
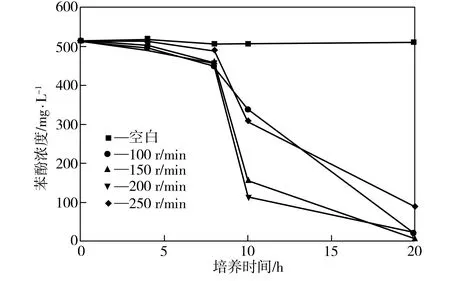
图3 不同摇床转速下菌株P1对苯酚的降解效果
Fig.3Phenol-degradingeffectofStrainP1atdifferentrotationspeeds
2.2.4 接种量
在35 ℃、150 r/min、初始pH值为7.0、苯酚浓度约为500 mg/L的条件下,考察接种量不同时菌株P1对苯酚的降解效果,如图4所示。由图4可见,培养初期,随着接种量的增加,营养物质的消耗率增大,苯酚降解率也随之增大。但过高的接种量会使微生物所分配到的营养物质减少,菌株生长代谢活动反而受到抑制。而接种量为1%~5%时,由于菌量较少,菌株平均分配到的营养物质较多,因此菌株繁殖速度较快,随着培养时间的延长,其苯酚降解效果也越来越好,且接种量为3%时的苯酚降解效率又明显比接种量为1%和5%时要高。综合考虑,确定最优接种量为3%。
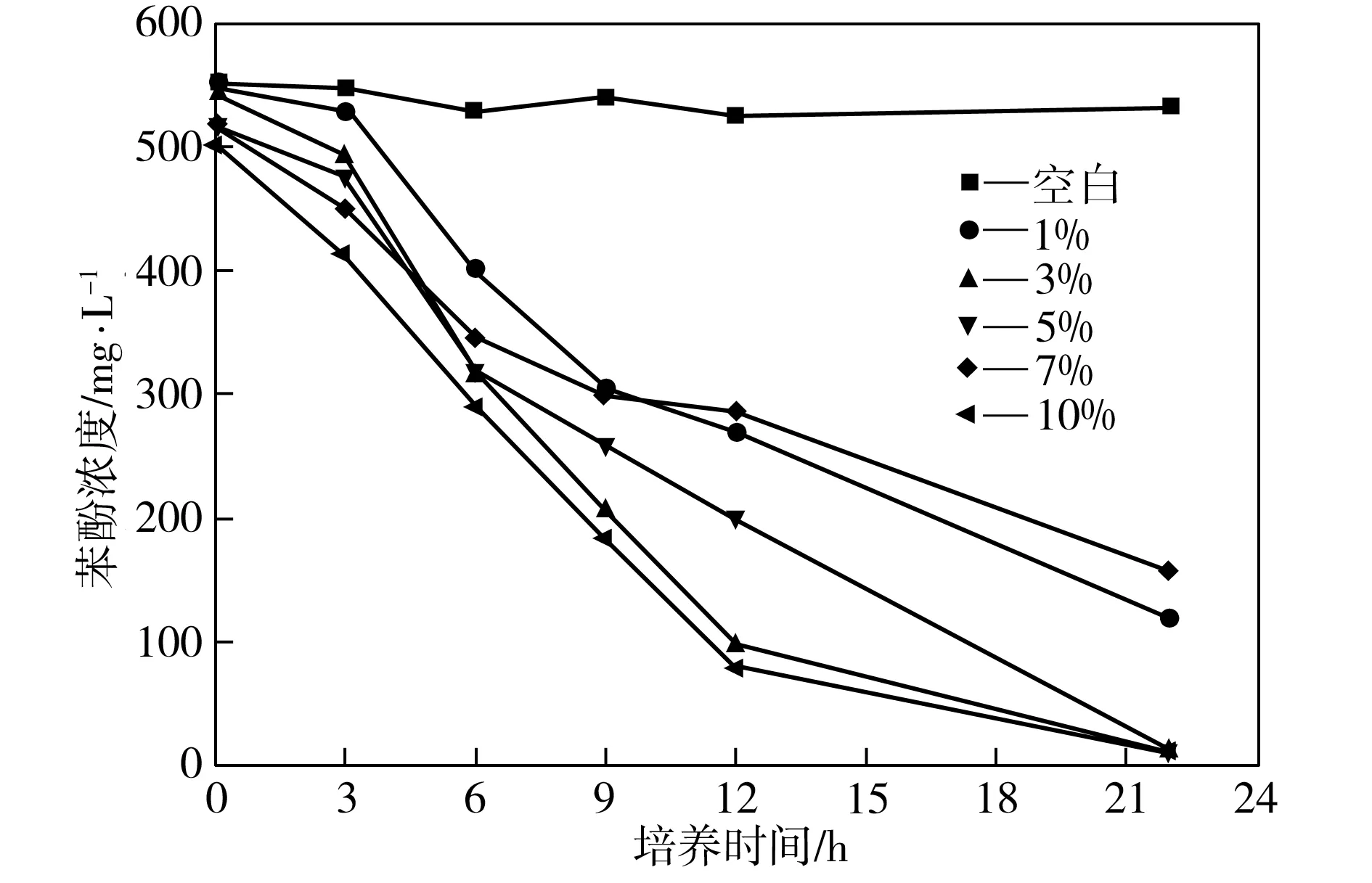
图4 不同接种量下菌株P1对苯酚的降解效果
Fig.4Phenol-degradingeffectofStrainP1atdifferentinoculumsizes
2.2.5 金属离子
在35 ℃、150 r/min、初始pH值为7.0、接种量为3%、苯酚浓度约为500 mg/L的条件下,考察培养基中加入不同金属离子时菌株P1对苯酚的降解效果,结果如图5所示,其中每种金属离子的质量分数均为0.001%,空白组不加金属离子。由图5可见,菌株的生长受到金属离子的明显抑制,其中重金属离子Hg2+对菌株的抑制尤为严重。另外,加入Hg2+的培养液中苯酚浓度出现略微升高,这可能是降解过程中生成了某种中间产物,它对指定波长的光也有吸收,而且比苯酚的摩尔吸光系数更大。
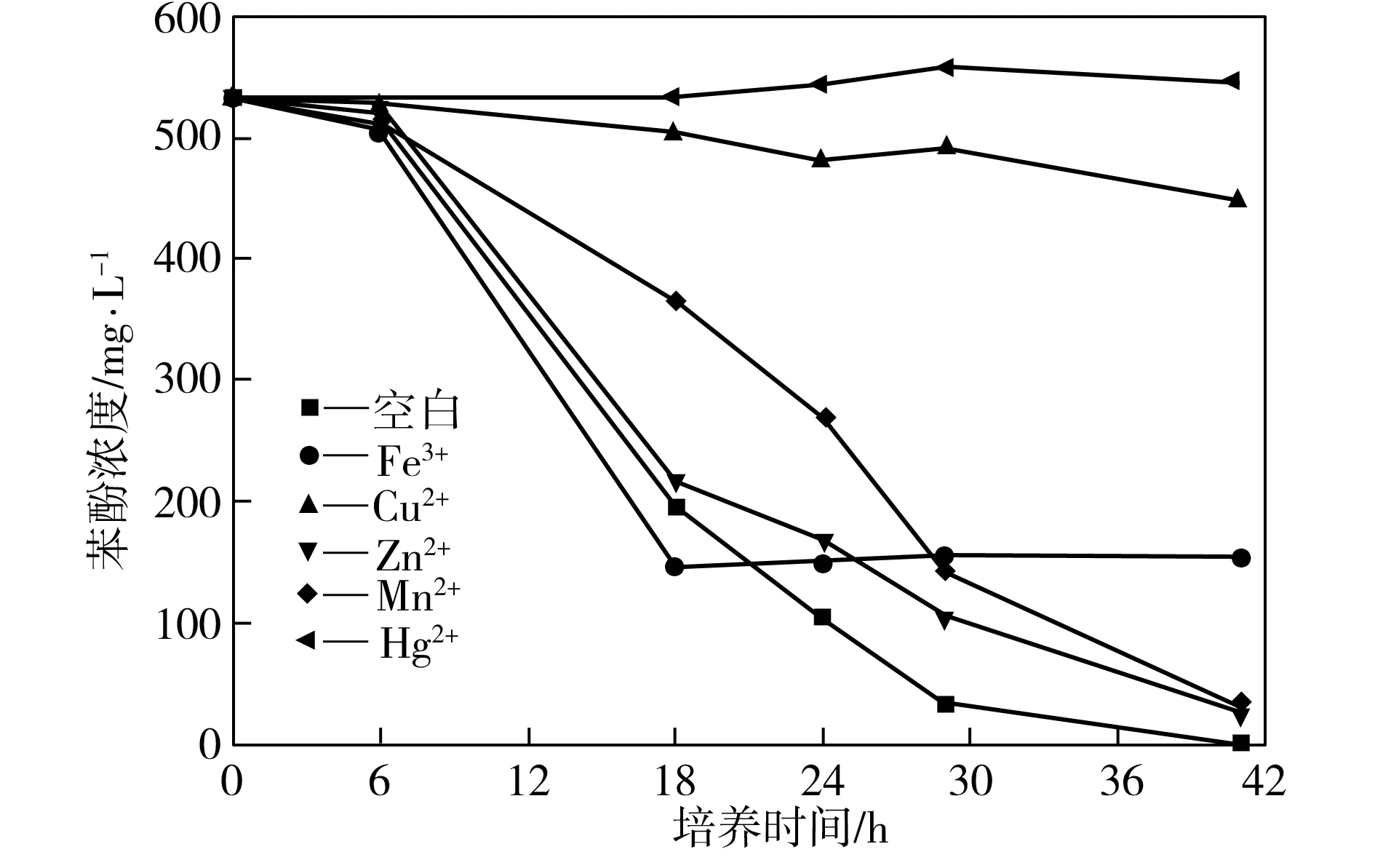
图5 加入不同金属离子时菌株P1对苯酚的降解效果
Fig.5Phenol-degradingeffectofStrainP1withdifferentmetalions
2.3 菌株P1的生长特性
在35 ℃、150 r/min、初始pH值为7.0、接种量为3%、苯酚浓度约为500 mg/L的培养条件下,菌株P1的生长曲线如图6所示。由图6可以看出,菌株P1在培养4 h后开始进入生长对数期,到约10 h后进入生长稳定期。因此10 h是菌株P1的生长对数期顶峰,也是降解苯酚的最佳时间。

图6 菌株P1的生长曲线及苯酚降解曲线
Fig.6Growthcurveandphenol-degradingcurveofStrainP1
2.4 菌株P1对苯酚的降解动力学分析
为了深入探究菌株P1对苯酚的降解规律,在不同底物浓度下进行P1的苯酚降解动力学分析,如图7所示。从图7可以看出,苯酚初始浓度越低,降解所需时间越短;苯酚初始浓度为500 mg/L时,苯酚完全降解耗费的时间为12 h;苯酚初始浓度超过1000 mg/L时,菌体的生长速度以及苯酚的降解速度均非常缓慢。
菌株P1在12 h内可将浓度为500 mg/L的苯酚完全降解,其代谢速率约为43.05 mg/(L·h),明显优于马海娟等[12]筛选得到的Nocardiasp.,该菌完全降解600 mg/L的苯酚需要20 h,也优于钱奕忠等[13]筛选出的菌种,该菌完全降解470 mg/L的苯酚需要耗费78 h。菌株P1的苯酚耐受浓度可达1200 mg/L。

图7 菌株P1的苯酚降解动力学曲线Fig.7 Phenol-degrading kinetic curves of Strain P1
Monod方程作为描述单一基质限制生长的动力学方程,其零级、一级反应动力学方程常被用于代谢动力学表征。将图7中的曲线用动力学方程表示,结果见表2。由表2可见,当苯酚浓度为100~500 mg/L时,苯酚的降解过程符合零级反应动力学方程,即dC/dt=-k;当苯酚浓度大于500 mg/L时,苯酚的降解过程符合一级反应动力学方程,即dlnC/dt=-k。

表2 菌株P1的苯酚降解动力学方程Table 2 Phenol-degrading kinetic equations of Strain P1
3 结论
(1)由某焦化厂活性污泥中驯化得到一株能以苯酚为唯一碳源生长的菌株P1,该菌株好氧,革兰氏染色呈阳性,初步鉴定为微球菌属(Micrococcussp.)。
(2)菌株P1对苯酚生物降解的较优条件为:初始pH值7.0,培养温度35 ℃,摇床转速150 r/min,接种量3%。菌株P1的生长受到一些金属离子的显著抑制,因此在用其处理含苯酚废水时,必须考虑到废水中的金属离子对微生物的影响。
(3)当苯酚浓度为100~500 mg/L时,P1对苯酚的降解过程符合Monod零级反应动力学模型。
[1] Muftah H El-Naas,Sulaiman Al-Zuhair,Souzan Makhlouf.Batch degradation of phenol in a spouted bed bioreactor system[J].Journal of Industrial and Engineering Chemistry,2010,16(2):267-272.
[2] Busca G,Berardinelli S,Resini C,et al.Technologies for the removal of phenol from fluid streams:a short review of recent developments[J].Journal of Hazardous Materials,2008,160(2/3): 265-288.
[3] 靳茂霞,刘桂林.提高焦化废水生化处理效果途径[J].上海环境科学,1997,16(2):13-14.
[4] Koutny M, Ruzicka J, Chlachula J. Screening for phenol-degrading bacteria in the pristine soils of south Siberia[J]. Applied Soil Ecology, 2003, 23(1): 79-83.
[5] Rehfuss M, Urban J.Alcaligenesfaecalissubsp.phenolicussubsp. nov. a phenol-degrading, denitrifying bacterium isolated from a graywater bioprocessor[J].Systematic and Applied Microbiology, 2005, 28(5): 421-429.
[6] Geng A, Lim C J. Proteome analysis of the adaptation of a phenol-degrading bacteriumAcinetobactersp. EDP3 to the variation of phenol loadings[J].Chinese Journal of Chemical Engineering, 2007, 15(6): 781-787.
[7] Vera Lúcia dos Santosa, Andrea de Souza Monteiroa, Danúbia Telles Braga,et al. Phenol degradation byAureobasidiumpullulansFE13 isolated from industrial effluents[J].Journal of Hazardous Materials, 2009,161(2/3): 1413-1420.
[8] Pradhan N, Ingle A O. Mineralization of phenol by aSerratiaplymuthicastrain GC isolated from sludge sample[J].International Biodeterioration and Biodegradation, 2007,60(2):103-108.
[9] Annadurai G, Ling L Y, Lee J F. Statistical optimization of medium components and growth conditions by response surface methodology to enhance phenol degradation byPseudomonasputida[J].Journal of Hazardous Materials, 2008, 151(1): 171-178.
[10]布钦南R E,吉本斯 N E.伯杰细菌鉴定手册[M].中国科学院微生物研究所,译.北京:科学出版社,1984.
[11]Kilic N K. Enhancement of phenol biodegradation byOchrobactrumsp.isolated from industrial wastewaters[J].International Biodeterioration and Biodegradation, 2009, 63(6): 778-781.
[12]马海娟,李光明,方萍,等.诺卡氏菌株C-14-1对苯酚降解特性的研究[J].水处理技术,2008,34(12):43-46.
[13]钱奕忠,张鹏,谭天伟.假单胞菌降解含苯酚废水试验[J].过程工程学报,2001,1(4):439-441.
