钴(Ⅱ)与芳香氮碱金属有机配合物的合成及荧光性能
2014-03-25迟红训王幸幸梁景松
迟红训, 王幸幸, 梁景松
(辽东学院 化工与材料学院, 辽宁 丹东 118003)
近年来,随着药物化学和生物无机化学的迅猛发展,尤其是在细胞层次及分子层次上的无机药物研究,人们逐渐发现金属离子及其配合物药物分子在消化吸收、转运转化和生物活性等方面的作用规律,获得一系列金属配合物的新颖诊断和治疗效果,探讨了金属配合物与DNA的作用及其生物活性间的构效关系,掌握了许多无机准药物分子的生物作用以及结构之间的依存关系[1-3],从分子水平上了解某些疾病的发病机理,阐明抗肿瘤药物的作用机理,并通过分子设计来寻找低毒高效的治疗药物,对无机药物体外筛选及研发具有重要的指导意义[4-6].过渡金属配合物在医学研究领域,尤其是在抗癌方面的研究日益受到重视,已成为目前研究的一个热点[7-9].本文合成一个钴配合物单晶,对结构进行了表征,研究配合物的分子结构和分子间弱作用,通过荧光光谱法研究了配合物与DNA的作用.
1 实验部分
1.1 试剂与仪器
硝酸钴,吡嗪-2,3-二羧酸,无水乙醇,均为分析纯.鱼精DNA(P的质量分数8 %) 为生化试剂.
Bruck smart 1000 CCD-X射线单晶衍射仪,Nicolet 470红外光谱仪,PE-LS 55荧光光谱仪,D-MS-I 磁力搅拌器,PHS-3C精密数显酸度计,E-201-C pH复合电极,AR2140电子分析天平,800B离心机.
1.2 Co(Ⅱ)化合物的合成与表征
将10 mL、15 mmol/L硝酸钴水溶液与10 mL、15 mmol/L吡嗪-2,3-二羧酸水溶液混合.连续搅拌下,用0.1 mol/L盐酸调节混合溶液pH值至4.8,搅拌8 h后pH值相对稳定为5.2.将该溶液过滤至烧杯中,室温下放置3~4周,烧杯中有淡粉色晶体析出,滤纸过滤,收集晶体,于真空干燥器干燥,收率60 %.C6H10N2O8Co元素分析测定值(w/%):C 24.23;H 3.41;N 9.47.理论计算值(w/%):C 24.26;H 3.39;N 9.43.配合物红外谱分析结果(σ/cm-1):3 419(s),2 360(s),1 600(s),1 444(m),1 384(m),1 130(m),825(m),767(m).
2 结果与讨论
2.1 化合物晶体结构
选取尺寸为0.24 mm×0.32 mm×0.19 mm的配合物单晶.在Bruker Smart 1000 CCDX单晶衍射仪上,用通过石墨单色器的Mo Kα为靶源(λ=0.071 073 nm),在一定范围内收集其衍射数据.应用Saint软件包对数据进行还原.采用直接法对晶体结构进行解析.氢原子采用理论加氢的方法获得,其余非氢原子则采用最小二乘法及各向异性修正.通过X-射线衍射数据分析对配合物的分子结构进行分析,得到该配合物的配位结构如图1所示.
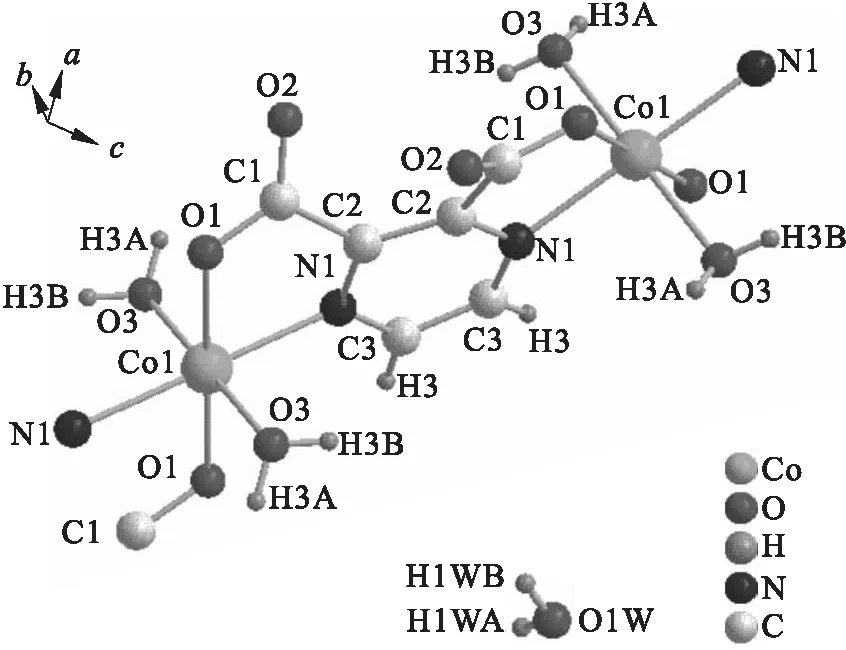
图1 配合物的配位结构Fig.1 Coordinated environment of complex
在配位化学研究领域,吡嗪羧酸类物质常被作为配体引入到金属配合物中,这是因为它与过渡金属离子之间具有很强的螯合作用.在其形成的金属配合物中,存在氢键作用,从而构成零维、一维、二维以及三维结构.从图1可以看到:配合物的每个中心离子Co(Ⅱ)采用六配位模式与其周围的氮、氧原子及水分子形成一个八面体结构.其主要键长(nm)为:Co(1)—N(1),0.213(1);Co(1)—N(1)#1,0.213(1);Co(1)—O(1),0.206(1);Co(1)—O(1)#1,0.206(1);Co(1)—O(3),0.210(1);Co(1)—O(3)#1,0.210(1).主要键角(°)为:O(3)—Co(1)—N(1),88.35(5);O(3)—Co(1)—N(1)#1,88.35(5);O(3)—Co(1)—N(1),91.65(5);O(3)—Co(1)—N(1)#1,91.65(5).其中总键角之和等于360°,说明在形成的八面体结构中,参与配位的2个氮原子和2个氧原子处在同一平面上[10].这种配位模式特有的空间位阻和作用力,对整个结构的稳定性起到至关重要的作用.
从图2可以看到:中心离子为Co(Ⅱ),它与其周围的来自于2个不同的吡嗪-2,3-二羧酸配体的氮原子、氧原子以及2个水分子形成六配位的八面体结构.Co(Ⅱ)与2个相邻的吡嗪-2,3-二羧酸配体反式螯合,形成一个以Co(Ⅱ)为中心的对称的、无限延伸的一维链状结构.
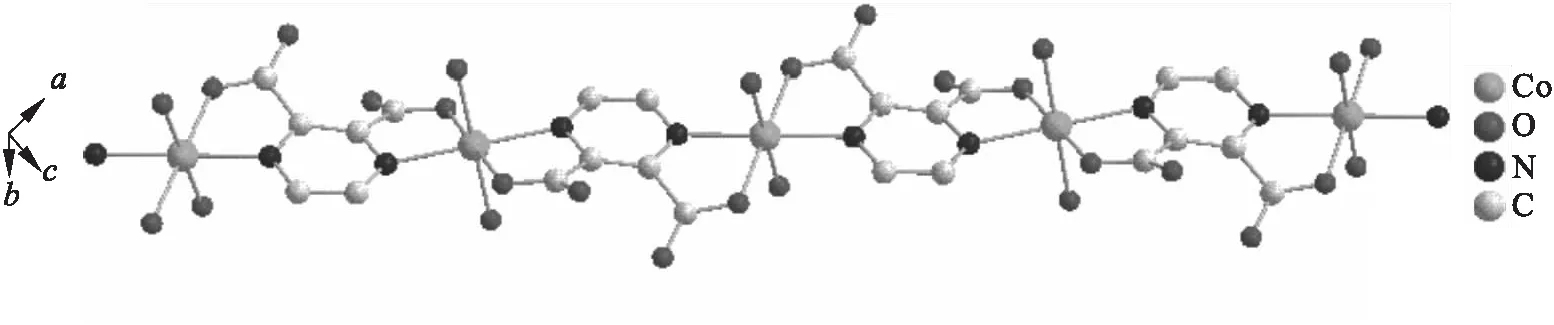
图2 配合物一维结构Fig.2 One dimension structure of the complex
从图3可以看出:一维链与一维链之间通过O—H…O的氢键作用,形成稳定的二维结构,其中O(2)—H(3A)的距离为0.189 7 nm.从图4可以看到:配合物的三维空间结构是通过O(2)与H(3)之间C—H…O的氢键作用所形成.其中O(2)—H(3)之间的距离为0.241 7 nm.

图3 配合物的二维氢键作用Fig.3 Two dimension structure of the complex

图4 配合物的氢键作用Fig.4 Hydrogen bonds of the complex
2.2 化合物与DNA作用
溴化乙锭(EtBr)与DNA发生作用后,能够破坏DNA原有紧密螺旋结构,阻止DNA进行复制转录,影响生物体的繁衍生殖进程.如果所合成的化合物(M)与EtBr具有相似结构,且荧光不强,就能够和EtBr分子竞争与DNA结合位点,缓释EtBr分子,导致EtBr/DNA复合体系的荧光减弱:M+EtBr·DNA=M·DNA+EtBr,以插入方式与DNA作用,因此可以跟踪反应体系的荧光变化来判断化合物(M)与DNA结合能力的强弱.依据经典斯特恩-沃尔默(Stern-Volmer)方程[11]:
其中:I0为复合物体系(M/EtBr/DNA)中未添加配合物(M)的荧光强度,I为添加配合物(M)时的荧光强度;r为体系中配合物(M)与DNA的浓度比;Ksq为斯特恩-沃尔默(Stern-Volmer)猝灭表征常数,用于定量描述配合物与DNA的作用能力强弱.通过Ksq值大小,定量地比较不同配合物分子在相同环境下与DNA作用能力的强弱,Ksq数值越大,表明配合物分子与DNA结合能力越强,作用强度越大.
图5为荧光法测定配合物分子与鱼精DNA发生作用的结果.从图5可以看出:DNA/EtBr复合物的荧光发射峰处于610 nm波长处;随着配合物分子浓度的逐渐增加,与EtBr的竞争力增强,使DNA/EtBr复合物体系的荧光强度逐渐
减弱,并导致了不同程度的猝灭.结果表明配合物分子的浓度越大,荧光猝灭越显著,说明该化合物与DNA发生了不同程度地专一插入作用[12].

c(DNA)=5×10-6mol/Lc(EB)=1.0×10-6mol/L 1c(M)=0 mol/L 2c(M)=0.5×10-5mol/L 3c(M)=1.0×10-5mol/L 4c(M)=1.5×10-5mol/L 5c(M)=2.0×10-5mol/L
图5 配合物与DNA作用的荧光光谱
Fig.5 The emission spectrum of EB bound to DNA
3 结 论
采用常温法合成了一个钴配合物单晶,分子式[Co(Pyzdc)(H2O)2]n·nH2O.采用红外光谱法、元素分析法和X-射线单晶衍射技术对配合物的结构进行了分析表征.通过荧光光谱研究配合物与DNA相互作用,结果显示配合物添加到DNA/EtBr复合体系中后,能够减弱荧光强度,发生荧光猝灭现象,说明该配合物能够与溴化乙锭发生竞争,与DNA发生作用,并插入DNA碱基对中.
参考文献:
[1] 孙伟.基于DNA相互作用的多核配合物的合成、结构及抗肿瘤活性研究[D].青岛:中国海洋大学,2009:3-15.
[2] 牟永平,吴刚,周立社,等.抗肿瘤金属配合物药物及其药理作用的研究进展[J].中国药理学通报,2007,23(11):1409-1413.
[3] 康永,艾罡.无机金属配合物与DNA的相互作用问题[J].生物医学工程学进展,2011,31(1):24-28.
[4] Lippert B.Cisplatin:Chemistry and Biochemistry of a Leading Anticancer Drug[M].Weinheim:Wiley-VCH,1999:207-221.
[5] 李清萍.含氮杂环铂(Ⅳ)类配合物的合成、抑菌性及与DNA相互作用研究[D].兰州:西北师范大学,2011:12-14.
[6] 康永,艾罡.无机金属配合物与DNA的相互作用问题[J].精细化工原料及中间体,2011(5):28-31.
[7] Vyas K M,Jadeja R N,Patel D,et al.A New Pyrazolone Based Ternary Cu(Ⅱ) Complex:Synthesis,Characterization,Crystal Structure,DNA Binding,Protein Binding and Anti-cancer Activity Towards A549 Human Lung Carcinoma Cells With a Minimum Cytotoxicity to Non-cancerous Cells[J].Polyhedron,2013,65:262-274.
[8] Pait M,Kundu B,Kundu S C,et al.Copper(Ⅱ) Complexes of Piperazine Based Ligand:Synthesis,Crystal Structure,Protein Binding and Evaluation of Anti-cancerous Therapeutic Potential[J].Inorganica Chimica Acta,2014,418(1):30-41.
[9] Frías González S E,Anguiano E A,Herrera A M,et al.Pro-apoptotic,Pro-oxidant,and Non-genotoxic Activities of a Novel Copper(Ⅱ) Complex Against Human Cervical Cancer[J].Toxicology,2013,314(1):155-165.
[10] Dehghani H.Spectrophotometric Studies of the Thermodynamics of Molecular Complexation between Free Base Meso-tetraarylporphyrins and Iodine(Ⅲ) Chloride[J].Journal of Solution Chemistry,2009,38:771-778.
[11] Lakowicz J R,Weber G.Quenching of Fluorescence by Oxygen,Probe for Structural Fluctuations in Macromolecules[J].Biochemistry,1973,12:4161-4170.
[12] 张黔玲,刘剑洪,任祥忠,等.新型双核配合物的形成、与 DNA 的作用机制及荧光性质研究[J].化学学报,2006,64(10):968-974.
