大鼠发热过程中脑腹中膈区TRPV1及AVPV1受体的表达
2014-03-22曹志友施蓓单悦梅张璠秦鑫曹宇
曹志友,施蓓,单悦梅,张璠,秦鑫,曹宇
(中国医科大学基础医学院生理学教研室,沈阳110001)
·论著·
大鼠发热过程中脑腹中膈区TRPV1及AVPV1受体的表达
曹志友,施蓓,单悦梅,张璠,秦鑫,曹宇
(中国医科大学基础医学院生理学教研室,沈阳110001)
目的观察在脂多糖致大鼠发热过程中脑腹中膈区(VSA)瞬时受体电位香草酸受体1(TRPV1)及精氨酸加压素(AVP)V1受体表达水平的变化。方法实验动物随机分为4组:正常对照(N)组、Capsazepine(C)组、脂多糖(L)组和Capsazepine+脂多糖(C+L)组。连续观察体温变化;对不同实验条件下VSA中TRPV1的表达采用Western blot方法检测,AVPV1受体mRNA水平变化采用RT-PCR方法检测。结果L组和C+L组体温显著增高,C+L组210~510 min期间体温明显高于L组(P<0.01)。TRPV1的表达水平显示致热后逐渐增多,L组最高值为基础状态的2.2倍。C+L组为1.72倍。同样,AVPV1受体mRNA表达水平出现相似的变化趋势,L组AVPV1受体mRNA表达最大量为基础状态的2.4倍。C+L组为1.95倍。结论LPS致大鼠发热时,体温升高到一定程度可诱导腹中膈区TRPV1的表达,并伴有AVPV1受体mRNA表达水平升高,此变化有利于AVP发挥对体温的负调节作用。
发热;瞬时受体电位香草酸受体1;精氨酸加压素V1受体;腹中膈
发热是机体在致热原作用下,通过体温调节中枢重调定产生的病理生理性体温升高,是机体对致热原刺激产生的一种调节反应。目前认为发热时体温上升值是由中枢内不同调节物质相互作用的结果,存在于体温调节中枢的精氨酸加压素(arginine vasopressin,AVP)是对体温具有负调节作用的物质,经下丘脑分泌后作用于腹中膈区(ventral septal area,VSA)[1],然而,关于中枢调控发热正、负调节物质的分子生物学机制还不清楚。瞬时受体电位香草酸亚型1(transient receptor potential vanilloid subfamily member 1,TRPV1)是近年发现的一种非选择性阳离子通道蛋白,离体实验显示可以直接被43℃以上的较高温度激活[2],在体时炎性因子等可降低其激活阈值[3],激活时通过产生钙离子内向性电流发挥功能作用[4]。根据其温度感受的特性,我们推测存在于体温调节中枢的TRPV1很可能参与发热过程的体温调节活动。为进一步探讨TRPV1对内源性发热负调节物质AVP作用的调控,本实验采用脂多糖(lipopolysaccharide,LPS)复制大鼠发热模型,结合应用TRPV1特异性阻断剂辣椒平(capsazepine),观察发热不同时相VSA组织中TRPV1表达和精氨酸加压素V1受体(AVPV1 receptor,AVPV1R)表达水平,以期明确TRPV1参与体温调节的中枢机制。
1 材料与方法
1.1 实验动物及分组
清洁级雄性SD大鼠,96只,体质量200~250 g,由中国医科大学实验动物中心提供,实验室温度控制在(20±2)℃,相对湿度40%~60%,昼夜光照节律12 h∶12 h,基础体温(38.1±0.2)℃,单笼饲养,自由进食水。实验所用试剂均用无热原生理盐水稀释。
将大鼠随机均分成4组,每组6只。(1)正常对照组(N组):腹中膈区局部注射溶解capsazepine溶剂(简称溶剂)10 μL,30 min后腹腔注射生理盐水(4 mL·kg-1);(2)Capsazepine组(C组):腹中膈区局部注射capsazepine 0.02 mg·kg-1,(美国Sigma公司)配制成溶液10 μL(溶剂为10%无水乙醇+10% Tween80+80%生理盐水配制),30 min后腹腔注射生理盐水(4 mL·kg-1);(3)LPS发热组(L组):向腹中膈区局部注射溶剂10 μL,30 min后腹腔注射LPS(4 mL·kg-1,LPS浓度为20 μg·ml-1,用生理盐水配制,美国Sigma公司);(4)Capsazepine+LPS组(C+L组):方法同C组和L组,向腹中膈区局部注射capsazepine及腹腔注射LPS。L组和C+L组分别取7个采样时间点。
持续观察动物体温510 min,描绘其体温变化曲线。检测样品采集来自N组和C组于注射生理盐水后210 min、L组和C+L组分别在给予LPS后0(未施加实验因素时),30,90,210,270,330,510 min。动物处理采取断头,打开颅骨顶,暴露脑组织,按大鼠脑图谱取出腹中膈区组织,立即投入液氮中速冻固定,20 min后放入-70℃冰箱内待测。
1.2 腹中膈区插管
将大鼠用10%水合氯醛(3 mL/kg)腹腔麻醉,然后将其头部固定于立体定位仪上,暴露前囟。参照大鼠脑图谱,用探针在颅骨表面钻孔,向腹中膈区(P:0.8 mm;L:1.5 mm;H:5.4 mm)插入1根不锈钢管,并留置与之相匹配的针芯,然后用牙科水泥固定。术后动物单笼饲养,恢复1周后进行实验。实验结束后检查插管位置,舍掉位置不正确的实验数据。
1.3 体温变化曲线的绘制
实验前对大鼠进行测温适应3 d,进行体温测量时,将涂有石蜡油的温度计探头(北京师范大学司南仪器厂生产)插入大鼠直肠6 cm处,待数值稳定后读数,以给药前1 h测得的3次直肠温度的平均值为大鼠基础体温。然后各组注射相应药物后30 min记录1次体温,直到实验结束,测算出体温变化值(ΔT℃),绘制体温变化曲线。
1.4 Western blot方法检测腹中膈组织TRPV1表达
取大鼠腹中膈区组织,冰浴匀浆,4℃离心(12 000 r·min-1)30 min 2次,取上清。进行蛋白定量后,电泳、转膜、封闭,加抗TRPV1抗体(1∶1 000)(美国Sigma公司),二抗为羊抗兔IgG(武汉博士德公司产品),ECL化学发光法显色,图像分析系统分析。对照选用抗β-肌动蛋白抗体(β-actin)。采用目的蛋白与相应β-actin蛋白的灰度比值表示相对表达量。
1.5 RT-PCR检测
按照Trizol说明书的方法提取腹中膈区组织RNA。取1 μg按RT-PCR试剂盒检测方法进行目的基因(AVPV1R)和内参基因(β-actin)的扩增。反应条件为94℃变性1 min,60℃退火1 min,72℃延伸1 min,共35个循环,最后72℃延伸10 min。AVPV1R上游引物为5′-CGACACAGCAAGGGTG ACAAGG-3′,下游引物为5′-AGGAAGCCAGCA ACGCCG-3′,扩增片段的长度为265 bp[5]。β-actin上游引物为5′-CCCATCTATGAGGGTTACGC-3′,下游引物为5′-TTTAATGTCACGCACGATTTC-3′,扩增片段的长度为432 bp。PCR产物经1.5%的琼脂糖凝胶电泳后,用凝胶成像分析系统进行mRNA表达水平分析,以AVPV1R/β-actin的灰度比值作为相对表达量。
1.6 统计学处理
采用SPSS 13.0软件进行统计学分析,所有实验数据均用表示,各组间比较应用t检验,P<0.05认为差异有统计学意义。
2 结果
2.1 各实验组大鼠体温变化
如图1所示,C组与N组比较各时间点的体温变化值无统计学差异(P>0.05)。大鼠给予LPS后(L组)可见体温明显升高,在210 min时达高峰值,升高(1.33±0.23)℃,在510 min回降至接近基础水平。L组与N组比较,在90~450 min期间各时间点差异显著(P<0.05)。C+L组与N组比较,在90~510 min期间体温变化值显著增大(P<0.01),最高值出现在270 min,为(1.50±0.23)℃。与L组比较,C+L组发热时程延长,发热幅值升高,在270~510 min期间差异显著(P<0.01)。
2.2 VSA组织TRPV1表达的变化

图1 连续记录的各组大鼠体温变化曲线Fig.1 Body temperature changes in each group rats by continuous recording
图2显示了1例在L组(210 min)VSA组织检测出的TRPV1mRNA和蛋白水平的表达及组织免疫荧光检测结果。经RT-PCR扩增通过琼脂糖凝胶电泳可见存在阳性表达产物,其扩增片段长度与设计产物长度一致。同时也检测到蛋白质阳性表达产物。

图2 大鼠腹中膈区TRPV1表达的鉴定Fig.2 Identification of TRPV1 expression in rat ventral septal area
采用Western blot方法检测的各实验组在不同时间点VSA组织中TRPV1的表达(图3),可见L组和C+L组TRPV1表达水平均随温度升高而增多,在体温处于高峰值时(210,270 min)TRPV1表达达到最大量,之后逐渐降低。其中,L组TRPV1表达最大量为基础状态的2.2倍。C+L组为1.72倍。在90,210 min时间点C+L组TRPV1表达显著低于L组(P<0.05)。
2.3 VSA中AVPV1RmRNA表达水平变化
采用RT-PCR方法检测的各实验组不同时间点VSA组织中AVPV1RmRNA水平的表达,结果见图4。N组、C组、L组(0,30,510 min)和C+L组(0,30, 510 min)之间没有统计学差异(P>0.05)。L组和C+L组随体温升高AVPV1RmRNA表达量增多,在体温明显升高(90~330 min)时,与N组、C组比较具有统计学差异(P<0.05),在L组AVPV1RmRNA表达最大量为基础状态的2.4倍。C+L组为1.95倍。C+L组在90,210 min检测结果显著低于L组(P<0.05)。
3 讨论
对于人和其他的恒温动物,体温过高会影响机体进行正常的功能活动,甚至造成蛋白质变性等不可逆性的损伤[5]。关于发热机制的研究目前主要发现一些具有抑热作用的内源性物质,其中在脑中的AVP作为一种主要的内源性解热物质,在机体发热过程中具有限制体温升高的作用,主要通过作用于VSA的V1受体发挥解热或限热作用[6],然而,机体是如何调控AVP发挥这一生理功能目前还不清楚。
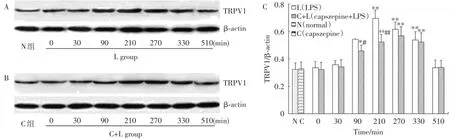
图3 大鼠经LPS致热过程中VSA TRPV1的表达Fig.3 Expression of TRPV1 in VSA in different groups
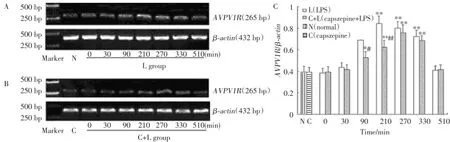
图4 LPS致热大鼠时VSA中AVPV1R mRNA的表达Fig.4 Expression of AVPV1R mRNA in VSA in different groups
TRPV1是近年来发现的存在于细胞膜或胞内细胞器膜上的一类与多种感受功能有关的非选择性阳离子通道蛋白,可以被热刺激等多种理化因素激活,有关TRPV1结构及活性的调控也有了新的研究进展[7],其基本结构中具有6个跨膜区,在第五和第六跨膜区内,有一个附加的疏水片段为其核心区域,在膜内N端和C端形成多个结构域。其功能活性主要在转录后水平通过磷酸化、去磷酸化及糖基化等形式进行调节,激活时主要引起Ca2+的大量内流,以胞内Ca2+浓度增高的形式调节着相应的生理功能或病理机制的发生。有研究显示抑制TRPV1可诱发出现高体温[8],提示TRPV1具有限制体温升高的作用,特别是存在于体温调节中枢的TRPV1在机体的发热反应中具有重要的作用。VSA作为神经垂体激素主要具有抗利尿作用和收缩血管的作用,是机体重要的应激反应激素,而作为中枢神经递质,除参与学习与记忆及行为活动的调节以外[9],如上所述,AVP还是体内重要的发热负调节物质,VSA则是AVP发挥发热负调节作用的靶组织。那么,VSA的AVP受体表达水平很可能是一个重要的调节靶点。TRPV1是否通过调节AVP受体表达水平,进而影响AVP发挥抑制发热反应的作用,这是我们想要明确的问题,为此,我们复制了LPS发热大鼠模型,结合应用TRPV1的阻断剂(capsazepine),在连续监测体温变化的同时,检测了VAS的TRPV1及AVPV1RmRNA的表达水平。Capsazepine是TRPV1的特异性阻断剂,能抑制TRPV1通道的开放及下调其表达水平,减少钙离子内流[10]。实验结果显示,在LPS致发热过程中,VSA中TRPV1的表达在体温升高过程中逐渐增多,同时检测到与之伴随的AVPV1RmRNA表达水平升高。而预先脑室内给予capsazepine,TRPV1表达量在发热达高峰期间低于单纯应用LPS诱导发热组,同样,AVPV1RmRNA表达水平也出现了相似的变化趋势。以上结果说明VSA中的TRPV1表达与AVPV1R的表达相关联,可能在机体发热时TRPV1由于具有温度感受特性而被激活,进而,使AVPV1R的表达量增多,以有利于AVP发挥限制体温升高的作用,这可能是TRPV1参与机体发热反应调控的重要机制之一,当然,有关更直接的证据还需要电生理学等方面的深入研究。
[1]Dong J,Xie XH,Lu DX,et al.Effects of electrical stimulation of ventral septal area on firing rates of pyrogen-treated thermosensitive neurons in preoptic anterior hypothalamus from rabbits[J].Life Sci,2007,80(5):408-413.
[2]Li L,Hasan R,Zhang X.The basal thermal sensitivity of the TRPV1 ion channel is determined by PKCβⅡ[J].J Neurosci,2014,34(24):8246-8258.
[3]Cortriqht DN,Szallzsi A.Biochemical pharmacology of the vanilloid recepter TRPV1[J].Eur J Biochem,2004,271(10):1814-1819.
[4]Sokabe T,Tominaga M.Molecular mechanisms underlying thermosensation in mammals[J].Brain Nerve,2009,61(7):867-873.
[5]Axelrod YK,Diringer MN.Temperature management in acute neurologic disorders[J].Neurol Clin,2008,26(2):585-603.
[6]Richmond CA.The role of arginine vasopressin in thermoregulation during fever[J].J Neurosci Nurs,2003,35(5):281-286.
[7]Nagy I,Friston D,Valente JS,et al.Pharmacology of the capsaicin receptor,transient receptor potential type-1 ion channel[J].Prog Drug Res,2014,68:39-76.
[8]Othman AA,Nothaft W,Awni WM,et al.Effects of the TRPV1 antagonist ABT-102 on body temperature in healthy volunteers:pharmacokinetic/pharmacodynamic analysis of three phase 1 trials[J]. Br J Clin Pharmacol,2013,75(4):1029-1040.
[9]Wojciak P,Remlinger-Molenda A,Rybakowski J.The role of oxytocin and vasopressin in central nervous system activity and mental disorders[J].Psychiatr Pol,2012,46(6):1043-1052.
[10]Babes A,Amuzescu B,Krause U,et al.Cooling inhibits capsaicin induced currents in cultured rat dorsal root ganglion neurons[J]. Neurosci Lett,2002,317(3):131-134.
(编辑 武玉欣)
Expression ofTRPV1 and AVPV1 Receptorsin the VentralSeptalArea ofRatduring Fever
CAOZhi-you,SHIBei,SHANYue-mei,ZHANGFan,QINXin,CAOYu
(DepartmentofPhysiology,College ofBasic MedicalScience,China MedicalUniversity,Shenyang 110001,China)
ObjectiveTo evaluate of expression levels of transient receptor potential vanilloid receptor 1(TRPV1)and arginine vasopressin(AVP)V1 receptorsin the ventralseptalarea(VSA)ofratduring fever.MethodsThe male rats were randomly divided into fourgroups:the control group(N),the Capsazepine group(CPZ),the LPS group(L)and the Capsazepine+LPS group(CPZ+LPS).Body temperature of the rats were continuously observed.TRPV1 expression was detected by Western blot andAVPV1mRNA lever was determined by RT-PCR in the VSA.ResultsThe body temperature ofthe rats were increased in both L group and C+L group;the body temperature was significantly higherin C+Lgroup than that in L group during 210-510 min(P<0.01).The levelofTRPV1 expression was gradually increased afterthe administration of LPS.The highestvalue in the L group was 2.2 times than that of the basal state,and in the C+L group the value was 1.72 times.Meanwhile,the mRNA level of AVPV1 appeared the similar trend.The maximum expression ofAVPV1mRNA level in group L was 2.4 times than that of the basal state,and the value was 1.95 times in the C+L group.ConclusionDuring the LPS-induced fever,whenever the temperature was rose to a certain degree,the TRPV1 expression could be induced in the VSA and theAVPV1mRNAlevelcould also be increased,which may play a negative effecton the regulation ofthe body temperature.
fever;transient receptor potential vanilloid receptor1;arginine vasopressin;ventral septal area
R332
A
0258-4646(2014)11-0965-04
国家自然科学基金主任基金(31340074);辽宁省自然科学基金(201202277)
曹志友(1981-),男,硕士研究生.
曹宇,E-mail:caoycmu@163.com
2014-08-21
网络出版时间:
