姜黄素对脂多糖刺激成骨细胞骨吸收的影响
2014-03-22王雪梅尚德浩潘亚萍
王雪梅,尚德浩,潘亚萍
(1.中国医科大学口腔医学院牙体牙髓科,中国医科大学口腔医学院中心实验室,辽宁省口腔医学研究所牙体牙髓病学研究室,沈阳110002;2.中国医科大学口腔医学院种植科,沈阳110002;3.中国医科大学口腔医学院牙周科,沈阳110002)
姜黄素对脂多糖刺激成骨细胞骨吸收的影响
王雪梅1,尚德浩2,潘亚萍3
(1.中国医科大学口腔医学院牙体牙髓科,中国医科大学口腔医学院中心实验室,辽宁省口腔医学研究所牙体牙髓病学研究室,沈阳110002;2.中国医科大学口腔医学院种植科,沈阳110002;3.中国医科大学口腔医学院牙周科,沈阳110002)
目的通过逆转录聚合酶链反应(RT-PCR)方法探讨姜黄素对脂多糖(LPS)刺激成骨细胞后骨保护因子(OPG)和破骨细胞核因子κB受体活化因子配基(RANKL)mRNA表达的影响。方法1 μg/mL LPS作用成骨细胞6、12、18、24、48 h,并用10 μmol/L姜黄素预处理成骨细胞60 min后加入1 μg/mL LPS继续作用6、12、18、24、48 h,RT-PCR检测成骨细胞OPG和RANKLmRNA的表达。结果当以1 μg/mL LPS作用于成骨细胞,随着作用时间的增加成骨细胞表达RANKLmRNA的能力逐渐增强,到24 h达到最高峰,到48 h基本恢复至初始水平;用10 μmol/L姜黄素预处理成骨细胞,然后再用1 μg/mL LPS处理成骨细胞48 h,发现成骨细胞表达RANKLmRNA的能力明显减弱,随着作用时间的增加成骨细胞表达RANKLmRNA的能力变化不明显。当以1 μg/mL LPS作用于成骨细胞,成骨细胞表达OPGmRNA的能力无明显变化;用10 μmol/L姜黄素预处理成骨细胞,然后再用1 μg/mL LPS处理成骨细胞48 h,发现成骨细胞表达OPGmRNA的能力也无明显变化。结论姜黄素可以减少LPS刺激后成骨细胞RANKLmRNA的表达,对OPGmRNA表达无影响,进而使得RANKL/OPG的比值减小,抑制骨吸收。
姜黄素;脂多糖;骨保护因子;破骨细胞核因子κB受体活化因子配基
细胞壁脂多糖(lipopolysaccharide,LPS)是革兰阴性厌氧菌内毒素的主要成分,当发生慢性根尖周炎或牙周炎时,LPS打破骨吸收和骨沉积的平衡状态,出现骨丧失。它不仅可以刺激细胞产生炎性细胞因子,使单核细胞、淋巴细胞等向破骨细胞前体细胞分化,而且可以促进成熟的破骨细胞存活,刺激骨吸收。LPS还可以直接作用于成骨细胞产生大量的破骨细胞核因子κB受体活化因子配基(receptor activator of nuclear factor-κB ligand,RANKL),它们与来自于血液或局部的破骨细胞前体细胞表面的破骨细胞核因子κB受体活化因子(receptor activator of nuclear factor-κB,RANK)结合,启动骨保护因子(osteoprotegerin,OPG)/RANKL/RANK信号传导通路,促进破骨细胞分化和成熟,使破骨活动增强,导致牙槽骨吸收,LPS是牙槽骨病理性吸收的关键因素。
大量研究证明,姜黄素具有抗氧化[1]、抗诱变、抗肿瘤[2]、抗炎[3]、清除自由基、抗微生物等多方面作用,在过去20年的研究中,姜黄素在多种细胞中显示了抗炎和免疫调节活性,但在口腔领域的研究还很少。Guimarães等[4]研究发现口服姜黄素可以降低LPS引起的实验性鼠牙周炎的免疫炎性反应,并且有研究发现姜黄素可以抑制LPS对多种细胞的损伤作用[5~12],因此本实验选用LPS作为外源性刺激物作用于体外原代培养的大鼠成骨细胞,应用逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)法检测姜黄素对LPS刺激成骨细胞OPG和RANKLmRNA表达的影响,以期证明姜黄素对LPS诱导骨吸收有抑制作用,为姜黄素治疗牙周炎和根尖周炎提供理论依据。
1 材料与方法
1.1 实验动物
新生24 h内的SD胎鼠,雌雄不限,体质量约6 g,由中国医科大学实验动物部提供。
1.2 主要试剂
Ⅰ型胶原酶、姜黄素、LPS、MTT(美国Sigma公司);高糖DMEM细胞培养液(美国Gibco公司);胰蛋白酶(华美公司);RT-PCR试剂盒(日本TaKaRa公司)。
1.3 成骨细胞的原代培养
取新生的SD胎鼠颅骨剪成碎片,胰蛋白酶消化,Ⅰ型胶原酶消化进行成骨细胞培养,以1∶2进行传代,每隔2 d换液1次,5~7 d进行传代[13]。
1.4 RT-PCR检测成骨细胞OPG和RANKLmRNA的表达
取第3~4代成骨细胞按5×103/cm2的密度接种于25 cm2的培养瓶中,加入1 μg/mL LPS继续作用6、12、18、24和48 h,然后用10 μmol/L姜黄素预处理60 min后加入1 μg/mL LPS持续作用6、12、18、24和48 h,分别在各时间点收集细胞,保存于-80℃冰箱中,留待RT-PCR实验所用。反应条件:94℃预变性1 min,94℃30 s,55℃30 s,72℃1 min,共扩增30个循环;72℃延伸5 min。RANKL引物序列:上游5′-TACTTTCGAGCGCAGATGGAT-3′,下游5′-GTACGCTTCCCGATGTTTCAT-3′,产物大小为482 bp;OPG引物序列:上游5′-AAACAGCACTGCACAG TGAG-3′,下游5′-TGGTAGGAACAGCAAACCTG-3′,产物大小为489 bp;GAPDH引物序列:上游5′-GGTGAAGGTCGGTGTGAACG-3′,下游5′-CTCGCT CCTGGAAGATGGTG-3′,产物大小为250 bp。
1.5 统计学分析
采用SPSS10.0软件包进行数据处理,采用t检验对比各时间点基因表达,P<0.05为差异有统计学意义。
2 结果
2.1 LPS刺激成骨细胞后RANKLmRNA的表达
RT-PCR的结果表明,LPS增强成骨细胞表达RANKLmRNA呈时间依赖性。成骨细胞基础表达少量RANKLmNRA及较强OPGmNRA。当以1 μg/mL LPS作用于成骨细胞48 h,随着作用时间的增加成骨细胞表达RANKLmRNA的能力逐渐增强,到24 h达到最高峰,24 h后成骨细胞表达RANKLmRNA的水平开始下降,到48 h基本恢复至初始水平(图1)。
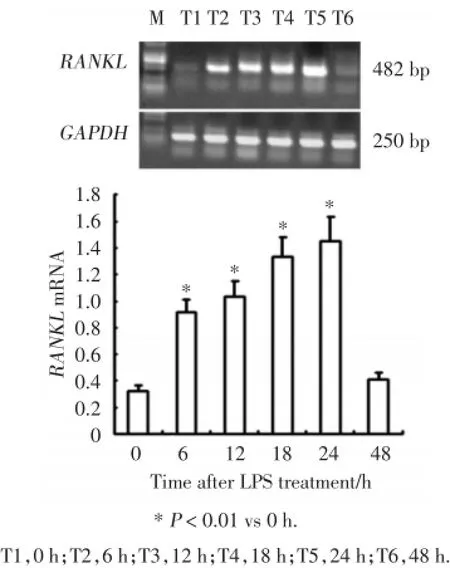
图1 RT⁃PCR检测LPS刺激后成骨细胞RANKL mRNA的表达Fig.1 Expression of RANKL mRNA after LPS stimulation in osteoblasts by RT⁃PCR
2.2 姜黄素对LPS刺激成骨细胞后RANKLmRNA表达的影响
用10 μmol/L姜黄素预处理成骨细胞60 min,然后再用1 μg/mL LPS处理成骨细胞48 h,发现成骨细胞表达RANKLmRNA的能力较LPS刺激组明显减弱,随着作用时间的增加成骨细胞表达RANKLmRNA的能力变化不明显(图2)。
2.3 姜黄素对LPS刺激成骨细胞后OPGmRNA表达的影响
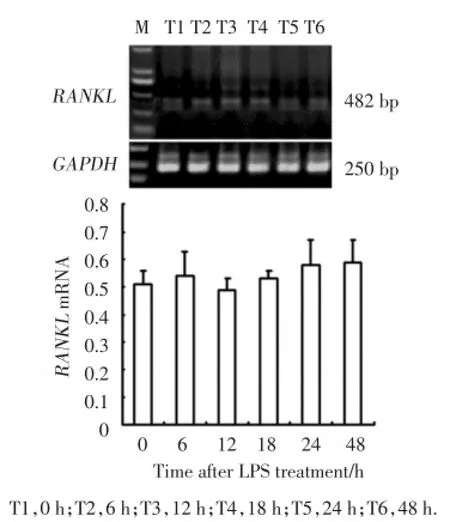
图2 RT⁃PCR检测姜黄素对LPS刺激后RANKL mRNA表达的影响Fig.2 Expression of RANKL mRNA in osteoblasts with curcumin preconditioned plus LPS stimulation by RT⁃PCR
当以1 μg/mL LPS作用于成骨细胞,成骨细胞表达OPGmRNA的能力无明显变化,当用10 μmol/L姜黄素预处理成骨细胞,然后再用1 μg/mL LPS处理成骨细胞48 h,发现成骨细胞表达OPGmRNA的能力也无明显变化(图3)。
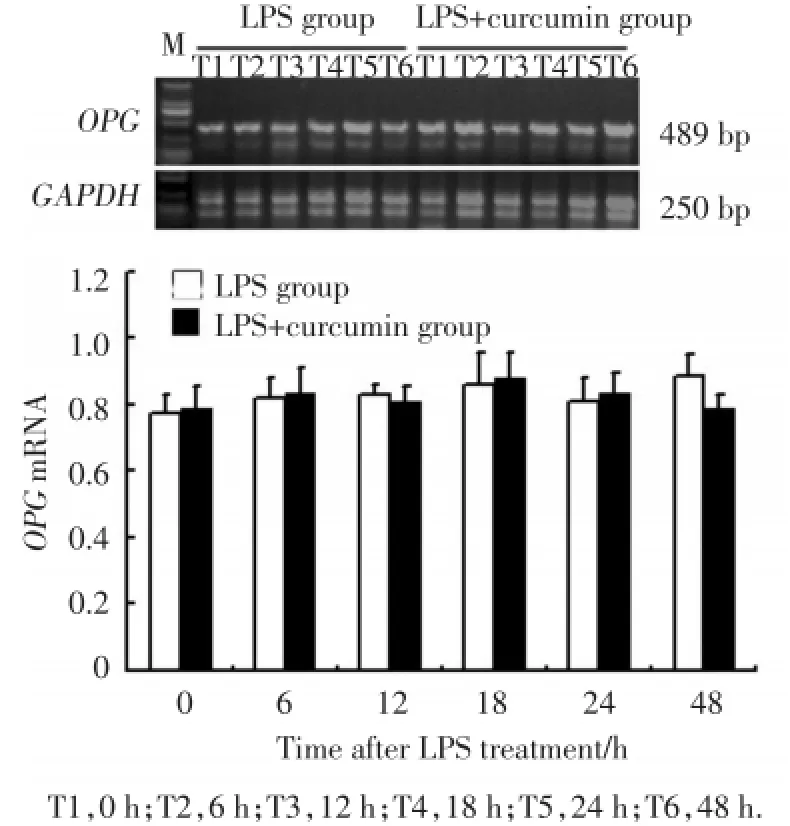
图3 姜黄素对LPS刺激后OPG mRNA表达的影响Fig.3 Expression of OPG mRNA in osteoblasts with curcumin preconditioned plus LPS stimulation by RT⁃PCR
3 讨论
近几年的研究认为,骨组织的代谢是通过成骨细胞和破骨细胞共同完成的,然而破骨细胞表面的受体非常少,其启动、功能激活到最后凋亡都需要成骨细胞的调节。成骨细胞分泌OPG和RANKL两种物质调节骨代谢,二者的比值是成骨细胞促进破骨细胞分化的决定性因素。RANKL一旦与RANK结合就会刺激前体破骨细胞分化,活化成熟的破骨细胞,引起骨吸收[14]。OPG通过阻碍RANKL与RANK的结合抑制破骨细胞的形成[15]。在多种微环境条件下,由于OPG对RANKL的竞争结合能力比RANK更强,可以结合或中和可溶性RANKL以及与基质细胞/成骨细胞结合的RANKL,通过该机制阻断RANKL与破骨谱系细胞(破骨前体细胞和破骨细胞)表面的RANK结合,从而抑制骨吸收[16,17]。因此OPG和RANKL是骨代谢的最终效应因子。OPG/ RANKL/RANK在骨重建过程中偶联了骨形成和骨吸收的调节系统,组成了破骨细胞的三角调控系统,同时它们也是破骨细胞分化、活化、成熟及凋亡过程中的关键调节因子[18]。其中,RANKL和OPG的比值是控制骨重建的关键因素[18~20]。
维持骨代谢的动态平衡需要成骨细胞和破骨细胞的相互作用,许多激素和细胞因子共同组成复杂的网络系统参与此动态过程的调控。LPS、维生素D3和一些促炎性细胞因子,都可通过上调RANKL的表达和下调OPG的表达使得破骨细胞增多[21]。
本研究结果显示:大鼠成骨细胞基础表达较强OPGmRNA和少量RANKLmRNA,LPS刺激大鼠成骨细胞时,其表达RANKLmRNA的能力均比未受刺激的细胞增强,与Kikuch等[22~25]的结果一致。我们发现随着LPS作用时间的延长,RANKLmRNA的表达逐渐增加,到24 h达到最高峰,到48 h降至初始状态,由于LPS刺激6 h成骨细胞表达RANKLmNRA能力明显改变,表明LPS的刺激作用可能是直接刺激细胞的结果,而不是成骨细胞分泌的其他细胞因子的间接作用;LPS对于大鼠成骨细胞OPGmRNA的表达无明显作用,说明LPS是通过激活牙槽骨中成骨细胞的OPG/RANKL/RANK传导通路,增加了RANKL/OPG比值从而诱导牙槽骨吸收。而用10 μmol/L姜黄素预处理成骨细胞,再用1 μg/mL LPS处理成骨细胞48 h,发现成骨细胞表达RANKLmRNA的能力明显减弱,提示姜黄素抑制了LPS诱导的成骨细胞RANKLmRNA表达升高,但是随着作用时间的增加成骨细胞表达OPGmRNA的能力变化不明显,因此RANKL/OPG比值减小,姜黄素从而抑制了骨吸收,为姜黄素治疗牙周炎和根尖周炎提供理论依据。
参考文献:
[1]Lal B.Effieiency of curcumin in the management of chronic anterioruveitis[J].Phytother Res,1999,13(4):318-323.
[2]Dorai T,Cao YC,Dorai B,et al.Theapeutic potential of curcumin in human prostate cancer.Ⅲ.Curcumin inhibits proliferation,induces apoptosis and inhibits angiogenesis of LNCaP prostate cancer cells in vitro[J].Prostate,2001,47(4):293-303.
[3]Gururaj AE,Belakavadi M,Venkatesh DA,et al.Molecular mechanisms of antiangiogenic effect of curcumin[J].Biochem Biophys Res Commun,2002,297(4):934-942.
[4]Guimarães MR,de Aquino SG,Coimbra LS,et al.Curcumin modulates the immune response associated with LPS-induced periodontal disease in rats[J].Innate Immun,2012,18(1):155-163.
[5]Ben P,Liu J,Lu C,et al.Curcumin promotes degradation of inducible nitric oxide synthase and suppresses its enzyme activity in RAW 264.7 cells[J].Int Immunopharmacol,2011,11(2):179-186.
[6]Zhao C,Cai Y,He X,et al.Synthesis and anti-inflammatory evaluation of novel mono-carbonyl analogues of curcumin in LPS-stimulated RAW 264.7 macrophages[J].Eur J Med Chem,2010,45(12):5773-5780.
[7]Song WB,Wang YY,Meng FS,et al.Curcumin protects intestinal mucosal barrier function of rat enteritis via activation of MKP-1 and attenuation of p38 and NF-κB activation[J].PLoS One,2010,5(9):e12969.
[8]Shah VO,Ferguson JE,Hunsaker LA,et al.Natural products inhibit LPS-induced activation of pro-inflammatory cytokines in peripheral blood mononuclear cells[J].Nat Prod Res,2010,24(12):1177-1188.
[9]Nishida M,Nishiumi S,Mizushina Y,et al.Monoacetylcurcumin strongly regulates inflammatory responses,through inhibition of NF-kappa B activation[J].Int J Mol Med,2010,25(5):761-767.
[10]Zhao C,Yang J,Wang Y,et al.Synthesis of mono-carbonyl analogues of curcumin and their effects on inhibition of cytokine release in LPS-stimulated RAW 264.7 macrophages[J].Bioorg Med Chem,2010,18(7):2388-2393.
[11]Zhang L,Wu C,Zhao S,et al.Demethoxycurcumin,a natural derivative of curcumin attenuates LPS-induced pro-inflammatory responses through down-regulation of intracellular ROS-related MAPK/NF-kappaB signaling pathways in N9 microglia induced by lipopolysaccharide[J].Int Immunopharmacol,2010,10(3):331-338.
[12]Liang G,Zhou H,Wang Y,et al.Inhibition of LPS-induced production of inflammatory factors in the macrophages by mono-carbonyl analogues of curcumin[J].J Cell Mol Med,2009,13(9B):3370-3379.
[13]袁月,哈斯达莱,祝海霆,等.大鼠胎鼠成骨细胞原代培养方法研究[J].中国实用口腔科杂志,2010,3(10):619-621.
[14]Blair JM,Zhou H,Seibel MJ,et al.Mechanisms of disease:roles of OPG,RANKL and RANK in the pathophysiology of skeletal metastasis[J].Nat Chin Pract Oncol,2006,3(1):41-49.
[15]Hsu H,Lacey DL,Dunstan CR,et al.Tumor necrosis factor receptor family member RANK mediates osteoclast differentiation and activation induced by osteoprotegerin ligand[J].Proc Natl Acad Sci USA,1999,96(7):3540-3545.
[16]Kong YY,Yoshida H,Sarosi I,et al.OPGL is a key regulator of osteoclastogenesis,lymphocyte development and lymph-node organogenesis[J].Nature,1999,397(6717):315-323.
[17]Kong YY,Feige U,Sarosi I,et al.Activated T cells regulate bone loss and joint destruction in adjuvant arthritis through osteoprotegerin ligand[J].Nature,1999,402(6759):304-309.
[18]伍贤平,廖二元.破骨细胞及其调节机制的某些进展[J].中华内分泌代谢杂志,2002,18(2):157-160.
[19]Kostenuik PJ.Osteoprotegerin and RANKL regulate bone resorption,density,geometry and strength[J].Curr Opin Phannaeol,2005,5(6):618-625.
[20]Kiechl S,Werner P,Knoflach M,et al.The osteoprotegerin/RANK/ RANKL system:a bone key to vascular disease[J].Expert Rev Cardiovasc Ther,2006,4(6):801-811.
[21]Lorenzo J,Horowitz M,Choi Y.Osteoimmunology:interactions of the bone and immune system[J].Endocr Rev,2008,29(4):403-440.
[22]Kikuchi T,Matsuguchi T,Tsuboi N,et al.Gene expresson of osteoclast differentiation factor is induced by lipopolysaccharide in mouse osteoblasts via Toll-like receptors[J].Immunol,2001,166(5):3574-3579.
[23]Wada Y,Mizuno M,Tamura M.Enamel matrix derivative neutralized the effect of lipopolysaccharide on osteoprotegerin and receptor activator of nuclear factor kappa B ligand expression of osteoblasts[J].Arch Oral Biol,2009,54(4):306-312.
[24]Fujita S,Kikuchi T,Sobue T,et al.Lipopolysaccharide-mediated enhancement of bone metabolism in estrogen-deficient mice[J].J Periodontol,2008,79(11):2173-2181.
[25]Kikuchi T,Yoshikai Y,Miyoshi J,et al.Cot/Tpl2 is essential for RANKL induction by lipid A in osteoblasts[J].Dent Res,2003,82(7):546-550.
(编辑 陈姜)
EffectofCurcumin on Bone Resorption Stimulated by Lipopolysaccharide in Osteoblasts
WANGXue-mei1,SHANGDe-hao2,PANYa-ping3
(1.Departments ofEndodentics,CenterExperimentalDepartment,SchoolofStomatology,China MedicalUniversity,Institution ofOralMedicine ofLiaoning,Shenyang 110002,China;2.Center of Implantology,School of Stomatology,China Medical University,Shenyang 110002,China;3.Periodontics,School of Stomatology,China MedicalUniversity,Shenyang 110002,China)
ObjectiveTo investigate the effect of curcumin on the expression of osteoprotegerin(OPG)and receptor activator of nuclear factor-κB ligand(RANKL)mRNA stimulated by lipopolysaccharide(LPS)in osteoblasts by reverse transcription-polymerase chain reaction(RT-PCR).MethodsOsteoblasts with/without10μmol/L curcumin precondition were treated with 1μg/mLLPS for6,12,18,24,48 h.RT-PCR was employed to detect the mRNA expression ofOPGandRANKL.ResultsAtime dependentincrease inRANKLmRNA expression was observed in 24 h when cells were treated with 1 μg/mL LPS.The level ofRANKLmRNA began to decrease after 24 h.The expression ofRANKLmRNA in osteoblasts was similaras thatin untreated controlsat48 h.Before exposure to LPS,osteoblasts were pretreated with 10μmol/Lcurcumin,the expression ofRANKLmRNA decreased significantly and exhibited no time dependent relationship,the level ofRANKLmRNA slightly changed.The level ofOPGmRNA slightly changed when osteoblasts either treated with 1 μg/mL LPS or 10 μmol/L curcumin preconditioned until 48 h.ConclusionCurcumin suppressed bone resorption by downregulate the expression ofRANKLmRNAinduced by LPS in osteoblastsand had no effecton thatofOPGmRNA.
curcumin;lipopolysaccharide;osteoprotegerin;receptor activator of nuclear factor-κB ligand
R783
A
0258-4646(2014)11-0982-04
辽宁省科技计划项目(2013225090)
王雪梅(1976-),女,主治医师,博士. E-mail:wangxuemeisdh@hotmail.com
2014-09-09
网络出版时间:
猜你喜欢
——陈谅教授生平简介
