激素诱导斜带石斑鱼(Epinephelus coioides)雄性化的研究*
2014-03-19杨宪宽李水生赵会宏张海发林浩然
黄 文 杨宪宽 徐 新 肖 玲 李水生 赵会宏 张海发 张 勇① 林浩然,
(1. 中山大学水生经济动物研究所暨广东省水生经济动物良种繁育重点实验室 广州 510275; 2. 华南农业大学动物科学学院广州 510642; 3. 广东省海洋渔业试验中心 惠州 516081; 4. 海南大学海洋学院 海口 570228)
石斑鱼是我国重要的海水养殖鱼类, 属鲈形目(Perciformes)、科(Serranidae)、石斑鱼亚科(Epinephelinae)。石斑鱼肉质鲜美, 营养丰富, 为餐桌中的上等佳肴,深受各地消费者的喜爱, 在热带和亚热带地区的沿海渔业中占有重要地位(Pierreet al, 2008)。
我国大陆石斑鱼人工养殖兴起于20世纪80年代(马荣和等, 1987)。随后, 我国学者围绕石斑鱼人工繁育进行研究, 在亲鱼培育和产卵、苗种培育技术以及石斑鱼的病害防治技术等方面取得突破, 促进了石斑鱼养殖产业的社会化分工, 在我国南方形成了石斑鱼苗种繁育和健康养殖产业(刘付永忠等, 2000; 陈国华等, 2001)。
由于石斑鱼是典型的雌雄同体、雌性先熟种类,高龄鱼才性转变为雄鱼。这种状况造成了在人工繁育中往往存在雄鱼缺乏或雌雄不同步的现象, 严重制约了石斑鱼人工繁育工作的开展。在自然海域, 雌性斜带石斑鱼(Epinephelus coioides)的初次性成熟年龄为3—4龄, 人工培育条件下可提前至2.5龄, 其发生性转变的年龄至少在4龄以上(赵会宏等, 2003)。已有研究表明, 应用外源激素可以诱导石斑鱼雌鱼提早发生性转变为雄鱼, 能够满足繁殖的需要(方永强等, 1992; 邹记兴等, 2000)。石斑鱼性别控制技术的研究与推广应用, 将为石斑鱼类种苗的稳定大批量生产提供技术保证。
有些鱼类如罗非鱼(Oreochromis)和异育银鲫(Allogynogenetic crucian carp,Carassius auratus gibelio)等, 在发育早期经一定剂量的雄激素处理后就能产生出功能性的雄鱼(张甫英等, 2000; 王扬才等,2003)。石斑鱼是典型的雌雄同体鱼类, 其性腺中同时存在雌性和雄性生殖细胞, 如果受到雄激素的刺激,性腺就有可能朝着雄性化的方向发育。因此, 本文作者在研究斜带石斑鱼性腺发育过程的基础上, 在性腺发育早期投喂甲基睾酮(MT)激素, 以诱导石斑鱼幼鱼雄性化。
1 材料与方法
1.1 样品
斜带石斑鱼均养殖于广东省海洋渔业试验中心,分别选取3、6、9、12、18、24、30、36月龄的石斑鱼, 解剖后取性腺, 用Bouin’s液固定。选取8月龄斜带石斑鱼幼鱼用于雄激素诱导性分化实验, 设1个对照组, 2个实验组, 每组2个网箱, 分别养殖在6个网箱中(网箱大小: 1.5m×1.5m×1.5m), 每个网箱100尾, 共600尾鱼, 在自然水温(26—30°C) 条件下, 流水饲养到6个月。实验重复1次。
1.2 方法和处理
1.2.1 不同年龄阶段石斑鱼性腺发育状况 对不同年龄阶段的斜带石斑鱼性腺, 经石蜡切片, H.E染色, 观察和拍照, 确定斜带石斑鱼性腺分化和发育时期。
1.2.2 雄激素诱导性别分化 对实验组的斜带石斑鱼幼鱼, 投喂含有10mg/kg MT激素的配合饲料,诱导其往雄性方向发展; 对照组投喂正常饲料。喂料频率为每天1次。利用鱼肝油溶解MT激素, 与饲料搅拌均匀, 鱼肝油与饲料的比例为: 10mL鱼肝油比100g饲料, 搅拌后置于空气中晾干30min再投喂。
每月对实验组和对照组分别取8尾斜带石斑鱼,解剖后取性腺用Bouin’s液固定, 石蜡切片, H.E染色,拍照观察性腺分化和发育情况。
1.2.3 中断雄激素投喂后石斑鱼性腺发育状况雄激素投喂3个月后, 一个实验组继续投喂含MT激素的配合饲料, 为持续投喂组; 另一组中断MT激素投喂, 改为正常饲料投喂, 为中断投喂组; 对照组照常喂养。喂料频率不变, 养殖方法不变。比较持续投喂组、中断投喂组、对照组石斑鱼性腺的发育状况。
2 结果与分析
2.1 人工养殖条件下斜带石斑鱼性腺发育过程
斜带石斑鱼在人工养殖条件下不同年龄阶段的性腺发育过程如图1所示(时期划分参照Chenet al,2011): 3月龄石斑鱼幼鱼性腺处于性原基形成时期,为未分化时期; 6月龄石斑鱼幼鱼性腺处于卵巢腔形成时期, 性腺已向雌性分化; 9月龄石斑鱼幼鱼性腺中形成大量的性原细胞, 卵巢腔已经形成, 还没有开始发育, 尚未发现卵母细胞; 12月龄石斑鱼性腺中开始形成初级卵母细胞(primary-growth stage oocyte,O1), 卵巢开始发育; 18月龄石斑鱼性腺中出现大量的O1期卵母细胞, 但还未出现皮层小泡, 处在初级卵母细胞生长期; 24月龄石斑鱼性腺的卵母细胞体积增大, 处于皮层小泡生成时期(cortical-alveolus stage oocyte, O2); 30月龄石斑鱼性腺仍处于O2期, 卵母细胞中皮层小泡明显增多, 但还未出现卵黄囊; 36月龄石斑鱼处于卵母细胞卵黄形成时期(vitellogenic stage oocyte, O3), 卵母细胞中存在大量的卵黄囊, 此时斜带石斑鱼已经发育成熟。
2.2 MT激素诱导斜带石斑鱼性腺发育过程
对8月龄斜带石斑鱼幼鱼投喂MT激素后, 其性腺发育如图2, 详细过程: 实验开始阶段, 对照组和实验组斜带石斑鱼幼鱼性腺细胞均为性原细胞, 石斑鱼幼鱼卵巢还未发育, 如图2(A0)和图2(B0)所示;投喂1个月后, 对照组性腺细胞所处时期不变, 仍为性原未分化细胞, 石斑鱼卵巢还处在未发育状态[图2(A1)]; 实验组石斑鱼幼鱼开始往雄性方向发育, 性腺切片中观察到育精囊, 育精囊(SG)中有精原细胞(Sg)和初级精母细胞(PSc)出现, 如图2(B1); 投喂2个月后, 对照组性腺细胞仍为性原细胞, 表明石斑鱼卵巢发育还未启动[图2(A2)]; 实验组石斑鱼继续往雄性方向发育, 性腺中开始出现了次级精母细胞(SSc),如图2(B2); 投喂3个月后, 对照组性腺切片中开始出现了O1期细胞, 说明正常情况下斜带石斑鱼在11—12月龄左右, 卵巢发育开始启动, 性腺往雌性方向发展; 相比之下, 实验组石斑鱼精巢继续发育[图2(B3)],性腺出现了精细胞(St), 甚至有少量的精子出现(Sz),可以确定斜带石斑鱼幼鱼在MT激素的诱导下已经转变为功能性雄鱼[图2(B3)]。
2.3 中断投喂MT激素后的斜带石斑鱼性腺发育过程
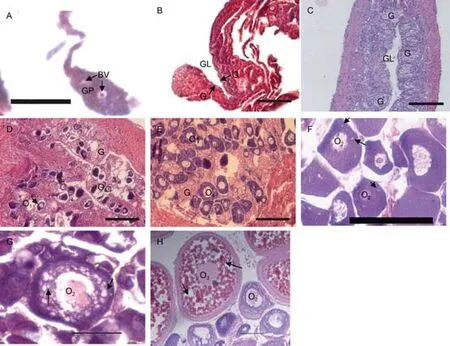
图1 斜带石斑鱼性腺发育过程切片图Fig.1 Gonad development sections of E. coioides
发现石斑鱼幼鱼转化成雄性后, 对一个实验组停止投喂含MT的配合饲料, 另一个实验组持续投喂含MT的配合饲料, 跟踪观察性腺发育状况, 见图3。结果发现: 中断投喂1个月后, 对照组性腺与上个月相比, 没有明显的变化[图3(A4)]; 持续投喂组性腺继续往雄性方向发展, 性腺中精子的数量开始增多[图3(B4)];中断投喂组性腺的雄性特征变得不明显, 表现在性原细胞的比例显著增大, 雄性相关的细胞数量大幅减少, 没有发现有Sz的出现[图3(C1)]; 中断投喂2个月后, 对照组与上个月相比, 性腺中O1期卵母细胞数量有增多的趋势, 表明斜带石斑鱼已向雌性卵巢发育[图3(A5)]; 持续投喂组性腺继续往雄性方向发展, 性腺精巢腔隙中出现大量的精子[图3(B5)]; 而中断投喂组性腺雄性特征持续退化, 性腺中St不再出现, SSc细胞在性腺中所占的比例比上个月更低,性腺中性原细胞占大部分比例[图3(C2)]; 中断投喂3个月后, 对照组与上个月相比, 性腺中O1期卵母细胞开始大量出现, 斜带石斑鱼雌性特征明显[图3(A6)]; 持续投喂组性腺雄性特征更加明显, 性腺精巢腔隙中出现的精子密度更加浓密[图3(B6)]; 中断投喂组性腺则全部退化为性原细胞时期[图3(C3)]。
3 讨论
石斑鱼属于雌雄同体雌性先熟的种类, 对多种石斑鱼类的染色体核型分析均未发现异型染色体(王世峰, 2007), 表明石斑鱼的染色体遗传无差异, 如Chan等(1981)的观点: 动物中存在由环境影响及具有遗传无差异特性的性别决定方式。本研究的斜带石斑鱼均养殖于广东省海洋渔业试验中心的循环水养殖系统中, 石斑鱼幼鱼卵巢腔形成于6—9月龄之间,之后卵巢开始发育, 以卵巢腔形成为石斑鱼性别分化为雌性的标志(Ryosukeet al, 2012)。硬骨鱼类的性别分化(性别决定或遗传意义上的分化)一般在胚后发育的较早时期发生, 例如, 鲤科鱼类在孵化后的4—6周性腺就开始分化, 此时就要开始投喂激素; 如果太晚投喂, 就有可能性逆转效果很差, 或达不到永久性逆转的效果(张甫英等, 2000; 岳敏娟等, 2009)。石斑鱼是雌雄同体雌性先成熟鱼类, 前人对石斑鱼的性逆转诱导在雌鱼卵巢发育之后, 均能成功诱导成为雄性。如方永强等(1992)经过连续投喂含有MT的饵料, 成功的诱导2龄及以上的赤点石斑鱼发生性逆转; 邹记兴等(2000)采用埋植混合激素药条的方法诱导3龄以上巨石斑鱼提早性逆转; 作者早期的研究表明投喂含有MT和ADSD的饵料, 均可诱导2龄斜带石斑鱼提前发生性转化, MT可诱导实验鱼产生精液, ADSD可诱导实验鱼到雌雄同体阶段(赵会宏,2003)。众多激素处理均能成功诱导石斑鱼性别转变,表明石斑鱼的性别决定属类固醇激素依赖型, 即雄性类固醇激素达到一定量时, 抑制或关闭了雌性相关基因的表达, 而启动了雄性相关基因, 导致一系列生理变化, 促进卵巢退化和吸收、性腺组织结构的重组, 以及雄性配子细胞的增殖(桂建芳, 2007)。
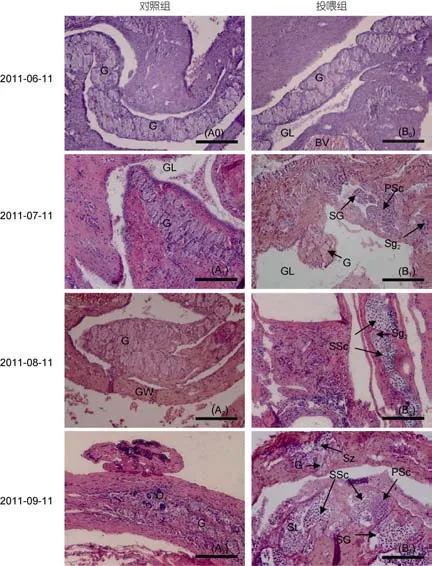
图2 投喂MT激素诱导斜带石斑鱼幼鱼转雄性腺切片图Fig.2 Gonad sections of juvenile E. coioides sex-change to male by MT food
作者在石斑鱼性别分化为卵巢发育之前, 选取斜带石斑鱼幼鱼进行雄激素诱导, 以诱导其性别往雄性方向发展。由于斜带石斑鱼幼鱼驯料时间较长,而6月龄的幼鱼配合饲料进食不够均匀, 个体差异较大。因此作者选取8月龄的斜带石斑鱼幼鱼进行投喂实验, 以期获得比较均一的结果。本研究中, 斜带石斑鱼幼鱼在8月龄的时候卵巢还未开始发育; 投喂激素一个月后, 性腺开始往雄性方向发展, 性腺中出现了雄性的生殖细胞; 保持相同的激素量, 在连续投喂三个月后, 石斑鱼性腺中开始出现精子, 在雄激素的持续作用下, 性腺中雄性生殖细胞也持续地往后期发展, 最后精子的出现证明石斑鱼已经发育成为雄鱼。相似的投喂诱导效果还见于东大西洋石斑鱼(Glamuzinaet al, 1998)、青铜石斑鱼(Hasssinet al,1997)、七带石斑鱼(Tanakaet al, 1999)、蜂巢石斑鱼(Kobayashiet al, 1999)等的研究。
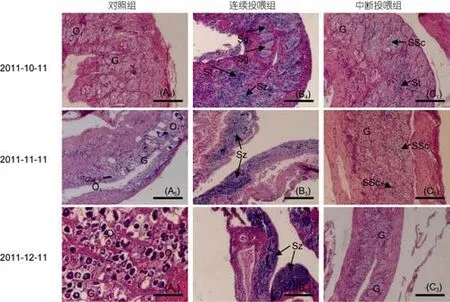
图3 中断MT激素投喂后各实验组性腺切片图Fig.3 Gonad sections of E. coioides while stopping MT food
中断激素投喂后, 雄性斜带石斑鱼性腺发生退化, 斜带石斑鱼幼鱼性腺中本来存在的精子、精细胞等退化消失了, 出现更为原始的精母细胞; 三个月后,性腺中不再存在雄性的细胞结构, 都退化为性原细胞, 呈现出未分化的状态。表明没有了外源雄激素的刺激, 斜带石斑鱼幼鱼不能继续往雄性方向发育。外源雄激素诱导鱼类性逆转的机制研究发现: 17α-MT主要是通过直接作用于性腺或者影响与性腺发育有关的生理过程起作用的(Leeet al, 1995; Kitanoet al, 2000; 李广丽等, 2006)。本文中, 石斑鱼幼鱼虽然被诱导往雄性方向发展, 却不能启动石斑鱼自身的雄性发育机制, 这种外源性的雄激素一旦消失,石斑鱼幼鱼就按照自身遗传基因控制的方向朝雌性发育。
综合前人的研究结果, 作者认为雌雄同体鱼类的性别决定过程可分为生殖腺分化时的初级性别决定和分化后完成生殖腺发育时(雌或雄)的次级性别决定。雌雄同体鱼类的初级性别决定调控与其他鱼类高度相似, 受遗传因子的调控; 但次级性别决定过程则受到年龄、体型和社会因子的影响。Fishelson(1970)对长棘花鳍(Anthias squamipinnis)的研究发现, 雄鱼的存在与否会影响雌性的性转变过程。Liu等 (2004)对黑鲙(Cephalopholis boenak)的研究认为: 体型小的雌鱼比体型大的雌鱼更容易发生性转变。石斑鱼是典型的雌雄同体雌性先熟的鱼类, 初级性别决定其在早期性分化为雌性, 如不受外源激素影响, 正常发育为雌鱼。卵巢未发育的雌鱼经雄激素诱导性转变为雄性, 停止药物处理后会再度性转变为雌性, 表明石斑鱼次级性别决定可能受到时间轴因子和社会因子的强烈影响。Chan等(1981)认为, “社会学因素”主要是通过神经内分泌途径来沟通外部刺激与性转变的,有关石斑鱼性转变的整个过程可能涉及到中枢神经系统、下丘脑—垂体—性腺轴等内分泌器官的一系列变化。
马荣和, 李加尔, 周宏团等, 1987. 赤点石斑鱼人工育苗的初步研究. 海洋渔业, (4): 158—160
王世峰, 2007. 六种石斑鱼核型特征比较和染色体进化研究.厦门: 厦门大学博士学位论文, 1—116
王扬才, 陆开宏, 2003. 罗非鱼的性别决定与控制. 水产科技,(3): 17—20
方永强, 林秋明, 齐 襄等, 1992. 17α-甲基睾酮对赤点石斑鱼性逆转的影响. 水产学报, 16(2): 171—174
刘付永忠, 王云新, 黄国光等, 2000. 斜带石斑鱼亲鱼强化培育及自然产卵研究. 中山大学学报, 39(6): 81—85
李广丽, 刘晓春, 林浩然, 2006. 17α-甲基睾酮对赤点石斑鱼性逆转的影响. 水产学报, 30(2): 145—150
邹记兴, 胡超群, 黄增岳等, 2000. 外援混合激素诱导巨石斑鱼性逆转的研究. 高技术通讯, 1: 5—9
张甫英, 胡 炜, 汪亚平等, 2000. 应用雄性激素诱导异育银鲫性转化的研究. 遗传, 22(1): 25—27
陈国华, 张 本, 2001. 点带石斑鱼亲鱼培育、产卵和孵化的试验研究. 海洋与湖沼, 32(4): 428—435
岳敏娟, 尤永隆, 林丹军, 2009. 温度对鲫鱼性腺分化的影响.动物学杂志, 44(1): 9—16
赵会宏, 2003. 斜带石斑鱼性腺发育和性别转变的神经内分泌研究. 广州: 中山大学博士学位论文, 1—100
赵会宏, 刘晓春, 刘付永忠等, 2003. 斜带石斑鱼雌鱼卵巢发育与血清类固醇激素的生殖周期变化. 中山大学学报,42(6): 56—63
桂建芳, 2007. 鱼类性别和生殖的遗传基础及其人工控制. 北京: 科学出版社, 1—247
Chan S T H, O Wai-sum, 1981. Environmental and Non-genetic Mechanisms in Sex Determination. In: Austin C R, Edwards R G ed. Mechanisms of Sex Differentiation in Animal and Man. New York: Academic Press, 55—111
Chen Huapu, Zhang Yong, Li Shuishenget al, 2011. Molecular cloning, characterization and expression profiles of three estrogen receptors in protogynous hermaphroditic orange-spotted grouper (Epinephelus coioides). General and Comparative Endocrinology, 172: 371—381
Fishelson L, 1970. Protogynous sex reversal in the fishAnthias squamipinnis(Teleostei, Anthiidae) regulated by the presence or absence of a male fish. Nature, 227: 90
Glamuzina B, Glavić N, Skaramuca Bet al, 1998. Induced sex reversal of dusky grouper,Epinephelus marginatus(Lowe).Aquaculture Research, 29: 563—567
Hasssin S, Monbrison D, Hanin Yet al, 1997. Domestication of the white grouper,Epinephelus aneus. 1. Growth and reproduction. Aquaculture, 156: 305—316
Kitano T, Takamune K, Nagahama Yet al, 2000. Aromatase inhibitor and 17α-methyltestosterone cause sex-reversal from genetical females to phenotypic males and suppression of P450 aromatase gene expression in Japanese flounder(Paralichthys olivaceus). Molecular Reproduction and Development, 56: 1—5
Kobayashi Y, Lee Y D, Takemura Aet al, 1999. Histological Observation of Sex Change in Honey Comb Grouper,Epinephelus merra. In: Proceeding of the 6thInternational Symposium on the Reproductive Physiology of Fish. Bergen,Norway, 269—267
Lee S T L, Kime D E, Chao T Met al, 1995. In vitro metabolism of testosterone by gonads of grouper (Epinephelus tauvina)before and after sex inversion with 17α-methyltestosterone.General and Comparative Endocrinology, 99: 41—49
Liu M, Sadovy Y, 2004. The influence of social factors on adult sex change and juvenile sexual differentiation in a diandric,protogynous epinepheline,Cephalopholis boenak(Pisces,Serranidae). The Zoological Society of London, 264: 239—248
Pierre Stéphanie, Gaillard Sandrine, Prévot-D'Alvise Nathalieet al, 2008. Grouper aquaculture: Asian success and Mediterranean trials. Aquatic Conservation: Marine and Freshwater Ecosystems, 18: 297—308
Ryosuke Murata, Yasuhisa Kobayashi, Hirofumi Karimataet al,2012. The role of pituitary gonadotropins in gonadal sex differentiation in the protogynous Malabar grouper,Epinephelus malabaricus. General and Comparative Endocrinology, 178(3): 587—592
Tanaka H, Tsuchihashi Y, Kuromiya Y, 1999. Induction of Sex Reversal in the Sevenband Grouper,Epinephelus septemfasciatus. In: Proceeding of the 6thInternational Symposium on the Reproductive Physiology of Fish. Bergen,Norway, 423
