利用分光光度法间接测定海水中的羟胺*
2014-03-19卢光远宋秀贤俞志明
卢光远 宋秀贤 俞志明
(1. 中国科学院海洋研究所 海洋生态与环境科学重点实验室 青岛 266071; 2. 中国科学院大学 北京 100049)
氮是海洋生态系统中重要的生源要素, 含氮化合物在微生物酶的作用下发生着多种生物地球化学过程(Brandeset al, 2007)。以往的研究者常关注于海水中以及CO(NH2)2含量的测定, 对微量还原性羟胺等含氮化合物关注不足。羟胺作为硝酸盐异化反硝化、厌氧氨氧化和铵盐第一步硝化作用的中间产物在氮的生物地球化学循环中扮演着重要角色(胡安辉等, 2010; Vajralaet al, 2013),同时在生物代谢中羟胺作为还原态化合物成为氢的供体(史云峰等, 2007; Brandeset al, 2007)。羟胺具有较强的还原性, 且没有显色剂直接与羟胺基团形成具有一定特征显色的物质(肖松涛等, 2008), 因此间接测定便成为一种可行之策。目前, 测定羟胺的方法主要有碘量滴定法、电化学法、光度法、色谱法等(杨明, 1999; 詹国庆等, 2004; Seikeet al, 2004; 孙桂进等, 2006; 李京雄等, 2013; Vajralaet al, 2013), 以上方法均因操作繁琐、显色时间长、显色不稳定、仪器昂贵等问题未能得到广泛应用。盐酸羟胺作为还原剂常被用于土壤间隙水、海水、污水等水体中铁含量的测定(冯媛媛等, 2004; 郝新焕, 2006; 迟光宇等, 2008); 而硫酸铁铵-邻菲罗啉法已被用于土壤中羟胺还原酶活性的测定(史云峰等, 2007), 且该法已被证实在复杂体系中具有较高的准确度和精密度(杨明, 1999; 史云峰等, 2007), 而在海水中未见羟胺测定的应用报道。基于此, 本文应用硫酸铁铵-邻菲罗啉法测定羟胺还原等量三价铁离子浓度的原理间接获得海水中的微量羟胺含量, 对该方法的适用性进行了系统检验评价, 并测定了天然海水培养东海原甲藻(Prorocentrum donghaiense)藻液中羟胺的含量。
1 材料与方法
1.1 仪器与试剂
仪器: T6型新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司)。
试剂: 1.0523g盐酸羟胺定容至500mL, 配制成浓度为1000mg/L羟胺标准储备液, 于4°C冷藏, 使用前临时配制10mg/L的标准使用液。缓冲溶液选取pH值为4.5左右的乙酸钠-乙酸缓冲溶液(1mol/L+1mol/L), 氧化剂为硫酸铁铵(4.0mmol/L), 显色剂为邻菲罗啉-乙醇溶液(0.01mol/L)(史云峰等, 2007)。灭菌天然海水(取自汇泉湾, 121°C高温灭菌20min), 东海原甲藻藻液及0.45μm混合纤维膜过滤液备用。
1.2 实验设计
1.2.1 实验原理 弱酸性条件下, 羟胺能将Fe3+还原为Fe2+(公式1), Fe2+与邻菲罗啉(简称phen)生成橙红色配位化合物(公式2), 此络合物较为稳定(杨明,1999)。可见光谱510nm处具有较强的吸收峰, 通过测定络合物吸光值获得Fe2+浓度(杨明, 1999), 扣除本底中Fe2+浓度后间接获得微量羟胺浓度。

1.2.2 工作曲线 分别取10mg/L羟胺标准使用液0.20、0.50、1.00、2.00、4.00、6.00、8.00mL于100mL容量瓶中, 配制成浓度梯度依次为0.020、0.050、0.100、0.200、0.400、0.600、0.800mg/L的溶液, 取2.5mL至1cm比色皿中, 分别依次加入乙酸钠-乙酸缓冲溶液、硫酸铁铵溶液和邻菲罗啉-乙醇溶液各0.1mL, 混合摇匀显橙红色, 30min后在510nm、温度20oC下测定其吸光值, 每组设四重样(史云峰等,2007), 用超纯水作参比, 所有数据均为扣除空白值。
1.2.3 加标回收实验 取灭菌天然海水2.5mL分别添加0.02、0.10、0.20mL羟胺标准使用液, 每组设四重样, 以灭菌天然海水作为空白参比, 其他条件同上, 最后浓度计算时需进行体积校准。
1.2.4 稳定性实验 取灭菌天然海水2.5mL分别添加0、0.10mL羟胺标准使用液, 摇匀显色后分别在10、30、60、120、180、1080、1440min进行测定, 每组设四重样。
1.2.5 藻液实验 分别取已破碎藻液及0.45μm膜过滤藻液2.5mL进行以上测定, 每组设四重样。
1.3 实验检测方法的评价
对间接测定方法进行准确度、检测限和方法重复性评价(曹雁平等, 2012)。利用标准偏差、变异系数等参数评价方法的精准度。在进行两组或多组数据变异程度比较时, 因为平均值不同, 比较其变异程度不能采用标准偏差, 而要对相对值进行比较, 即变异系数比较, 又称相对标准偏差。
方法检测限评价: 通常以3倍标准偏差与检出限附近校正曲线斜率k的商计算检出限, 即它表示被测组分浓度改变一个单位时分析信号的变化量, 即灵敏度。
方法重复性评价采用临界极差法。针对多个测试结果(n≥2)时, 将结果极差(测量结果最大值与最小值之差)与临界极差CrR0.95(n)进行比较,CrR0.95(n)=f(n)Sr, 对于四次平行检测, 由中华人民共和国国家标准GB/T 11792-89中(国家技术监督局, 1989)临界极差系数f(n)表查得f(4)=3.6, 任一实验结果最大浓度与最小浓度极差小于或等于临界极差, 则认为检测方法的重复性较好(李慎安, 2006; 吴孟浩, 2012)。
2 结果与分析
2.1 羟胺工作曲线
实验结果表明, 该分光光度间接测定法在羟胺浓度为0.020—0.800mg/L范围内, 其浓度与吸光值具有显著的线性相关性(y=0.2696x+0.003,R2=0.9996,P<0.0001,n=32, 图1)。即使放置24h后吸光值有所升高, 但羟胺浓度与吸光值依然保持显著的线性相关性(y=0.3256x+0.0082,R2=0.9951,P<0.0001,n=32),说明该方法显色在24h内具有较好的线性稳定性。显色30min后吸光值测量相对标准偏差为0.70%—5.13%, 平均相对标准偏差为2.65%; 测量浓度与设定浓度间的相对误差为-2.63%—5.71%, 平均相对误差为1.30%(表1)。
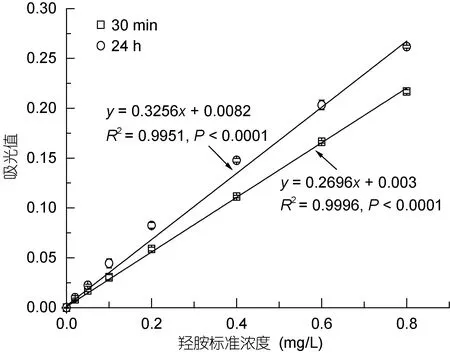
图1 羟胺溶液工作曲线Fig.1 The working curve of hydroxylamine
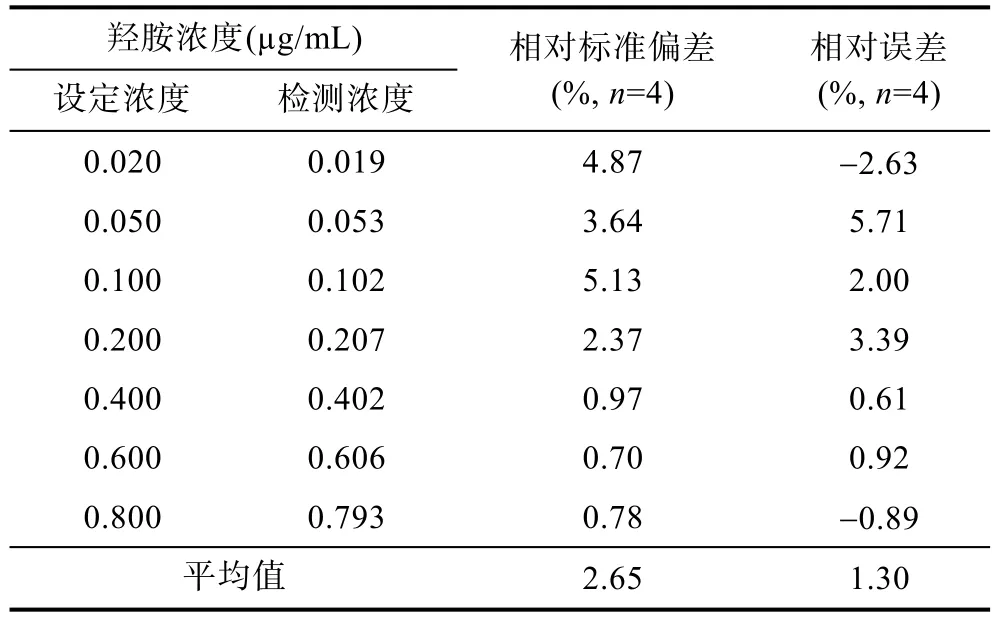
表1 羟胺标准溶液测定的准确性Tab.1 The accuracy of hydroxylamine in standard solution
2.2 海水加标回收试验
为了解缓冲体系是否适合海水样品, 分别将海水与缓冲液(乙酸钠-乙酸)按照50︰1、33.3︰1、25︰1、20︰1、12.5︰1体积比进行混合, 测得其pH值依次为4.55、4.51、4.50、4.49、4.48, 再添加硫酸铁铵后,pH值分别为4.56、4.52、4.50、4.49、4.48。以上结果说明, 在本研究实验条件下该反应体系pH值较为稳定, 适于海水样品测量。利用添加标准羟胺的溶液与灭菌天然海水为空白进行差值比较, 计算添加0.20、1.00、2.00μg羟胺的回收率分别达到105.9%、108.1%、106.8%, 平均回收率达到106.9%, 平均相对标准偏差为1.71%(表2)。该结果表明, 在灭菌天然海水中添加一定浓度羟胺具有较好的重现性和稳定性,说明该方法具有较高的准确度。
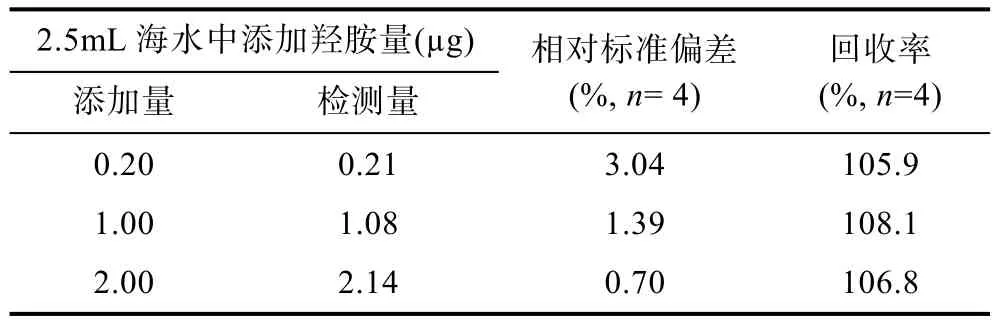
表2 海水中外加羟胺的回收率Tab.2 The recovery of hydroxylamine added in seawater
2.3 反应时间优化及稳定性试验
对比灭菌天然海水稳定性发现, 添加标准羟胺溶液不影响显色时间, 显色均在30—120min保持稳定(P=0.6224>0.05,n=12), 超过120min会出现吸光值升高现象, 差异性显著(P<0.0001,n=24), 这可能是显色物质受到其他微量有色金属的干扰所致, 而在1440min后吸光度出现较大增长(图2)。所以, 选择反应时间在30—120min的稳定期内进行测量。显色干扰在以往研究中时有发生: 如海水铁元素测量中铜、钴、镍等有色络合物离子的共存可能会影响实验后期的显色, 而在溶液中添加10倍于羟胺浓度的硝酸银、亚硝酸银、氯化铵均对溶液吸光度无影响(杨明, 1999;詹国庆等, 2004; 李京雄等, 2013)。但在乙酸钠-乙酸缓冲溶液中, 小于等于10倍铁浓度的铜、锌、钴、铬及小于2mg/L的镍不会干扰铁的测定(郝新焕,2006), 而具有较强还原性的肼可能会对羟胺的测定有一定影响(杨明, 1999; 肖松涛等, 2008)。据此判断本研究间接测定法需在120min显色稳定期内测定完毕, 以避免其他潜在物质的干扰。
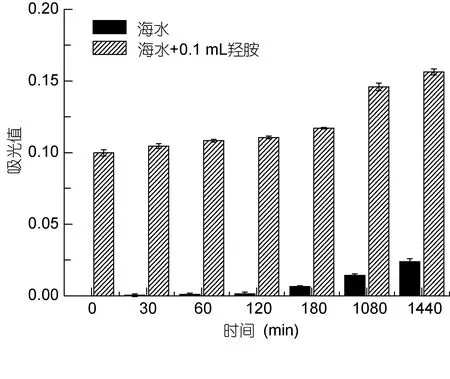
图2 海水及添加羟胺后的反应稳定性Fig.2 The reaction stability of hydroxylamine in seawater
2.4 藻液中羟胺浓度
将破碎后的东海原甲藻原藻液与0.45µm混合纤维膜过滤后的藻液按照上述方法进行羟胺浓度的测定(表3), 发现过滤后藻液中羟胺的浓度约为0.021mg/L, 接近最低检测限, 而破碎藻液中羟胺总含量为0.291mg/L (相对标准偏差RSD=1.60%), 据此推测羟胺主要存在于藻细胞内部, 从而验证了羟胺是在藻细胞内部合成, 是藻细胞利用铵盐转化为有机氮的重要中间体。
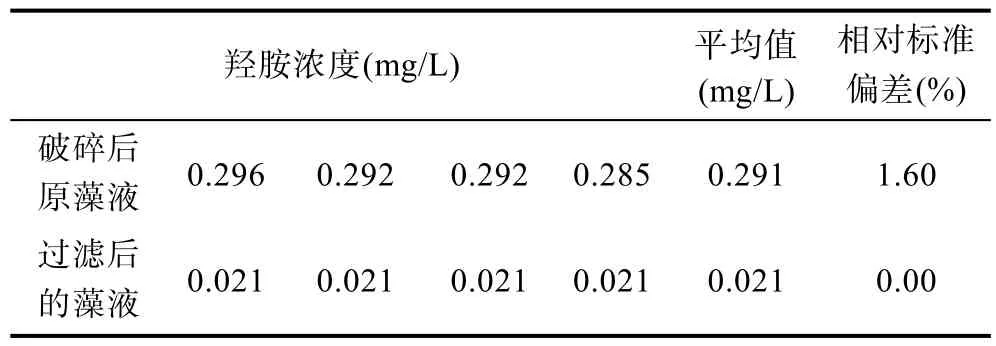
表3 东海原甲藻藻液中羟胺浓度Tab.3 Hydroxylamine concentration in Prorocentrumdonghaiense solution
2.5 海水中羟胺分光光度间接检测方法的评价
利用公式计算该方法的标准偏差、测样浓度极差、变异系数和检出限(李慎安, 2006; 吴孟浩, 2012),结果如表4。其中标准偏差Sr值较低, 由此可确定该方法的精确度较高; 而变异系数CV值偏低反映出该方法在检测低浓度羟胺时其离散性较低; 检出限D最低达0.021mg/L, 相当于0.6μmol/L NH2OH, 说明该方法具有较高的分辨率, 但对于痕量级羟胺测定需进一步优化; 4个实验的4次平行检测的最大浓度与最小浓度极差分别为0.0037、0.0111、0.0148、0.0111mg/L, 均小于各自的重复性临界极差CrR0.95(n)值0.0067、0.0168、0.0231、0.0168mg/L, 说明该方法的重复性很好(曹雁平等, 2012)。
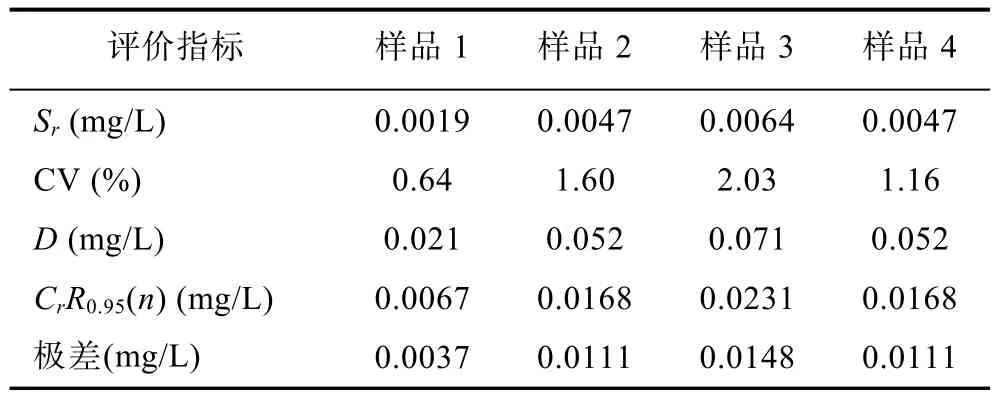
表4 间接分光光度检测羟胺法的评价Tab.4 The evaluating parameters of the indirect hydroxylamine method
本研究只针对同一操作者在不同实验时间和测样条件下进行的重复性检测, 并未针对不同测样人员和仪器进行复现性检测(李慎安, 2006)。该方法适于样品初始pH值在1.5—9.5范围内, 由于测试用样品体积较小, 无法获知盐度、温度等因素对检测限的影响, 对于海水中更低含量羟胺浓度的测定需要进一步优化。同时, 针对不同的测量样品需进行特定空白校准。
3 结论
海洋生态系统中, 羟胺可与多种离子发生氧化还原反应, 同时可与金属发生配位, 在细胞转录中会作为化学诱变剂使碱基对发生改变, 引起基因突变。所以, 研究羟胺的测定方法不仅对获得海洋中羟胺的转化过程至关重要, 更为了解氮的生物地球化学循环提供了物质佐证。本研究结果表明: 硫酸铁铵-邻菲罗啉分光光度间接法可用于测定海水中浓度范围在0.020—0.800mg/L的羟胺, 其平均相对标准偏差为2.65%, 平均相对误差为1.30%, 通过添加标准物发现该方法具有较好的重现性和稳定性, 测定结果准确可信。该方法显色稳定时间在30—120min内无显著差异(P=0.6224>0.05,n=12)。测定东海原甲藻藻液含量验证了羟胺在藻细胞内部合成, 是藻细胞利用铵盐转化为有机氮的重要中间体。通过方法不确定度的系统评价得出该方法精确度较高, 检测时离散性低, 具有较高的分辨率、重复性, 不需要特殊仪器, 且简捷易行。
史云峰, 武志杰, 史 奕等, 2007. 土壤羟胺还原酶活性测定方法的改进. 生态学杂志, 26(7): 1133—1137
冯媛媛, 刘东燕, 张曼平等, 2004. 海水中铁的测定方法. 海洋科学, 28(1): 71—75
孙桂进, 张炳谦, 贾海红等, 2006. Fe(III)-磺基水杨酸体系间接分光光度法测定盐酸羟胺. 淮海工学院学报(自然科学版), 15(3): 44—46
李京雄, 温欣荣, 吴秀萍, 2013. 磷钼酸铵分光光度法测定盐酸羟胺. 分析试验室, 32(3): 86—88
李慎安, 2006. JJ F1059—1999《测量不确定度评定与表示》讨论之四 方法确认的重复性标准差与复现性标准差. 工业计量, 16(2): 35—37
杨 明, 1999. 间接分光光度法测定盐酸羟胺. 化学工业与工程, 16(4): 233—235
肖松涛, 欧阳应根, 2008. 间接分光光度法测定单甲基肼, 二甲基羟胺. 中国核科技报告, (1): 68—72
吴孟浩, 2012. 统计检验在色谱仪器比对中的应用. 环境监测管理与技术, 24(6): 76—78
迟光宇, 张兆伟, 陈 欣等, 2008. 羟胺浸提-可见分光光度法测定土壤无定形铁. 光谱学与光谱分析, 28(12): 2931—2934
国家技术监督局, 1989. 中华人民共和国国家标准GB/T 11792-89测试方法的精密度 在重复性或再现性条件下所得测试结果可接受性的检查和最终测试结果的确定. 北京: 中国标准出版社, 1—7
郝新焕, 2006. 邻菲罗啉分光光度法测定污水中的总铁. 石油化工腐蚀与防护, 23(4): 44—46
胡安辉, 郑 平, 陆慧峰等, 2010. 厌氧氨氧化菌富集培养物对羟胺的转化研究. 微生物学报, 50(4): 485—492
曹雁平, 袁英髦, 朱雨辰, 2012. 低强度超声场中羟自由基分光光度法检测研究. 光谱学与光谱分析, 32(5):1320—1323
詹国庆, 罗登柏, 张永波, 2004. 铜磷钼酸分光光度法间接测定盐酸羟胺. 分析测试学报, 23(5): 128—129, 132
Brandes J A, Devol A H, Deutsch C, 2007. New developments in the marine nitrogen cycle. Chemical Reviews, 107(2):577—589
Seike Y, Fukumori R, Senga Yet al, 2004. A simple and sensitive method for the determination of hydroxylamine in fresh-water samples using hypochlorite followed by gas chromatography. Analytical Sciences, 20: 139—142
Vajrala N, Martens-Habbena W, Sayavedra-Soto Let al, 2013.Hydroxylamine as an intermediate in ammonia oxidation by globally abundant marine archaea. PNAS, 110(3): 1006—1011
