养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响
2014-03-17阳李二超陈立侨龙丽娜崔超杜震宇孙盛明黎
曹 阳李二超陈立侨龙丽娜崔 超杜震宇孙盛明黎 明
(1. 华东师范大学生命科学学院, 上海 200241; 2. 中国水产科学研究院渔业机械仪器研究所, 上海 200092; 3. 中国水产科学研究所淡水渔业研究中心, 无锡 214081; 4. 宁波大学海洋学院, 宁波 315211)
养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响
曹 阳1李二超1陈立侨1龙丽娜2崔 超1杜震宇1孙盛明3黎 明4
(1. 华东师范大学生命科学学院, 上海 200241; 2. 中国水产科学研究院渔业机械仪器研究所, 上海 200092; 3. 中国水产科学研究所淡水渔业研究中心, 无锡 214081; 4. 宁波大学海洋学院, 宁波 315211)
密度是决定养殖鱼类生长速度、产量和效益的主要因素之一。鱼类集约化养殖系统中, 生产者往往尽可能地提高单位水体中的放养密度, 以获得养殖产量和经济效益的最大化[1]。但是, 密度过高除了直接加剧鱼类对空间和饵料的竞争, 导致能量消耗增多和饵料利用率降低外,还会抑制鱼类的正常生长, 甚至造成养殖动物的发病和死亡[2—6]。从代谢的角度来看, 在高密度养殖条件下, 鱼类新陈代谢旺盛, 血液中的皮质醇、血糖和血红蛋白水平也相应升高, 血液携氧能力上升。短期内皮质醇和血糖水平的上升有利于缓解鱼体所遭受的胁迫, 但持续过久会导致机体或组织对氨基酸的利用率下降, 并影响免疫系统的正常功能[7—10]。另有研究发现, 养殖系统中密度过高或过低, 都会在一定程度上抑制鱼类的生长效率, 从而影响产量和经济效益。孙大川等在对宝石鲈(Scortum barcoo)的研究发现, 养殖密度过高或者过低都对该鱼的生长造成一定的负面影响[7]。已有的研究证实, 鱼类种类、规格和养殖条件的不同, 密度胁迫所对其造成的负面影响也不尽相同[11—13]。因此, 探讨特定养殖对象在不同密度下的生长性能和生理反应, 对于确定该养殖对象的适宜密度是十分必要的。
俄罗斯鲟(Acipenser gueldenstaedtii), 俗称金龙王鲟,是一种营底栖生活的冷水性鱼类。该鱼体型大、生长快、繁殖能力强, 对不良环境具有较高的耐受性, 并且肉质鲜美, 用鲟鱼卵所制成的鱼子酱具有很高的经济价值。随着鲟鱼的工厂化养殖业的发展日渐繁盛, 俄罗斯鲟作为鲟鱼养殖业的重要品种之一, 具有广阔的开发前景。然而, 迄今对于俄罗斯鲟适宜养殖密度的研究仍不多见。基于此, 本实验研究不同养殖密度对俄罗斯鲟幼鱼生长、免疫和抗应激性能等方面的差异, 以期为俄罗斯鲟幼鱼工厂化养殖适宜密度的确定提供参考, 结果对促进俄罗斯鲟的工厂化养殖技术、提高经济效益都具有重要的意义。
1 材料与方法
1.1 实验动物及养殖管理
俄罗斯鲟幼鱼购自浙江衢州市一养殖场, 经聚维酮碘(10 g/L浸泡5min后, 暂养14d后, 开始正式实验。随机选取体表无外伤、个体均匀的幼鱼(4.4±0.5) g共 1090尾, 平均投放到9个网箱(0.75 m×0.75 m×1 m)中。所有网箱均安放在一个循环水池(5 m×1.6 m×1.2 m)中, 水深0.5 m。养殖用水为曝气24h以上的除氯自来水, 日循环量1440 m3, 日净化量为120 m3。养殖期全程充氧, 每天用YSI多参数水质分析仪(美国)对温度、盐度、溶氧量和pH进行监测。在整个养殖过程中, 水温(24—26)℃, 溶解氧>6 mg/L, 总氨氮<0.1 mg/L, pH 7.44—8.12, 光照周期保持12h︰12h。实验周期为56d。
暂养及实验期间均投喂商业饲料, 营养参数为粗蛋白含量≥48%, 粗脂肪≥5%, 粗灰分≥15%。每天分三次(8:00、14:00和20:00)饱食投喂, 投喂30min后利用食物台收集残饵, 记录投饵量和残饵量。
1.2 实验设计和取样
实验设置3个密度处理组, 分别为高密度组(3.2 kg/m3)、中密度组(1.6 kg/m3)和低密度组(0.8 kg/m3), 每个处理组设置三个平行。饲养实验结束后, 饥饿 24h, 以浓度为120 mg/L的三卡因甲基磺酸盐(MS-222)进行麻醉, 统计鱼的存活率, 并称量体重及测量体长, 以统计增重率和肥满度。每个平行组随机挑选 5尾鱼, 解剖取肝脏称重,以计算肝体指数。再随机挑选10尾鱼, 5尾用内涂有肝素钠(100 IU/mL)的一次性注射器于尾静脉取血, 用以血液学和免疫学分析, 另 5尾用未浸润过肝素钠的一次性注射器尾静脉取血, 所取血样置于 4℃过夜, 1200 r/s离心5min获取血清, –80℃存储用于生化分析。
与生长指标有关的指标计算公式如下:
增重率(Weight gain, WG, %)=100×(W2–W1)/W1
饵料系数(Feed conversion ratio, FCR)=F/[W2–W1+W0]摄食量(Food intake, FI, g/尾)=F/[(N2+N1)/2]
蛋白质效率(Protein efficiency rate, PER, %)=100×(W2–W1)/(F×48%)
肥满度(Condition factor, K)=WB/L3
肝体指数(Hepatosomatic index, HSI, %)=100×WL/WB存活率(Survival rate, SR, %)=100×N2/N1
其中, W1、W2和W0分别为实验开始、实验结束和死亡个体总重量(g), F为各平行投喂的饲料量(g), N1为初始总数(尾), N2为终末总数(尾), WB为个体体重(g), L为体长(cm), WL为同一尾鱼的肝脏鲜重(g)。
1.3 急性氨氮胁迫
在养殖实验结束后, 每个平行随机选取10尾俄罗斯鲟, 分别投放于9个聚乙烯(0.6 m×0.4 m×0.4 m)水箱中,进行 96h氨氮急性胁迫实验。实验用水和养殖实验相同,期间不投喂。
参照杜浩等[14]对中华鲟稚鱼的研究结果并结合多次预实验的结果, 确定用总氨17 mg/L的浓度进行96h氨氮胁迫实验, 每隔7h进行氨氮浓度的校准。统计12h、24h、36h、48h、60h、72h、84h和96h的死亡率, 及时捞出死鱼。
1.4 血液指标分析
全血样品一式三份经磷酸缓冲液(PBS)稀释(1︰10000), 采用血球计数板统计红细胞数(RBC)和白细胞数(WBC)。血红蛋白含量的测定采用双波长比色法, 试剂盒购自南京建成生物工程研究所。
1.5 生化指标测定
皮质醇、超氧化物歧化酶(SOD)和丙二醛(MDA)的测定均选用南京建成生物工程研究所的试剂盒。皮质醇采取双位点夹心酶联免疫吸附法。血糖含量测定采用葡萄糖氧化酶-过氧化物酶法, 用分光光度计测定在波长505 nm处吸光值。超氧化物歧化酶(SOD)酶活性测定采用黄嘌呤氧化酶法, 其活力单位定义为: 每mg蛋白质在1 mL反应液中SOD 抑制率达50%时所对应的SOD 量为一个亚硝酸盐单位(NU)。丙二醛(MDA)含量采用硫代巴比妥酸法, 利用MDA可与硫代巴比妥酸缩合形成红色产物, 测定其在532 nm处的吸光值。每个样品均重复测定三次。
1.6 免疫指标
溶菌酶的测定采用南京建成生物研究室的试剂盒,遵照空白对照法, 同一样品一式三份测定530 nm处的吸光值, 以1min内吸光值下降0.001为1个活性单位(U)。
血液吞噬细胞的呼吸暴发水平(Respiratory burst activity)的测定方法参照[15]。同一样品重复测定三次。向每个酶标孔中加入 0.1 mL的硝基四唑氮兰(Nitro blue tetrazolium, NBT)溶液(sigma公司)0.1 mL, 再向当中加入0.1 mL的抗凝血, 使其在NBT溶液中温浴至少30min, 然后加入50 µL的汉克缓冲液(Sigma公司), 3000 r/min离心5min, 记录其在545 nm下的吸光值。根据NBT(mg/mL)= 40×(吸光值–0.0245)/5.8564得出呼吸暴发的水平。
1.7 统计分析
所有数据用平均值±标准误(Mean±SE)的方式来表示。采用单因素方差分析(ANOVA)对实验数据进行检测,如果检测到显著性差异, 则采用 Duncan多重比较。P<0.05时被认为差异显著。软件在Windows 7操作系统中完成。
2 结果
2.1 生长性能
由表 1可以看出, 各组存活率无显著差异(P>0.05);中密度组的增重率和肥满度均显著高于高密度组(P<0.05), 但与低密度组之间无显著差异(P>0.05); 同时,低、中密度组之间的蛋白质效率差异不显著(P>0.05), 但均显著高于高密度组(P<0.05); 饲料系数的统计结果显示,高密度组显著高于中、低密度组(P<0.05), 后二者间则无显著性差异(P>0.05); 中密度组摄食量显著高于低密度组和高密度组(P<0.05), 且高密度组显著高于低密度组(P<0.05); 此外, 高密度组的肝指数最低, 但在各组间无显著性差异(P>0.05)。
2.2 血液参数
从表 2中可以看出, 高密度组的血红蛋白含量最高(P<0.05), 相比之下, 中密度组与低密度组之间则无显著性差异(P>0.05); 此外, 红细胞数目随着养殖密度的提高而升高, 但各个密度组之间并无显著性差异(P>0.05); 相似地, 高密度组的白细胞数目最低, 但与中密度组、低密度组相比, 三者之间亦无显著性差异(P>0.05)。高密度组呼吸爆发水平最低, 但各组间无显著差异(P>0.05)。X SE± )X SE± )
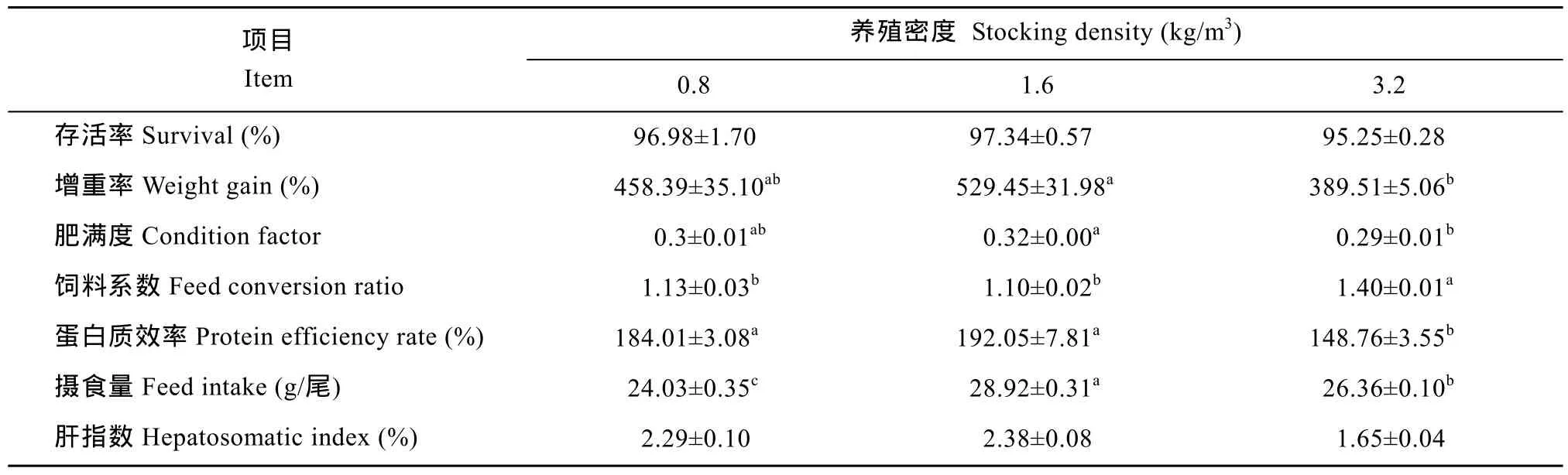
表1 不同养殖密度对俄罗斯鲟的生长指标的影响Tab. 1 Effects of stocking density on growth parameters of juvenile Russian sturgeon juvenile (n=5,
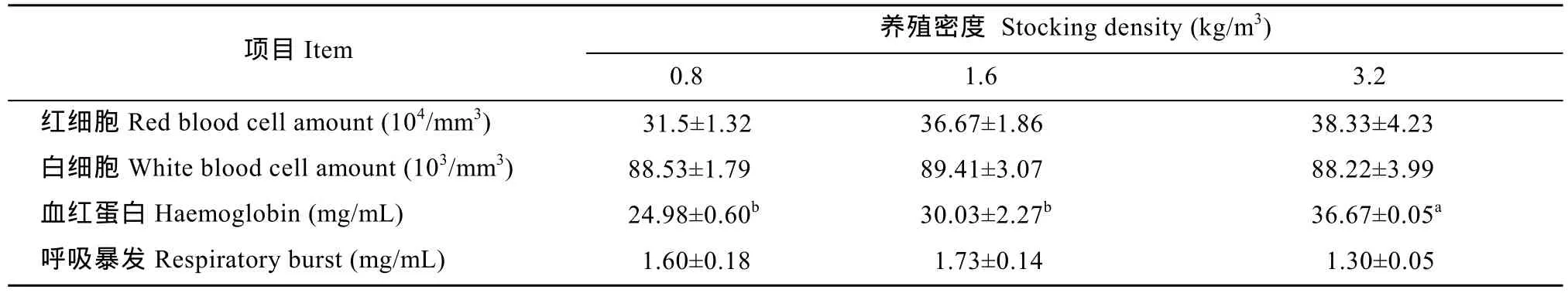
表2 不同养殖密度对俄罗斯鲟血液参数的影响Tab. 2 Effect of stocking density on some hematological parameters in juvenile Russian sturgeon juvenile (n=5,
2.3 血清生化和免疫参数
表 3显示, 高密度组的皮质醇水平显著高于中密度组、低密度组(P<0.05), 而低密度组和中密度组无显著性差异(P>0.05); 血糖含量的趋势与皮质醇类似, 但各组间无显著差异(P>0.05); 低密度组的血清SOD活性最高, 高密度组的最低, 但三个密度组之间无显著性差异(P>0.05);血清MDA的测定结果显示, 高密度组血清MDA的含量最高, 中密度组的最低, 各组间无显著性差异(P>0.05);此外, 低密度组与中密度组的溶菌酶活力无显著性差异(P>0.05), 但均显著高于高密度组(P<0.05)。
2.4 急性氨氮胁迫
从图1可以看出, 在总氨浓度为17 mg/L条件下, 随着氨氮胁迫时间的延长, 各组死亡率均呈逐渐上升趋势,从实验开始至 84h内, 同一时段不同组间之间的个体死亡率无显著性差异(P>0.05), 但至 96h时, 高密度组的死亡率最高, 低密度组居中, 中密度组最低, 统计分析发现,高密度组的死亡率显著高于中密度组(P<0.05), 而低密度组与中、高密度组之间则无显著性差异(P>0.05)。
3 讨论
3.1 生长性能
在通常情况下, 随着养殖密度的上升, 鱼类的生长率和饲料效率均呈下降的趋势[16]。Rafatnezha等对不同密度条件下欧洲鳇(Huso huso)的研究表明, 最高密度组的个体增重率和肥满度显著最低, 而饲料系数最高[8]。Christiansen等在对北极红点鲑(Salvelinus alpinus)的研究发现, 摄食率和增重率均随密度的升高而显著降低[17]。并且,过高的养殖密度也在一定程度上抑制了银鲈(Bidyanus bidyanus)、非洲鲶(Clarias gariepinus)、罗非鱼(Oreochromis spilurus)和虹鳟(Oncorhynchus mykiss)等的生长[18—21]。高密度抑制鱼类生长的原因有如下几点: 其一, 过高的养殖密度会加剧群体内的竞争, 直接导致平均个体摄食量降低[22]。其二, 密度过高会对鱼类造成一定程度的应激效应, 机体需消耗更多的能量来应对胁迫,以维持正常的代谢过程。在本实验中, 高密度组的血红蛋白含量显著高于中、低密度组, 这与此前诸多报道的结果一致, 提示高密度组个体的血液携氧能力提高, 新陈代谢相对旺盛[23—25]。其三, 高密度下的个体用于新陈代谢所消耗能量的比例,一般要高于密度适中或较低环境下的个体[26]。并且, 高密度组个体为了获得必要的食物, 觅食游动频繁, 消耗的能量也相应有所提高[27]。在本实验中, 与中、低密度组相比, 高密度组的摄食量、蛋白质效率、饲料利用率均最低,表明高密度组条件下的鱼摄入、吸收和同化的营养物质比例相对较低, 而消耗供能的比例偏高, 从而抑制了鱼的生长性能和饲料利用效率。但也有一些学者发现, 高密度并未明显影响某些鱼类的生长性能, 如 Celikkale等的研究显示, 高养殖密度对均重(280±31.27) g的俄罗斯鲟的特定生长率、饲料利用率和肥满度未造成显著影响[28]。造成这一差异的原因, 可能与鱼的种类、生长阶段以及实验环境的不同有关, 具体原因尚需进一步深入研究。另有研究指出, 养殖密度偏低亦会抑制鱼的生长[29]。逯尚尉等在对点带石斑鱼(Epinephelus malabaricus)的研究表明,中密度(2.1 kg/m3)组个体的增重率显著高于低密度(1.1 kg/m3)组和高密度(3.2、4.2 kg/m3)组[5]。本研究中低密度组的摄食率和增重率均低于中密度组, 可能由于俄罗斯鲟幼鱼具有集群效应(Cluster effect), 密度过低导致其摄食不积极, 且个体平均活动范围过大, 觅食等活动所消耗能量相应增多。低密度组的饲料系数高于中密度组, 且蛋白质效率较低则从另一个侧面验证了这一点。
表3 不同养殖密度对俄罗斯鲟血清生化和免疫参数的影响Tab. 3 Effects of stocking density on the serum biochemical and immune parameters in juvenile Russian sturgeon juvenile (n=5,± SE)

表3 不同养殖密度对俄罗斯鲟血清生化和免疫参数的影响Tab. 3 Effects of stocking density on the serum biochemical and immune parameters in juvenile Russian sturgeon juvenile (n=5,± SE)
项目Item 0.8 1.6 3.2养殖密度 Stocking density (kg/m3)血清皮质醇水平Serum cortisol (ng/mL) 728.62±24.58b731.73±45.74b887.32±46.16a血糖水平Serum glucose (mg/dL) 45.05±1.28 46.10±1.41 52.08±3.35超氧化物歧化酶SOD (U/mL) 98.79±2.06 97.50±3.11 91.40±2.28丙二醛MDA (nmol/mL) 6.83±0.43 6.20±0.19 7.11±0.27溶菌酶Lysozyme (U/mL) 155.79±2.11a179.61±9.5a117.99±7.81b
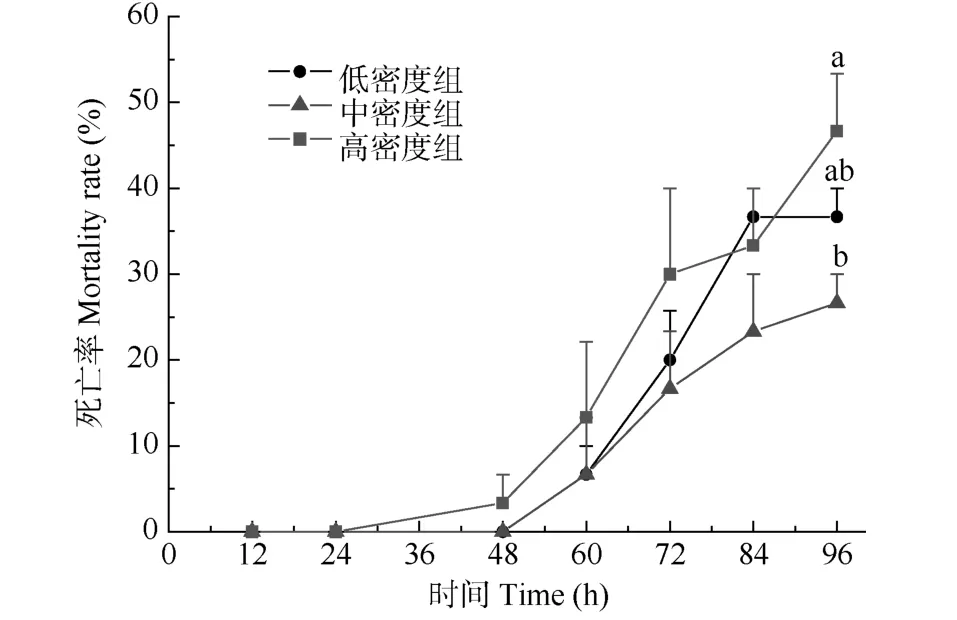
图1 俄罗斯鲟幼鱼氨氮胁迫死亡率Fig. 1 The mortality rate of Russian sturgeon juvenile under ammonia nitrogen stress
3.2 抗应激能力
皮质醇(Cortisol)是一项反映评估鱼类应激反应强度的重要指标。当鱼类处于急性应激状态下, 鱼体的皮质醇在几小时之内急剧升高, 而处于慢性胁迫条件时, 皮质醇水平长期维持在较高水平。鱼类由于高密度胁迫而长期处在应激状态, 通过下丘脑—垂体—肾间组织产生皮质醇等类固醇, 释放到血液中[30]。皮质醇短期的升高能够促进体蛋白分解, 加速脂肪的氧化, 糖类的合成增多, 从而使机体获得足够的能量用以缓解抵御胁迫所需。但是, 皮质醇水平过高或长期持续较高水平, 则会造成鱼体生长停滞, 脂肪合成减少和机体消瘦[31]。在本研究中, 高密度组个体长期处于某种应激状态, 因此机体皮质醇持续处于较高水平, 这可能是抑制幼鱼生长的原因之一。并且, 密度胁迫造成的皮质醇水平的升高还会引起鱼类短期的急性适应性反应, 血糖水平因而升高[32]。在本研究中, 高密度组的血糖含量高于其他组, 但组间没有达到显著差异水平。Lupatsch等对欧洲鲈鱼(Dicentrarchus labrax)[26]的研究支持了本实验的结果。不仅如此,机体持续处于应激状态导致了皮质醇水平长期过高, 进而抑制机体的特异性和非特异性免疫防御机制, 导致鱼体对各类病原体敏感性的升高[33]。高养殖密度常引起水质恶化, 氨氮浓度过高, 进而导致鱼类组织溃烂和呼吸功能受阻, 损伤鱼类的抗氧化系统和免疫系统等[34]。本研究 96h急性氨氮胁迫实验中, 高密度组的累计死亡率高于中、低密度组, 可能是由于密度胁迫导致了皮质醇水平过高, 进而降低了该组鱼对高氨氮的耐受性和免疫性能的正常发挥。
3.3 免疫及抗氧化力
有研究表明, 高养殖密度作为胁迫会对鱼类免疫性能和抗氧化性能造成一定影响[35,36]。溶菌酶是鱼类重要的非特异性免疫因子。Demers和 Bayne在对虹鳟(Oncor-hynchus mykiss)的研究发现, 随着养殖密度的升高, 皮质醇和溶菌酶水平显著升高[37]。但 Yin等对锦鲤(Cyprinus carpio L.)研究的发现, 溶菌酶等非特异性免疫指标在胁迫初期显著降低, 之后便维持较低水平[38]。王博文等在对鲫鱼(Carassius auratus)的研究表示, 各密度组溶菌酶水平的变化趋势与皮质醇不同, 高密度组的溶菌酶水平随着胁迫时间的延长, 呈先升高后降低的趋势[39]。在本研究中高密度组的溶菌酶水平显著低于中、低密度组。在环境影响机体免疫器官的过程中皮质醇起介导作用,短期内的升高能帮助增强机体非特异性免疫, 但若长期处于较高水平就会抑制机体免疫功能[37]。这可能是导致本实验高密度组俄罗斯鲟的溶菌酶水平受到显著抑制,免疫功能下降的一个原因。呼吸暴发(Respiratory Burst, NBT)是另一个反映机体免疫性能的指标, 呼吸暴发活性越强, 说明吞噬细胞的杀菌能力越强[40]。在本研究中, 各密度下的俄罗斯鲟的呼吸暴发活性虽然差异不显著, 但高密度组的 NBT活性最低, 这说明高密度胁迫在一定程度上影响了鲟鱼的免疫性能, 该结果与Peters等的研究结果类似[41]。SOD活力和MDA含量的高低间接反映了机体的抗氧化能力[42]。本研究的结果显示, 高密度组的血清SOD活性要低于中、低密度组, 且高密度组的MDA水平要稍高于中、低组, 组间差异均不显著, 与刘松岩等[36]对中华鲟(Acipensersinensis)的研究结果相似, 提示高密度组个体受到密度胁迫时, 新陈代谢加快, 能量消耗升高, 这在一定程度上促进了氧自由基的产生, 进而导致MDA含量升高。高密度组的 SOD活力较其他组低, 说明养殖密度过高也可能导致机体内的自由基代谢失衡。
4 结论
本实验初步研究表明, 低密度(0.8 kg/m3)组和中密度(1.6 kg/m3)组条件下的俄罗斯鲟幼鱼的生长、生理及免疫性能较高密度(3.2 kg/m3)组更优。其中中密度组最优。在本实验条件下, 体质量为(4—5) g左右的俄罗斯鲟幼鱼的适宜放养密度约为 1.6 kg/m3, 该结果可为工厂化养殖提供参考依据。
[1] Zhu Y J, Yang D G, Chen J W, et al. An evaluation of stocking density in the cage culture efficiency of Amur sturgeon (Acipenser schrenckii) [J]. Journal of Applied Ichthyology, 2011, 27(2): 545—549
[2] Salas-Leiton E, Anguis V, Martin-Antonio B, et al. Effects of stocking density and feed ration on growth and gene expression in the senegalese sole (Solea senegalensis): potential effects on the immune response [J]. Fish & Shellfish Immunology, 2010, 28(2): 296—302
[3] Marchand F, Boisclair D. Influence of fish density on the energy allocation pattern of juvenile brook trout (Salvelius fontinalis) [J]. Canadian Journal of Fisheries and Aquatic Sciences, 1998, 55(4): 796—805
[4] Shi X T, Li D P, Zhuang P, et al. Effects of rearing density on juvenile Acipenser schrenckii digestibility, feeding rate and growth [J]. Chinese Journal of Applied Ecology, 2006, 17(8): 1517—1520 [石小涛, 李大鹏, 庄平, 等. 养殖密度对史氏鲟消化率, 摄食率和生长的影响. 应用生态学报, 2006, 17(8): 1517—1520]
[5] Lu S W, Liu Z P, Yu Y. Effects of density stress on growth and metabolism of juvenile Epinephelus malabaricus [J]. Journal of Fishery Sciences of China, 2010, 18(2): 322—328 [逯尚尉, 刘兆普, 余燕. 密度胁迫对点带石斑鱼幼鱼生长、代谢的影响. 中国水产科学, 2011, 18(2): 322—328]
[6] Han N N, Shi Y C. The application of blood indexes in ichthyological research [J]. Journal of Anhui Agricultural Science, 2010, 38(33):18877—18878, 18880 [韩娜娜, 史成银. 血液指标在鱼类学研究中的应用. 安徽农业科学, 2010, 38(33): 18877—18878, 18880]
[7] Tian Z H, Xu S G, Wang W, et al. Effect of acute thermal stress on Hsp70 Mrna, physiology and nonspecific immunity in Siberian sturgeon (Acipenser baerii) [J]. Acta Hydrobiologica Sinica, 2013, 37(2): 344—350 [田照辉, 徐邵刚, 王巍, 等. 急性热应激对西伯利亚鲟HSP70 mRNA表达、血清皮质醇和非异性免疫的影响. 水生生物学报, 2013, 37(2): 344—350]
[8] Rafatnezhad S, Falahatkar B, Gilani M H T. Effects of stocking density on haematological parameters, growth and fin erosion of great sturgeon (Huso huso) juveniles [J]. Aquaculture Research, 2008, 39(14): 1506—1513
[9] Pickering A D. Rainbow trout husbandry: management of the stress response [J]. Aquaculture, 1992, 100(1—3): 125—139
[10] Huan Y, Zhu X M, Xie S Q, et al. Compensmory growth in Acipenser baerii, following feed derivation at high tempemture: temporal patterns in growth, feed intake and body composition [J]. Acta Hydrobiologica Sinica, 2011, 34(6): 1113—1121 [黄莹, 朱晓鸣, 解绶启, 等. 西伯利亚鲟在高温下饥饿后的补偿生长. 水生生物学报, 2011, 34(6): l113—1121]
[11] Rotllant J, Tort L. Cortisol and glucose responses after acute stress by net handling in the sparid red porgy previously subjected to crowding stress [J]. Journal of Fish Biology, 1997, 51(1): 21—28
[12] Peng S M, Shi Z H, Sun P, et al. Effects of breeding density on the growth and tissues biochemical indices of juvenile silver pomfret (Pampus argenteus) [J]. Chinese Journal of Ecology, 2010, 29(7): 1371—1376 [彭士明, 施兆鸿, 孙鹏,等. 养殖密度对银鲳幼鱼生长及组织生化指标的影响. 生态学杂志, 2010, 29(7): 1371—1376]
[13] Yang D, Wei Q W, Wang K, et al. Three types of culture Chinese sturgeon (Acipenser sinesis) and the analysis of their effects by comparison [J]. South China Fisheries Science, 2006, 2: 1—5
[14] Du H, Wei Q W, Liu J Y, et al. Acute toxicity of phenol, copper, nitrite and total ammonia to juvenile Chinese sturgeon, Acipenser sinensis [J]. Journal of Dalian FisheriesUniversity, 2007, 22(2): 118—122 [杜浩, 危起伟, 刘鉴毅,等. 苯酚、Cu2+、亚硝酸盐和总氨氮对中华鲟稚鱼的急性毒性. 大连水产学院学报, 2007, 22(2): 118—122]
[15] Prusty A K, Sahu N P, Pal A K, et al. Effect of dietary tannin on growth and haemato- immunological parameters of Labeo rohita (Hamilton) fingerlings [J]. Animal Feed Science and Technology, 2007, 136: 96—108
[16] Shelbourn J E, Brett J R, Shirahata S. Effect of temperature and feeding regimes on the specific growth rate of sockeye salmon fry (Oncorhynchus nerka), with a consideration of size effect [J]. Fisheries Research Board of Canada, 2011, 30: 1191—1194
[17] Christiansen J S, Svendsen Y S, Jobling M, et al. The combined effects of stocking density and sustained exercise on the behaviour, food intake, and growth of juvenile Arctic charr (Salvelinus alpinus L.) [J]. Canadian Journal of Zoology, 1992, 70(1): 115—122
[18] Rowland S J, Mifsud C, Nixon M, et al. Effects of stocking densety on the performance of the Australian freshwater silver perch (Bidyanus bidyanus) in cages [J]. Aquaculture, 2006, 253(1—4): 301—308
[19] Haylor G S. Controlled hatchery production of Clarias gariepinus (Burchell, 1822): growth and survival of fry at high stocking density [J]. Aquaculture Research, 1992, 23(3): 405—422
[20] Cruz E M, Ridha M. Production of the tilapia Oreochromis spilurus Günter stocked at different densities in sea cages [J]. Aquaculture, 1991, 99: 95—103
[21] Bagley M J, Bentley B, Gall A E G. A genetic evaluation of the influence of stocking density on the early growth of rainbow trout (Oncorhynchus mykiss) [J]. Aquaculture, 1994, 121(4): 313—326
[22] Sawcer S J, Maranian M, Singlehurst S, et al. Enhancing linkage analysis of complex disorders: an evaluation of highdensity genotyping [J]. Human Moecularl Genetics, 2004, 13(7): 1943—1949
[23] Trenzado C E, Morales A E, Palma J M, et al. Blood antioxidant defenses and hematological adjustments in crowded uncrowded rainbow trout (Oncorhynchus mykiss) fed on diets with different levels of antioxidant vitamins and HUFA [J]. Comparative Biochemistry and Physiology C, Toxicology & Pharmacology, 2009, 149(3): 440—447
[24] Ruane N M, Carballo E C, Komen J. Increased stocking density influences the acute physiological response of the common carp Cyrinus carpio (L) [J]. Aquaculture Research, 2002, 33(10): 777—784
[25] Docan A, Gristea V, Grecu I, et al. Haematological response of the European catfish, Silurus glanis reared at different densities in “flow-through” production system [J]. Archiva Zootechnica, 2010, 13: 63—70
[26] Lupatsch I, Santos G A, Schrama J W, et al. Effect of stocking density and feeding level on energy expenditure and stress responsiveness in European sea bass Dicentrarchus labrax [J]. Aquaculture, 2010, 298(1): 245—250
[27] Lambooij E, Vis J W V D, Kloosterboer R J, et al. Welfare aspects of live chilling and freezing of farmed eel (Anguilla anguilla L.): neurological and behavioural assessment [J]. Aquaculture, 2002, 210(1—4): 159—169
[28] Celikkale M S, Memis D, Ercan E, et al. Growth performance of juvenile Russian sturgeon (Acipenser gueldenstaedtii Brandt & Ratzenburg,1833) at two stocking densities in net cages [J]. Journal of Applied Ichthyology, 2005, 21(1): 14—18
[29] Jorgensen E H, Christiansen J S, Jobling M. Effects of stocking density on food intake, growth performance and oxygen consumption in Arctic charr (Salvelinus alpinus) [J]. Aquaculture, 1993, 110: 191—204
[30] Vijayan M M, Leatherland J F. High stocking density affects cortisol secretion and tissue distribution in brook charr, Salvelinus fontinalis [J]. Journal of Endocrinology, 1990, 124(2): 311—318
[31] Gregory T R, Wood C M. The effects of chronic plasma cortisol elevation on the feeding behaviour, growth, competitive ability, and swimming performance of juvenile rainbow trout [J]. Physiological and Biochemical Zoology, 1999, 72(3): 286—295
[32] Bayunova L, Barannikova I, Semenkova T. Sturgeon stress reactions in aquaculture [J]. Journal of Applied Ichthyology, 2002, 18(4—6): 397—404
[33] Robertson O H, Hane S, Wexler D C, et al. The effect of hydrocortisone on immature rainbow trout (Salmo gairdneri) [J]. General and Comparative Endocrinology, 1963, 3(4—6): 422— 436
[34] Qiang J, Xu P, He J, et al. The combined effects of external ammonia and crowding stress on growth and biochemical activities in liver of (GIGT) Nile tilapia juvenile (Oreochromis niloticus) [J]. Journal of Fisheries of China, 2011, 35(12): 1837—1847 [强俊, 徐跑, 何杰, 等. 氨氮与拥挤胁迫对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化指标的联合影响. 水产学报, 2011, 35(12): 1837—1848]
[35] Hegazi M M, Attia Z I, Ashour O A. Oxidative stress and antioxidant enzymes in liver and white muscle of Nile tilapia juveniles in chronic ammonia exposure [J]. Aquatic Toxicology, 2010, 99(2): 118—125
[36] Liu S Y. Effect of environmental stress on free radical level and antioxidant enzyme activities of Chinese sturgeon, Acipenser Sinensis [D]. Thesis for Master of Science. Huazhong Agricultural University, Wuhan. 2006 [刘松岩.环境胁迫对中华鲟体内自由基水平和抗氧化酶活力的影响. 硕士学位论文, 华中农业大学, 武汉. 2006]
[37] Demers N E, Bayne C J. The immediate effect of stress on hormones and plasma lysozyme in rainbow trout [J]. Developmental and Comparative Immunology, 1997, 21(4): 363—373
[38] Yin Z, Lam T J, Sin Y M. The effects of crowding stress on the non- specific immuneresponse in fancy carp (Cyprinus carpio L.) [J]. Fish and Shellfish Immunology, 1995, 5(7): 519—529
[39] Wang B W, Wang J G, Li A H, et al. Changes of cortisol an lysozyme levels in Carassius auratus blood after crowding stress and the fish sensitivity to pathogen [J]. Journal of Fishery Sciences of China, 2004, 11(4): 408—412 [王博文,王建国, 李爱华, 等. 拥挤胁迫后鲫鱼血液皮质醇和溶菌酶水平的变化及对病原的敏感性. 中国水产科学, 2004, 11(4): 408—412]
[40] Sharp G J E, Secombes C J. The role of reactive oxygen species in the killing of the bacterial fish pathogen Aeromonas salmonicida by rainbow trout macrophages [J]. Fish and Shellfish Immunolog, 1993, 3(2): 119—129
[41] Peters G, Faisal M, Lang T, et al. Stress caused by social interaction and its effect on susceptibility to Aeromonas hydrophila infection in rainbow trout Salmo gairdneri [J]. Diseases of Aquatic Organisms, 1988, 4: 83—89
[42] Viarengo A, Canesi L, Martinez P G, et al. Pro-oxidant processes and antioxidant defence systems in the tissues of the Antarctic scallop (Adamussium colbecki) compared with the Mediterranean scallop (Pecten jacobeus) [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 1995, 111(1): 119—126
EFFECTS OF STOCKING DENSITY ON GROWTH, PHYSIOLOGICAL AND IMMUNE RESPONSES IN JUVENILE RUSSIAN STURGEON
CAO Yang1, LI Er-Chao1, CHEN Li-Qiao1, LONG Li-Na2, CUI Chao1, DU Zhen-Yu1, Sun Sheng-Ming3
and LI Ming4
(1. School of Life Sciences, East China Normal University, Shanghai 200241, China; 2. Institute of Fisheries Mechanical Equipment, Scientific Research Institute of China, Shanghai 200092, China; 3. Freshwater Fisheries Research Center, Chinese
Academy of Fishery Sciences, Wuxi 214081, China; 4. School of Marine, Ningbo University, Ningbo 315211, China)
俄罗斯鲟; 养殖密度; 生长; 生理; 免疫
Russian sturgeon (Acipenser gueldenstaedtii); Stocking density; Growth; Physiology; Immune
S965.2
A
1000-3207(2014)05-0968-07
10.7541/2014.143
2013-07-30;
2014-02-26
国家科技支撑计划(2012BAD25B03); 国家基础研究“973” 计划项目(2009CB118702); 公益性行业(农业)科研专项项目(201003020, 201203065); 国家自然科学基金项目(31172422); 上海市教委水产E研究院(E03009)部分资助
曹阳(1988—)女, 辽宁开原人; 硕士研究生; 主要从事水生动物营养学研究。E-mail: caoyang3640@163.com
陈立侨, 教授; E-mail: lqchen@bio.ecnu.edu.cn
