鸡白痢沙门氏菌O12特异性噬菌体的分离及生物学特性研究
2014-03-16李涵依车晨耿亚刘福音郝葆青
李涵依, 车晨, 耿亚, 刘福音, 郝葆青
(西南民族大学生命科学与技术学院, 成都 610041)
鸡白痢沙门氏菌O12特异性噬菌体的分离及生物学特性研究
李涵依, 车晨, 耿亚, 刘福音, 郝葆青
(西南民族大学生命科学与技术学院, 成都 610041)
采用双层平板培养法从成都某养鸡场的污水样本中分离得到一株鸡白痢沙门氏菌O12(宿主菌)的噬菌体(Ph-1),并对菌斑形态及理化特性进行了初步研究. 试验结果显示, 纯化后该噬菌体的噬菌斑直径约3mm; 经高于60℃温度处理1h 后噬菌体失活; PH5-7时该噬菌体可保持较高效价和较强的紫外线耐受性; 该噬菌体的最佳感染复数(MOI)为0.01-0.001; 一步生长曲线显示该噬菌体的潜伏期为40min, 裂解期持续60min.
鸡白痢; 噬菌体; 沙门氏菌
鸡白痢在我国大部分地区频繁发生, 为养鸡场中一种常见的细菌性传染病, 其雏鸡致死率可高达80%[1]. 鸡白痢的病原菌是鸡白痢沙门氏菌, 分类上属于肠科沙门氏菌. 沙门氏菌定殖在动物肠道内, 在胴体加工中若处理不当, 极易污染食品, 造成食品安全隐患, 危害人类健康[2]. 近些年来, 随着养殖户和饲料生产商抗生素的滥用导致该病菌出现越来越多的耐药菌株, 使众多的治疗沙门氏菌感染病症的抗生素失效. 据报道[3], 中国沙门氏菌对磺胺类抗生素的耐药性已经接近100%, 人们不得不寻求别的、能有效对抗该病菌感染的防治方法.
噬菌体是一类专性寄生或感染细菌的病毒, 它们广泛存在于自然界中. 一般而言, 存在某种病原细菌的场所中往往也可能存在能对其裂解的特异性噬菌体[4]. 烈性噬菌体可以在敏感宿主菌胞内增殖, 最后裂解宿主菌释放出子代噬菌体, 从而达到破坏宿主菌的作用. 早在1934年, 美国科学家就报道了用噬菌体进行肠球菌感染的治愈率可达90%[5].
本次实验随机采取成都郊区某养鸡场地面污水的30份试样, 从中分离得到了一株鸡白痢沙门氏菌O12特异性噬菌体, 并对其进行纯化, 增殖和一系列理化特性的研究, 以期为噬菌体防治鸡白痢新途径的探索提供参考数据.
1 实验材料
1.1 实验菌株
鸡源沙门氏菌O12(保藏于本实验室); 30份地面污水样本采集于成都郊区某养鸡场.
1.2 培养基.
SS琼脂培养基(成都科龙化工试剂厂).
LB液体培养基: 10g蛋白胨, 5g氯化钠, 5g酵母提取物, 蒸馏水定容至1000ml.
LB琼脂培养基: LB液体培养基+1%琼脂;
双层琼脂平板培养基: 上层——半固体培养基(LB液体培养基+0.7%琼脂), 下层——固体培养基(LB 液体培养基 +1.5%琼脂).
以上培养基配制完成后调PH至7.2-7.5, 121℃高压灭菌20min.
1.3 主要仪器
恒温水浴锅; 离心机; 721分光光度计; 0.22µm无菌过滤器; 自动PH计等.
2 实验方法
2.1 宿主菌的复苏与准备
取斜面保存的沙门氏菌O12, 将其放入无菌EP管中, 用蒸馏水稀释. 稀释后, 接种于SS琼脂培养基, 恒温水浴培养箱中倒臵 37℃培养16h. 观察并挑取中等大小, 中央呈灰褐色的典型沙门氏菌菌落接种于LB液体培养基, 空气浴振荡180r/min, 37 ℃, 培养8h得到宿主菌悬液, 备用.
2.2 噬菌体的分离与鉴定
30份养鸡场污水样, 每份取5ml, 5000r/min离心10min, 吸取上清经0.22µm微孔滤膜过滤除去杂菌后接种于加入有20ml LB液体培养基的灭菌三角瓶中, 再按体积比1:1.5加入对数生长期的宿主菌(沙门氏菌O12)悬液, 37℃, 80r/min, 振荡培养8h, 再次经0.22µm 微孔滤膜过滤去除宿主菌得到噬菌体原液. 然后, 采用双层琼脂平板法进行噬菌体鉴定. 具体方法如下: 下层培养基倒板后4℃冷藏, 上层培养基倒板后50℃保温备用. 取菌悬液300µl和300µl噬菌体原液混合, 40℃水浴30min使噬菌体充分吸附于宿主菌表面. 将混合液加入盛有4mlLB上层琼脂培养基的EP管中, 混匀后迅速倒入上层平板培养基, 旋转培养皿使其均匀分布, 待充分冷却凝固后倒臵培养4-8h. 若噬菌体原液中沙门氏菌O12特异性噬菌体存在, 则在下层培养基中出现不规则形状蚕蚀状噬菌斑.
2.3 噬菌体纯化
选择直径较大, 边缘清晰, 噬菌斑中央无菌落的初次培养噬菌斑, 用接种环刮取上层培养基的噬菌斑, 放于含有宿主菌菌液(菌量约108)的4ml LB液体培养基的EP管中, 臵于水浴锅中40℃度水浴1h, 使噬菌体充分吸附于宿主菌, 摇床80r/min培养8h后进行双层平板噬菌斑培养试验. 重复数次以上实验步骤, 直至观察到噬菌斑形态呈现较规则、统一的大小为止.
2.4 噬菌体增殖
纯化后的噬菌体效价较低, 需经过反复增殖来增加噬菌体浓度来进行后续研究. 方法如下: 用接种环刮取纯化后的噬菌斑, 臵于5mlLB液体培养基中用移液枪反复吹打, 40℃水浴1h, 10000r/min离心5min后收集上清,过滤去除宿主菌即为噬菌体浸出液. 取1ml 浸出液加入5ml宿主菌增菌液37℃过夜培养, 可见培养液较之前变澄清, 离心过滤除菌后得到噬菌体增殖液. 通常将增殖过程重复4-8次以得到较大效价的噬菌体液.
分别各取5ml噬菌体浸出液和宿主菌悬液(对照)在721分光光度计上测定650波长的OD值, 以快速检测噬菌体的增殖效果和大致密度.
2.5 效价测定
将噬菌体增殖液用LB液体培养基做10倍梯度稀释10 次. 将3-10次的稀释度各取100µl, 加入过夜培养的300µl宿主菌增菌液, LB液体培养基补至4ml充分混匀, 40℃水浴1h后做双层平板, 取噬菌斑适宜(个数约50-200)的平板计算噬菌斑个数, 平行实验取平均值. 效价(PFU/ml)=噬菌斑个数×稀释倍数×10.
2.6 噬菌体PH稳定性的测定
配制不同PH(3、4、5、6、7、8、9、10)的LB培养基, 灭菌后分别取4ml加入400µl噬菌体液浸出液中, 室温20℃放臵30min, 取1ml加入300µl宿主菌菌液, , 40℃恒温水浴箱中水浴1h, PH 为7的LB培养基补至4ml双层平板法过夜培养测定噬菌体效价, 做平行实验, 效价取平均值.
2.7 噬菌体热稳定性的测定
取5支无菌EP管, 各加100µl纯化噬菌体液, 分别40℃、50℃、60℃、70℃和80℃水浴1h, 加入300µl宿主菌混合后40℃水浴1h, 然后LB培养基补至4ml, 采用双层平板法过夜培养测定噬菌体效价.
2.8 最佳感染复数(MOI)的测定
宿主菌过夜培养8h至对数增长期, 平板法测定菌液浓度, 然后稀释至约107CFU/ml, 按0.001(菌液1000µl噬菌体液1µl)、0.01(菌液1000µl噬菌体液10µl)、0.1(菌液300µl噬菌体液30µl)、1(菌液300µl噬菌体液300µl)的比例加入经稀释的噬菌体液(107PFU/ml), 然后加液体LB培养基至4ml, 37℃摇床80r/min培养4h, 10000r/min离心5min, 取上清, 双层平板法测效价. 各比例均设平行实验组取平均值, 以产生最高噬菌体效价比例为最佳感染复数.
2.9 紫外线耐受性实验
取噬菌体液10ml于培养皿下盖中, 采用超净台20w紫外线灯35cm处照射, 间隔10min取样, 共取9次. 取样后立即做双层平板计算噬菌体效价. 设对照组, 同样时间取样, 不经紫外线照射.
2.10 一步生长曲线的绘制
取过夜培养的宿主菌, 稀释调滴度至107CFU/ml, 按照感染复数(MOI)0.01 加入梯度稀释的噬菌体(105PFU/ml)5ml和宿主菌5ml. 40℃水浴孵育15min, 10000r/min离心5min, 弃上清以去除游离的噬菌体后加入适量LB培养基, 迅速开始37℃, 80r/min摇床培养. 培养每隔10min摇匀取样200µl, 10000r/min离心2min, 取上清梯度稀释后, 做双层平板测定噬菌体滴度, 共取样12次. 以取样时间为横坐标, 噬菌体滴度的对数值为纵坐标, 绘制一步生长曲线.
3 结果
3.1 噬菌体分离与噬菌斑形态
第一次培养噬菌体原液做双层平板培养8h后, 平板上出现大量形状不规则的噬菌斑, 呈蚕蚀状(图1A), 证明噬菌体原液中存在沙门氏菌O12的特异性噬菌体. 经过6次纯化后, 获得大小和形状基本一致的噬菌斑, 直径约2-3mm, 即为一株纯化的噬菌体, 命名为Ph1.

图1 沙门氏菌O12噬菌体噬菌斑(A纯化前; B 纯化后)
3.2 噬菌体效价测定
经增殖后获得噬菌体原液, 梯度稀释后选择适宜噬菌斑个数的平板计数. 其中第6次稀释的噬菌体液产生的噬菌斑数较适宜, 约为80个, 计算效价为8.4×108.
3.3 噬菌体的热稳定性
温度对噬菌体Ph1的影响见表1. 可以发现在40-50℃是能较好得保持活性, 效价没有明显下降, 当温度高于60℃时, 噬菌体效价大幅下降, 70℃以上水浴1h可使噬菌体全部灭活.

表1 噬菌体热稳定性测定结果
3.4 噬菌体PH稳定性
环境PH值对该噬菌体影响见表2和图2. 结果表明噬菌体在PH5-8时保持较高的活性. 在PH低于5时, 活性大幅下降. 在PH为6-7时能够保持最大效价.

表2 噬菌体PH 稳定性测定结果
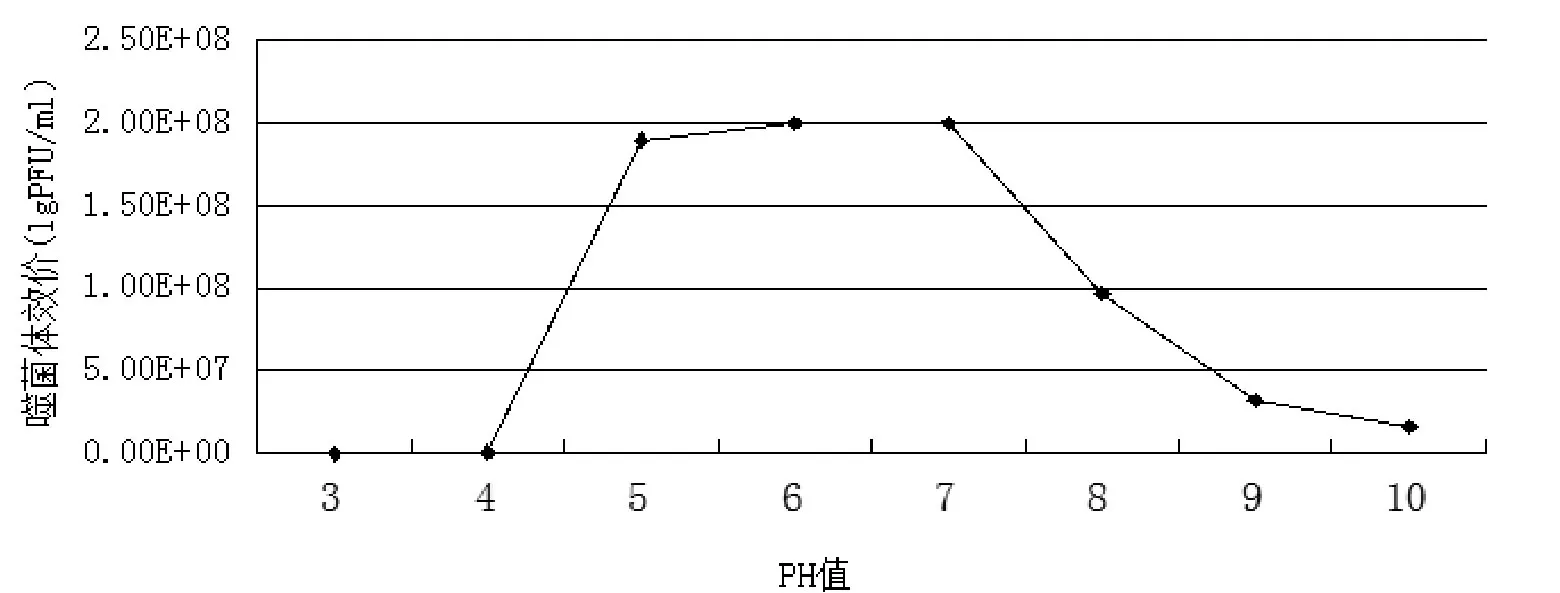
图2 噬菌体的PH值稳定性实验结果
3.5 噬菌体紫外线耐受性实验
图3和表3显示了噬菌体Ph1对紫外线照射的耐受性. 实验结果表明, 实验组和对照组两组数据的 P(T<=t)值=0.17>0.05, 两组数据无明显显著性差异, 说明紫外线照射对噬菌体并无明显影响, 照射90min以后噬菌体效价仍保持初始效价108PFU/ml.

表3 噬菌体Ph1紫外线耐受性测定结果
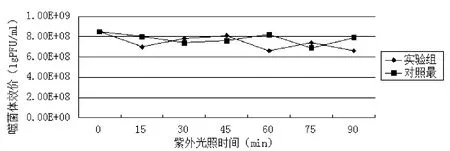
图3 噬菌体紫外线耐受性实验结果
3.6 最佳感染复数
实验结果表明, 在四个不同的感染复数中, 0.01和0.001实验组中培养的噬菌体滴度最高, 为108PFU/ml, 故此噬菌体的最佳感染复数在0.01-0.001之间.

表4 噬菌体最佳MOI实验结果
3.7 噬菌体一步生长曲线
每10min取样测噬菌体效价, 绘制噬菌体Ph1的一步生长曲线如图4 , 可以看出噬菌体侵染宿主菌的前50min内, 噬菌体效价几乎没有上升, 即此段时间为噬菌体的潜伏期, 在60min效价出现大幅上升, 为噬菌体裂解期, 裂解期持续约40min.

图4 噬菌体的一步生长曲线
4 讨论
鸡白痢沙门氏菌广泛存在于禽类养殖场所, 是鸡群爆发性腹泻主要原因之一, 死亡率较高[6]. 禽类肠道内的沙门氏菌极易污染食品, 是主要食品卫生和安全的隐患. 另外, 该病原菌易变异产生耐药菌株, 抗生素防治在逐渐失去其效果. 噬菌体作为一种能够高效裂解细菌的病毒, 将有可能替代抗生素担当防治细菌性感染疾病的重任.[7]噬菌体有较高的特异性, 针对特定病原细菌的噬菌体分离、鉴别及特性研究正在受到广泛的重视, 并且这些研究将有助于开发噬菌体在防治细菌性感染疾病方面的潜力和临床应用.
本次实验采用双层平板法分离法从成都某养鸡场地面污水样本中获得了一株鸡白痢沙门氏菌噬菌体(Ph1).该噬菌体在平板上形成直径2-3mm的圆形噬菌斑, 边缘清晰透亮, 说明该噬菌体能对宿主菌进行较彻底的裂解.经过富集增殖实验, 噬菌体的效价能达到108PFU/ml. 不同细菌的噬菌体也有不同的最佳感染复数(MOI), 本次实验分离的噬菌体最佳感染复数为0.01-0.001. 感染复数是病毒感染宿主菌能力的重要指标, 在最佳感染复数时,噬菌体的感染率是最高.[8]对噬菌体感染复数的研究将可为后续噬菌体制剂的制备和临床应用剂量的确定都有重要指导意义.
噬菌体感染宿主菌的第一个步骤是吸附, 在吸附过程中, 环境的温度和PH都会影响噬菌体的吸附效率.[9]温度过高和PH过高或过低都会引起噬菌体失活. 本实验中, 噬菌体Ph1侵染宿主菌的最佳温度为40-50℃. 温度高于70℃时, 噬菌体失活; PH高于7时, PH1噬菌体效价大幅下降.
先前研究表明, 紫外线对一部分大肠杆菌噬菌体有较强的灭活作用.[10]然而, 本次紫外照射实验中对照组和实验组的P值>0.05, 数据无显著性差异, 说明紫外线照射对噬菌体PH1活性并无明显影响. 噬菌体PH1对紫外线有较强耐受性, 原因可能是该噬菌体PH1由于化学、物理和生物因子比如环境压力的长期作用下导致变异所致. 大部分病毒的生长期都呈现“一步生长”的特点, 即子代噬菌体的释放呈现爆发的状态. 一般认为潜伏期短、且裂解期长的噬菌体其裂解能力较强.[11]本实验显示, 噬菌体Ph1的潜伏期为60min, 裂解期持续约40min,表明该噬菌体的裂解能力较强, 可用于后续噬菌体防治细菌性感染疾病的研究.
[1] HUI AN, DAHUA ZHANG, XIAOLING CHEN, et al. Isolation and identification of Salmonella pullorum[J]. Agricultural Science & Technology, 2012, 13(3): 661-663, 668.
[2] 孙裕光. 鸡白痢沙门氏杆菌的分离鉴定及灭活菌苗的研制[D]. 武汉: 华中农业大学, 2004.
[3] 张凌云. 鸡场沙门氏菌的分离鉴定及耐药性研究[D]. 沈阳: 吉林农业大学, 2011.
[4] 李菁华, 孙延波. 噬菌体疗法在耐药性细菌感染中应用的研究进展[J]. 吉林大学学报: 医学版, 2013, 39(3): 630-633.
[5] 刘平, 邬亭亭, 彭丽, 等. 噬菌体疗法治疗大肠埃希菌感染的研究现状及应用前景[J]. 重庆医学, 2012, 41(16): 1641-1644.
[6] 钱明珠. 河南省部分地区鸡沙门氏菌的分离鉴定与耐药性研究[D]. 郑州:河南农业大学, 2010.
[7] 姜焕焕, 安小平, 米志强. 噬菌体治疗细菌性感染的进展[J]. 中国生物工程杂志, 2010, 30(12):116-122.
[8] 陈光, 温剑平, 赵银泉, 等. 肺炎克雷伯杆菌噬菌体的分离鉴定和生物学特性的研究[J]. 中国实验诊断学, 2009, 13(11): 1611-1614.
[9] WATANABE R, MATSUMOTO T, SANO G. Efficacy of bacteriophage therapy against gut-derived sepsis caused by Pseudomonas aeruginosa in mice[J]. Antimicrob Agents Chemother, 2007,51(2): 446-452.
[10] 杜崇涛. 大肠杆菌O157噬菌体的分离鉴定及初步应用[D]. 沈阳:吉林大学, 2008.
[11] 鲁会军. 耐药大肠杆菌噬菌体生物特性的研究[D]. 长春: 中国人民解放军军需大学, 2002.
Study on isolation and biological characterization of bacteriophage of salmonella O12for pullorum
LI Han-yi, CHE Chen, GENG Ya, LIU Fu-yin, HAO Bao-qing
(College of Life Science & Technology, Southwest University for Nationalities, Chengdu 610041, P.R.C.)
One bacteriophage, named Ph1, was isolated from waste-water samples collected from a Chengdu hennery by the double-agar method, and was to be obligate on the salmonella O12pullorum (Bacillary white diarrhea) that was as host bacteria. The biological catheterization was explored on this bacteriophage. The results indicated that the diameter of Ph1 phages was about 3mm. When incubated in 60℃ or higher for 1h, the phage was inactivated. It was able to keep a high activity at a range of pH5-7. In the UV-test it was demonstrated that Ph1 possesses a strong ant-UV ability. The best MOI of Ph1 was 0.01-0.001. It showed that the latent phase and rise phase were 40min and 60 min respectively on the one-step growth curve.
pullorum; bacteriophage; salmonella.
S852.61
A
1003-4271(2014)02-0186-06
10.3969/j.issn.1003-4271.2014.02.05
2014-01-10
郝葆青(1956-), 男, 教授, 研究方向: 药物载体, Email:1296714389@qq.com.
西南民族大学研究生创新项目.
