重组猪源胰蛋白酶原的构建、表达与活性分析
2014-03-13冯雪婷刘素丽黄潇王云康龙军金亮曹荣月
冯雪婷,刘素丽,黄潇,王云康,龙军,金亮,曹荣月*
(1. 中国药科大学生命科学与技术学院,江苏 南京210009;2. 江苏未名生物医药有限公司,江苏 常州 213000 ;3. 南京中医药大学生命科学与技术学院,江苏 南京 210046)
·药学研究·
PHARMACEUTICAL RESEARCH
重组猪源胰蛋白酶原的构建、表达与活性分析
冯雪婷1,2,刘素丽2,黄潇2,王云康1,龙军3,金亮1,曹荣月1*
(1. 中国药科大学生命科学与技术学院,江苏 南京210009;2. 江苏未名生物医药有限公司,江苏 常州 213000 ;3. 南京中医药大学生命科学与技术学院,江苏 南京 210046)
目的:构建、表达重组猪源胰蛋白酶原,并对其进行分离纯化和酶活性分析。方法:利用大肠埃希菌表达系统(pET-28a,宿主菌BL21 DE3)优化天然猪源胰蛋白酶原基因,经乳糖诱导表达重组胰蛋白酶原蛋白,采用阴离子交换色谱法分离纯化,以SDS-PAGE电泳鉴定目标蛋白,以紫外分光光度法检测重组蛋白的酶活力。结果:测序结果表明,重组猪源胰蛋白酶原基因工程菌构建成功,SDS-PAGE检测显示目的蛋白条带位置与标准猪源胰蛋白酶条带位置一致,且酶活力可达513.09 U•mg-1。结论:成功获得了重组猪源胰蛋白酶原,且酶活力较好,为进一步研究生产提供了基础。
猪源胰蛋白酶原基因;包涵体变性;乳糖诱导;稀释复性
胰蛋白酶(trypsin,EC3.4.21.4)属于丝氨酸蛋白酶的一种,在胰脏中以胰蛋白酶原的前体形式被合成和分泌。胰蛋白酶原与胰蛋白酶的结构中均存在一个对Ca2+高度亲和的部位,其对胰蛋白酶原的激活及胰蛋白酶活性状态的保持非常重要[1]。在Ca2+的存在下,胰蛋白酶原被肠激酶或有活性的胰蛋白酶激活,形成活化胰蛋白酶[2],后者作为肽链内切酶,对多肽链中赖氨酸或精氨酸羧基所形成的肽键呈高度专一性,可水解该肽键产生以碱性氨基酸为羧基末端的小分子肽。
胰蛋白酶可作为添加剂,用于表面黏附细胞的脱壁,流感病毒疫苗、胰岛素和其他蛋白质的生产,蛋白的快速水解以及动物细胞组织的前处理等,故市场上对纯度高、活性强的胰蛋白酶需求量较大。但在制备胰蛋白酶的传统方法中,由于动物胰腺的个体差异,特别是胰腺中脂肪含量严重影响酶活力以及酶的活化和纯化,故每批的活性胰蛋白酶收率存在差异[3],且分离纯化不彻底所带来的杂质(如糜蛋白酶)会对胰蛋白酶特异性切割赖氨酸和精氨酸的位点产生影响。同时,传统制备方法中分离纯化的步骤多、时间长,易对蛋白造成破坏以致失活,导致产率偏低。因此,胰蛋白酶的制备生产,已逐步由从动物胰脏中提取向重组表达生产过渡。通过构建重组猪源胰蛋白酶原的大肠埃希菌表达系统生产胰蛋白酶,还可避免因供体动物源性所致相关病原体污染以及携带未知病毒的风险。
猪源胰蛋白酶原相对分子质量约为24 000,按等电点不同,猪源胰蛋白酶原可分为阴离子型(pI < 6.8)和阳离子型(pI > 6.8)[4]。因阳离子型不仅比重较大,且稳定性优于阴离子型,故选择阳离子型猪源胰蛋白酶原进行构建、表达[5]。猪源胰蛋白酶原含有12个半胱氨酸,可形成6对二硫键[6](30-160、48-64、132-233、139-206、171-185、196-220),这极大地增加了后续实验中包涵体变性与复性的难度。同时,猪源胰蛋白酶性质不稳定,易发生自溶作用[7],在选择构建重组猪胰蛋白酶原表达系统时,该自溶特性使真核表达系统很难获得完整的胰蛋白酶原,且活化后产物对宿主细胞也会产生毒性[8],故考虑选择原核表达系统[9-10]。此外,该自溶特性要求猪源胰蛋白酶原的激活条件也需严格控制。本研究利用大肠埃希菌表达系统(pET-28a,宿主菌BL21 DE3),初步确立了重组猪源胰蛋白酶原的制备工艺,所得重组猪源胰蛋白酶的酶活力较好,且不含其他动物源污染,为工业化研究生产提供了一定的实验基础。
1 材料
1.1 仪器
DYCP-31C型电泳槽(北京市六一仪器厂);WD-9403型紫外分析仪(北京六一仪器厂);5W-CJ-IB型净化工作台(苏州净化设备厂);HDJ-2B型核酸蛋白检测仪(南京普阳科学仪器研究所);0.2 m2中型切向流超滤交换机(美国密理博公司);AKTA Prime plus(美国通用电气医疗系统有限公司)。
1.2 质粒与菌株
含有pro-Tg基因的表达载体pET-28a为本实验室构建;大肠埃希菌E.coli DH5α、表达宿主菌E.coli BL21(DE3)为本实验室保存。
1.3 酶与试剂
分子克隆工具酶,质粒抽提试剂盒,PCR产物回收试剂盒,甘氨酸,N-苯甲酰-L-精氨酸乙酯(BAEE),标准猪源胰蛋白酶(上海生工生物工程有限公司);硫代乙醇酸钠(β-ME),琼脂粉,氯化钠,磷酸氢二钠,磷酸二氢钾(国药集团化学试剂有限公司);标准常规胰岛素(Lilly France公司,100 IU·mL-1);胰岛素原为实验室自备(浓度为1 g·L-1);猪源胰蛋白酶原基因合成、引物合成、基因测序由南京金斯瑞生物科技有限公司完成。其他试剂均为国产分析纯。
2 方法
2.1 重组猪源胰蛋白酶原基因工程菌的构建
在NCBI基因库中提取天然猪源胰蛋白酶原基因序列(LOC100302368),分析基因中含有的大肠埃希菌表达系统的稀有密码子,且在不改变目的蛋白氨基酸序列的前提下将稀有密码子替换为大肠埃希菌表达系统偏爱密码子,并于5’端添加一个NdeⅠ酶切位点、3’端添加一个NcoⅠ酶切位点。通过基因合成,获得pro-Tg基因以平末端的方式连接在pUC57载体上。经NdeⅠ和NcoⅠ双酶切得到目的片段,以T4DNA连接酶连接到具有相同双酶切位点的表达载体pET28a上,14 ℃过夜反应,并转化大肠埃希菌E.coli DH5α,利用卡那霉素抗性筛选阳性克隆。提取质粒进行NdeⅠ、NcoⅠ双酶切及pvuⅡ单酶切鉴定,以及测序和序列分析。提取重组表达质粒pET28a- pro-Tg转化表达在宿主菌E.coli BL21(DE3)中,构建基因工程菌株。
2.2 重组表达质粒pET28a- pro-Tg的诱导表达
将pET28a-pro-Tg/BL21(DE3)重组基因工程菌接种至含50 μg·mL-1卡那霉素的LB培养基中,于37 ℃活化16 h,按1%的比例转接至含50 μg·mL-1卡那霉素的新鲜LB培养基中,于33 ℃、220 r·min-1条件振荡培养3.5 h后,加入乳糖使其终浓度为5 mmol·L-1,培养24 h,经乳糖诱导表达重组胰蛋白酶原蛋白。
菌液于4 ℃、8 000 r·min-1离心30 min,取少量培养基上清液后留样;收集菌体沉淀,经高压破碎后4 ℃、8 000 r·min-1离心30 min,取上清液与沉淀留样,作14% SDS-PAGE检测重组蛋白的表达情况。
2.3 重组猪源胰蛋白酶原的包涵体变性与复性
2.3.1 重组猪源胰蛋白酶原的包涵体的获得 菌液于4 ℃、8 000 r·min-1离心15 min收集菌体。将菌体重悬于菌体破碎缓冲液(4 mmol·L-1EDTA,10 mmol·L-1Gly-NaOH,pH 8.0~9.0)中室温搅拌1 h。以高压匀浆方式破碎菌体,再于4 ℃、8000 r·min-1离心30 min,弃去上清液,沉淀物重悬于破碎洗涤液(2 mmol·L-1EDTA,25 mmol·L-1Gly-NaOH,pH 8.5)中,室温搅拌2 h。最后于4 ℃、8 000 r·min-1离心30 min,得包涵体沉淀。
2.3.2 重组猪源胰蛋白酶原包涵体的溶解变性 将30 g(湿重)包涵体加至1 L尿素裂解缓冲液(50 mmol·L-1Gly-NaOH,8 mol·L-1Urea,pH 10.5)中,待包涵体重悬后,边搅拌(转速200 r·min-1)边匀速通N2以充分置换溶液中O2, 10 min后加入10 mmol·L-1β-ME作还原剂,25 ℃、200 r·min-1搅拌16 h,最后于25 ℃、8 000 r·min-1离心30 min,收集上清液。
2.3.3 重组猪源胰蛋白酶原包涵体的稀释复性 按V变性上清液︰V复性液=1︰30逐滴加入复性缓冲液(5 mmol·L-1Gly-NaOH,GSH和GSSG比例为1︰0.8,pH 8.0)并缓慢搅拌,使蛋白终浓度为0.2 g·L-1,于8 ℃静置复性24 h后,作超滤浓缩7倍(体积比),并置换缓冲液(5 mmol·L-1Gly-NaOH, pH 8.0)。
2.4 重组猪源胰蛋白酶原的活化
取浓缩复性液按W复性液中蛋白量︰W标准胰蛋白酶=400︰1添加标准胰蛋白酶作酶切,酶切条件为0.5 mmol·L-1Ca2+、pH 8.0、温度25 ℃、时间16 h。
2.5 重组猪源胰蛋白酶的分离纯化
选用DEAE-FF阴离子交换柱,以 5 mmol·L-1Gly-NaOH、pH 9.0的缓冲液平衡至基线平稳,将经标准胰蛋白酶处理后的复性液缓慢连续上样,用相同的缓冲液平衡至基线平稳后,分别用10 mmol·L-1、80 mmol·L-1NaCl盐溶液(含5 mmol·L-1Gly-NaOH,pH 8.0)进行阶段洗脱。收集的样品进行14% SDSPAGE检测纯化结果并进行活力测定。
2.6 重组猪源胰蛋白酶的活力测定
参照《中国药典》[11],以含0.0025 mol·L-1BAEE为测活底物溶液(每10 mL 0.0025 mol·L-1BAEE,加入按 V0.067mol·L-1磷酸二氢钾︰ V0.067mol·L-1磷酸氢二钠=13︰87混合的磷酸盐缓冲液,稀释定容至100 mL,pH 7.6)。取3 mL上述底物溶液置于1 cm的石英比色杯中,在25 ℃环境中,将以0.001 mol·L-1HCl稀释过的酶溶液加至底物中,用紫外分光光度法检测5 min内在254 nm处吸光度的变化。

式中:△A253nm为T分钟内光吸收值的差值;
T为测定时间(min);
V为加入的样品酶溶液的体积(mL);
W为测定液中含供试品的量(mg);
0.003 为在上述条件下,吸光度每分钟改变0.003,即相当于1个胰蛋白酶单位。
2.7 重组猪源胰蛋白酶切割胰岛素原
取定量胰岛素原复性液,以重组猪源胰蛋白酶(浓度为0.392 g·L-1)为实验组、标准猪源胰蛋白酶(浓度为 1 g·L-1)为对照组,按 W复性液中胰岛素原蛋白量︰W胰蛋白酶蛋白量=3000︰1进行酶切反应。其他反应条件为:CPB 添加量按W复性液中胰岛素原蛋白量︰WCPB量=2000︰1、10 mmol·L-1CaCl2、10 mmol·L-1MgCl2、10 mmol·L-1Gly-NaOH 、pH 8.0、时间16 h、温度4 ℃。酶切反应完毕后用1 mol·L-1HCl调节pH至2~3终止反应,HPLC检测实验组、对照组的酶切结果(HPLC进样量均为2μL)。
3 结果
3.1 重组表达质粒pET28a- pro-Tg的构建及序列测定
将通过基因合成连接在pUC57载体上的pro-Tg基因进行NdeⅠ、NcoⅠ双酶切,得到目的片段,再对表达载体pET28a进行相同双酶切得到载体片段,最后按摩尔比5︰1以T4DNA连接酶进行连接。构建好的重组表达质粒pET28a- pro-Tg经NdeⅠ、NcoⅠ双酶切验证,可得到1000 bp左右的目的条带(见图1A)。另对pET28apro-Tg进行pvuⅡ单酶切鉴定,因pro-Tg基因上有3个pvuⅡ酶切位点,可作特异性验证,电泳检测结果见图1B。对构建的重组表达质粒pET28a- pro-Tg进行基因测序,证实其与预期结果一致,已成功将pro-Tg基因插入表达载体质粒pET28a中。

图1 pET28a 酶切鉴定Figure 1 Identification of pET28a by enzyme digestion
3.2 重组猪源胰蛋白酶原的诱导表达
pro-Tg在pET28a与BL-21(DE3)表达系统中,经乳糖诱导表达后,14%SDS-PAGE电泳结果显示培养基上清液和菌体裂解液上清液几乎无目的蛋白,而菌体裂解液沉淀中有大量蛋白,证明pro-Tg以包涵体的形式表达。每升培养基可获得290 g包涵体(湿重),结果见图2。

图2 目的蛋白的SDS-PAGE分析检测Figure 2 SDS-PAGE analysis and identification of target protein
3.3 激活后重组猪源胰蛋白酶的分离纯化
将用标准胰蛋白酶处理的复性液上样至预先平衡的DEAE-FF阴离子交换柱中,再用10 mmol·L-1、80 mmol·L-1NaCl进行阶段洗脱。通过活力检测,发现有活性的组分位于80 mmol·L-1NaCl盐洗脱峰中,通过14% SDS-PAGE检测显示目的蛋白条带位置与标准猪源胰蛋白酶条带位置一致(见图3)。每升发酵液纯化后得11.90 mg活性重组胰蛋白酶,回收率(即得率)为20.51%。
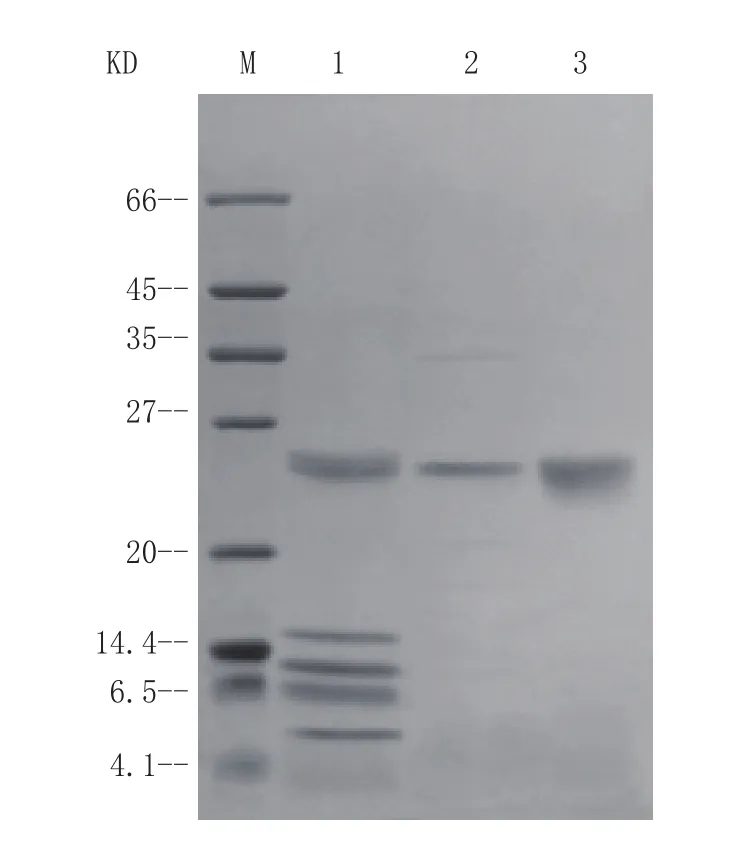
图 3 重组胰蛋白酶的SDS-PAGE纯化分析Figure 3 SDS-PAGE analysis of recombination trypsin purification
3.4 重组猪源胰蛋白酶的活力测定
紫外-可见光分光光度计测量△A253nm来检测标准胰酶活化后的浓缩复性重组胰蛋白酶活性,根据公式计算得重组胰蛋白酶(总蛋白浓度1.91 g·L-1)的比活力为513.09 U·mg-1;猪胰蛋白酶标准品(1 g·L-1)所测得的比活力为2500 U·mg-1。
3.5 重组猪源胰蛋白酶切割胰岛素原
实验组与对照组酶切结果经HPLC检测分析报告见表1、图4,对照标准胰岛素(10 IU·mL-1,0.36 g·L-1),实验组可得胰岛素0.113 g·L-1,对照组可得胰岛素0.120 g·L-1,可见重组胰蛋白酶同样起到了很好的酶切效果。

表 1 重组胰蛋白酶切割胰岛素原的HPLC分析Table 1 HPLC analysis of proinsulin digested with active recombination trypsin

图4 胰蛋白酶实验组、对照组激活胰岛素原的HPLC分析Figure 4 Analysis of proinsulin digested with recombination trypsin by HPLC
4 讨论
本实验中重点与难点在于pro-Tg基因在大肠埃希菌中是以包涵体的形式表达,虽然包涵体蛋白没有活性,可避免对宿主细胞产生毒性以及自身的降解,但其蛋白本身含有6对二硫键,使得包涵体的变性、复性难度较大。在变性中,还原剂β-ME需要增大至包涵体中二硫键总数目的数倍以上,且在加入β-ME前向变性缓冲液中通入N2置换原溶液中所含的O2,可保证原有的二硫键全部断裂,使变性过程完全。而在复性过程中,由于影响蛋白正确折叠的因素较多,如氧化还原对比例、蛋白浓度、溶液离子强度和pH值、温度、时间等,使得重组胰蛋白酶中的6对二硫键错配几率较高,需要对复性影响因素进行综合考虑,不断摸索出最适复性条件来提高复性率。
在实验操作中发现,若向复性液中直接加入标准胰蛋白酶进行激活反应,在后续酶活测定中无法检测到酶活力,而若将复性液先进行超滤置换缓冲液,以去除原复性液中的氧化还原对及其他小分子物质,再作激活反应,则可检测到酶活力,说明原复性液中的氧化还原对及其他小分子物质对胰蛋白酶的活性可能有抑制作用。同时,该抑制作用不仅体现在胰蛋白酶水解肽键的过程中,若往酶活检测底物BAEE溶液中加入测定量的复性缓冲液(不含重组猪源胰蛋白酶原),再加入已知有活性的标准猪源胰蛋白酶,结果检测到的标准猪源胰蛋白酶活性值大大降低,证明该抑制作用同样影响胰蛋白酶水解酯键的过程。
此外,胰蛋白酶的自溶特性对激活步骤有较大的影响,在其他相同条件下,若酶切反应时间过长,会导致所得的活性胰蛋白酶量大大降低。故重组猪源胰蛋白酶原的激活反应需要严格控制反应时间,及时终止反应避免活性胰蛋白酶的自身降解。
实验最终纯化得到重组胰蛋白酶粗品的活力为513.09 U·mL-1,为天然提取酶(标准猪源胰蛋白酶)比活力的20.52%,每升发酵液得11.90 mg活性重组胰蛋白酶,一步DEAE纯化后产率为67.24%,得率(最终得到的有活性酶量/投入的包涵体干重)为20.51%。目前研究多为人源重组胰蛋白酶,如张文勇[12]所做人源胰蛋白酶融合表达,每升发酵液获得1.6 mg活性蛋白;如涂艳等[13]所做人胰蛋白酶的包涵体表达,其终产物比活力为74 U·mL-1,采用本实验中的方法,获得的重组胰蛋白酶得率与比活力均较高。为了利于工业化生产使用,进一步提高该重组胰蛋白酶的纯度、得率和比活力的研究正在进行中。
[参 考 文 献]
[1]凌贤龙. 胰蛋白酶与胰腺疾病[J].国外医学消N化系疾病分册, 1992, 12(3): 139-142.O O NN
[2]Walsh K A. Trypsinogens and trypsins oHf various species[J]. Methods Enzymol, 1970, 19: 41-63.O N
[3]王福清, 李素霞, 郑勇峰. 猪胰腺羧肽酶B提取工艺中的激活条件NN与稳定性研究 [J]. 中国生化药物杂志, 2007, 28 (4): 250-253.
[4]Guy O. Two humaOn trypsinogens: purifcation, molecular properties, and N-terminal sequences [J] . Biochemistry, 1978, 17 (9) : 1669-1675.
[5]Fletcher T S, Alhadeff M, Craik C S, et al. Isolation and characterization of a cDNA encoding rat cationic trypsinogen [J]. Biochemistry, 1987, 26 (11) : 3081-3086.
[6]王军, 唐建国, 张庭芳, 等. 胰蛋白酶分子中二硫键Cys129-Cys232的定位改造研究 [J].中国生物化学杂志, 1996, 12(5): 583-587.
[7]Key J, Kassell B. The autoactivation of trypsinogen [J]. J Biol Chem, 1971, 246 (21) : 6661-6665.
[8]Jungbauer A, Kaar W, Schlegl R, et al. Folding and refolding of proteins in chromatographic beds [J]. Curr Opin Biotechnol, 2004, 15 (5) : 487-494.
[9]Hanquier J, Sorlet Y, Desplancq D, et al. A single mutation in the activation site of bovine trpsinogen enhances its accumulation in the fermentation broth of the yeast Pichia pastoris [J]. Appl Environ Microbiol, 2003, 69 (2) : 1108-1113.
[10]Szilágyi L, Kénesi E, Katona G, et al. Comparative in vitro studies on native and recombinant human cationic trypsins. Cathepsin B is a possible pathological activator of trypsinogen in pancreatitis [J]. J Biol Chem, 2001, 276 (27) : 24574-24580.
[11]国家药典委员会. 中华人民共和国药典(二部)[M]. 北京: 中国医药科技出版社, 2000: 847-848.
[12]张文勇, 王大梅, 甘一如, 等. 人源胰蛋白酶-1与DsbA在E.Coli中的融合表达 [J]. 化学工业与工程, 2014, 31(6): 75-79.
[13]涂艳, 欧西军, 朱乃硕. 人胰蛋白酶原-2在大肠埃希菌中的表达、纯化与活性测定 [J]. 复旦学报, 2004, 43(6): 1067-1072.
Cloning and Expression of Porcine-recombination Trypsinogen Gene and Its Activity Analysis
FENG Xueting1,2, LIU Suli2, HUANG Xiao2, WANG Yunkang1, LONG Jun3, JIN Liang1, CAO Rongyue1
( 1.School of Life Science and Technology, China Pharmaceutical University, Nanjing 210009, China; 2.Js Bioway Pharmaceutical Co., LTD,Changzhou 213000, China; 3. School of Life Science and Technolog, Nanjing University of Chinese Medicine, Nanjing 210046, China)
Objective: To optimize and express the gene of recombinant porcine trypsinogen, and to detect the specifc activity after purifcation. Methods: The aynthetic porcine-recombination trypsinogen gene, of which the rare codon was substituted, was inserted into pET28a and then transformed into E.coli BL21(DE3). Porcine-recombination trypsinogen was obtained in the inducement of lactose. The target protein by using anion exchange chromatography was purifed and its activity was detected with UV spectrophotometer. Results: The inactive inclusion body of porcinerecombination trypsinogen was obtained. From the result of SDS-PAGE, its relative molecular mass met the expectation, and the specifc activity achieved 513.09 U•mg-1after purifcation. Conclusion: The porcine-recombination trypsin was successfully obtained, which had the better specifc activity. It is important to raise awareness of recombination trypsin and industrial production.
recombinant trypsin; denaturing of inclusion body; induction of lactose; dilution method
Q556+.3
B
1001-5094(2014)12-0916-06
接受日期:2014-11-10
项目资助:国家级大学生创新创业训练计划项目(No.J1030830);国家自然科学基金(No.81172973;No.81373232)
*通讯作者:曹荣月,副教授,硕士生导师;
研究方向:微基因药学;
Tel:025-83271242;E-mail:caorongyuenanjing@126.com
