炎症标记物与缺血性中风预后评价
2014-03-13王艺璇冉桂梅严颐丹江慧勇何华柳晓泉
王艺璇,冉桂梅,严颐丹,江慧勇,何华,柳晓泉
(中国药科大学药物代谢动力学研究中心,江苏 南京210009)
炎症标记物与缺血性中风预后评价
王艺璇,冉桂梅,严颐丹,江慧勇,何华*,柳晓泉**
(中国药科大学药物代谢动力学研究中心,江苏 南京210009)
缺血性中风触发的炎症反应是一个级联放大过程,不仅可直接对缺血脑组织造成继发性损伤,还可通过与其他病理生理通路的相互影响、相互促进,共同对缺血后脑组织造成不可逆损伤。因此,采用炎症标记物对脑缺血损伤及其预后进行评价,具有重要临床意义。临床研究发现,多炎症标记物法用于缺血性中风的诊治和预后评价比单炎症标记物法更全面、更准确,故更具明显优势。综述脑缺血引发的炎症机制、脑缺血所致炎症通路与其他病理生理通路(如氧化应激、细胞凋亡和兴奋性毒性)的关联以及炎症标记物在缺血性中风预后评价中的应用。
缺血性中风;炎症机制;炎症标记物;预后评价
中风的发生率目前在世界范围内呈逐年上升之势,其致死率和致残率在所有疾病中分别列第2和第3位[1-2]。中风又分缺血性和出血性两类,其中缺血性中风约占中风总病例数的87%[3],时刻威胁着人类健康,因此对该病的预防与诊治一直都是全球医学界研讨的热点课题。
脑缺血在发生几分钟后就会启动缺血性级联反应,其涉及一系列复杂的病理生理通路,如兴奋性中毒、氧化应激、炎症以及细胞凋亡等,这些机制性事件在不同时期发生,彼此联系,相互作用,最终导致缺血核心区域的不可逆损伤[4]。不过,缺血核心区周围存在一个缺血边缘区,此区域虽然有损伤,但并未发生细胞死亡,如果及时给予正确的治疗,可逆转脑组织损伤,而此区域恰恰是局部缺血引起的炎症发生部位。研究证明,炎症反应是脑缺血继发性损伤的关键性机制之一。因此,探讨缺血后炎症发生机制以及合理利用炎症标记物,对脑缺血损伤及其预后的评价也就显得尤为重要。然而,缺血触发的炎症反应是一个涉及到多条炎症通路变化的复杂过程,可引起体内多种炎症生物标记物水平的改变。所以,对临床缺血性中风进行预后评价时,采用多炎症标记物评价法比单个标记物评价法更具明显优势,能提高评价的准确性。本文主要根据文献报道,对脑缺血引发炎症的机制、脑缺血所致炎症通路与其他病理生理通路的关联以及炎症标记物在缺血性中风预后评价中的应用作一综述。
1 脑缺血引发的炎症机制
1.1 炎症发生发展过程
脑缺血触发的炎症级联反应是一个极为复杂的过程,涉及多条炎症途径以及多种炎性细胞和炎症介质。脑缺血引起的急性炎症反应是以脑组织内小胶质细胞和星形胶质细胞的激活以及外周血白细胞,包括中性粒细胞、单核细胞与淋巴细胞浸润脑实质为特征[5]。
脑缺血后,脑部出现能量代谢障碍、钙超载及细胞线粒体功能受损而诱发大量自由基产生,活性氧簇(ROS)则能激活小胶质细胞和星形胶质细胞。星形胶质细胞可分泌一系列炎症因子,包括细胞因子、趋化因子和诱导型一氧化氮合酶(iNOS)。小胶质细胞是常驻脑内的巨噬细胞,而且在中枢神经系统中也是常驻免疫活性成分,并发挥着吞噬细胞的作用。由缺血激活以后,小胶质细胞转化成吞噬细胞,并释放各种有细胞毒性或细胞保护作用的物质[6]。另外,ROS能刺激缺血细胞甚至缺血神经元分泌促炎细胞因子[如肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、IL-6等]和趋化因子[如单核细胞趋化蛋白-1(MCP-1)等],而促炎细胞因子和趋化因子能上调黏附分子[如细胞间黏附分子-1(ICAM-1)和血管细胞黏附分子-1(VCAM-1)]的表达,IL-6还能促使肝脏细胞分泌急性期蛋白,如C-反应蛋白(CRP)和纤维蛋白原等,CRP和纤维蛋白原则可激活体内的凝血途径,此外,CRP还可激活补体途径,以促进炎症发展。在上述因素的共同作用下,大量外周血白细胞被激活,并于内皮细胞上滚动黏附,迁移至缺血区[7]。激活的炎症细胞可释放一系列细胞毒性物质,包括更多的细胞因子、趋化因子、蛋白水解酶[如基质金属蛋白酶(MMP)]、iNOS、一氧化氮(NO)、自由基等,直接损伤血管内皮细胞,导致血脑屏障破坏,继发脑水肿、脑出血及神经元损伤,最终造成组织坏死(见图1)。同时,白细胞在脑部微血管内聚集,释放炎性介质和细胞因子,又募集更多的白细胞聚集、浸润,加重炎症反应,形成恶性循环。募集的白细胞和内皮细胞相互作用,致使白细胞黏附于血管内皮细胞,阻塞微血管,引发“无复流”现象。在脑缺血诱发的炎症过程中,炎症细胞、黏附分子、炎症介质、趋化因子等相互作用,形成所谓的炎症级联反应。
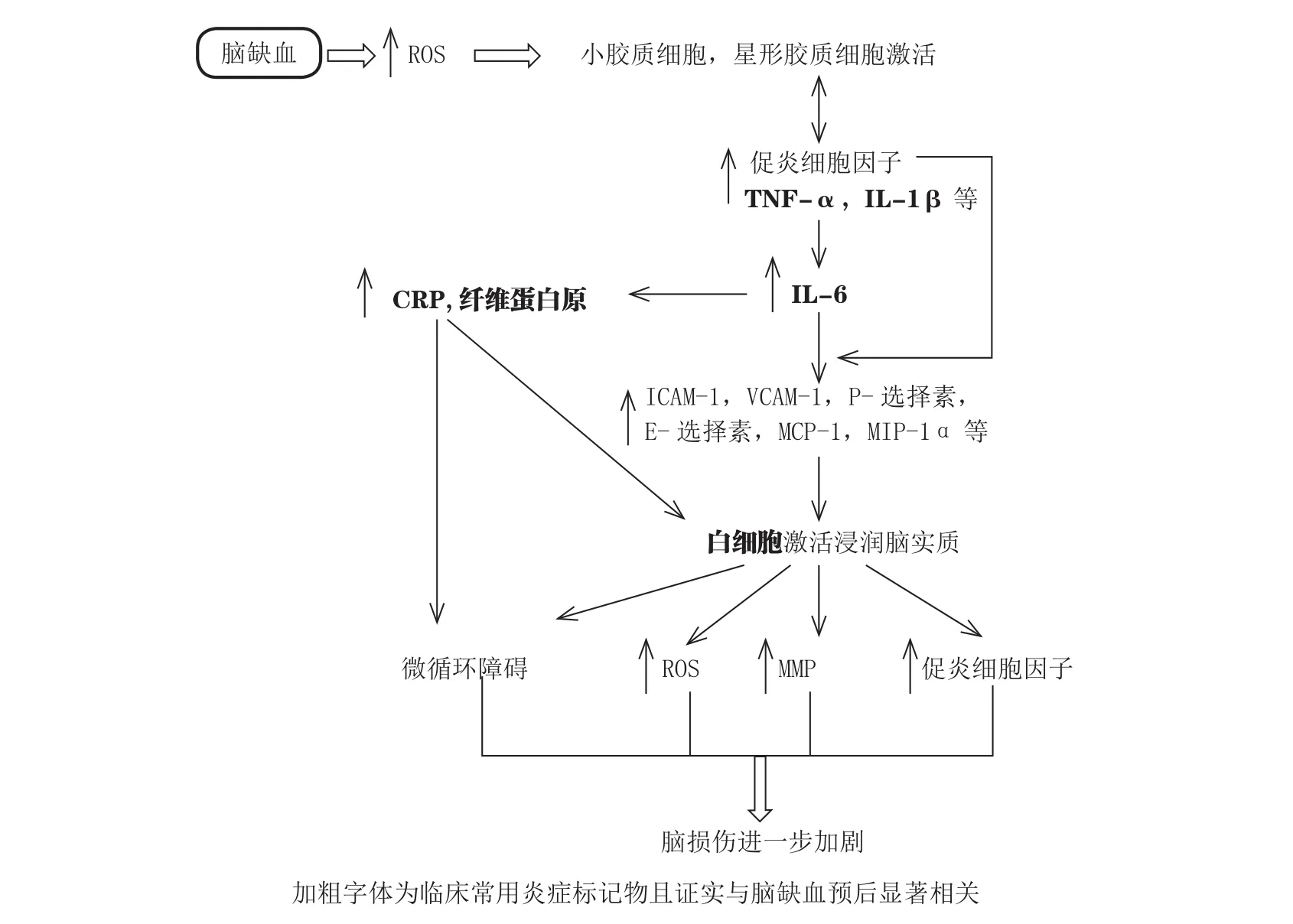
图1 脑缺血后的炎症反应及相关生物标记物Figure 1 Inflammation following ischemic stroke and the involved biomarkers
1.2 脑缺血相关炎症介质
1.2.1 促炎细胞因子
1.2.1.1 IL-1β IL-1β是一种脑缺血后炎症反应的始动细胞因子[8]。研究表明,IL-1β水平的升高与脑缺血后梗死的恶化程度相关。IL-1β在脑缺血过程中造成损伤的可能机制如下:1)促进其他细胞因子(如IL-6)的合成,加速炎症反应;2)激活磷脂酶A2,启动花生
四烯酸代谢级联反应;3)参与白细胞和小胶质细胞的激活,诱导脑微血管内皮细胞中黏附分子及化学趋化细胞因子的表达,促进白细胞浸润。
1.2.1.2 IL-6 研究表明,血清IL-6 水平是脑缺血早期临床症状加重的独立因素,且其高水平与急性脑梗患者的不良预后密切相关,故IL-6可作为临床上预测中风和评价其预后的生物标记物[9]。而另有研究显示,大鼠的IL-6基因敲除后,其脑缺血性炎症反应增强,炎性细胞浸润加剧,梗死体积加大。提示,IL-6 可能是一种神经元死亡抑制剂。IL-6发挥神经保护作用的机制可能与刺激内源性IL-1ra等缺血保护因子的产生有关[10];此外,IL-6可通过负反馈机制抑制IL-1及TNF-α的合成,并促进可溶性IL-1和TNF-α受体拮抗剂的产生,促皮质激素的分泌,从而发挥神经保护作用。
1.2.2 趋化因子
1.2.2.1 MCP-1 MCP-1是最重要的趋化因子之一,脑缺氧后可由神经元、小胶质细胞和内皮细胞合成分泌,并趋化单核细胞、噬中性粒细胞和巨噬细胞至梗死区。据报道,MCP-1基因敲除的小鼠在发生脑缺血后,只呈现较小的梗死面积,且白细胞的浸润过程受阻,一些炎症分子(如IL-6、IL-1β等)的表达水平整体下调。而研究发现MCP-1与血脑屏障的破坏有关[11],这可能是由于MCP-1参与调控通过血脑屏障的水泡的形成及运输,进一步破坏血脑屏障,造成继发性脑水肿[12]。
1.2.2.2 MIP-1 MIP-1为巨噬细胞炎性蛋白,其中MIP-1α可通过趋化和激活单核细胞、T淋巴细胞、巨噬细胞及中性粒细胞,促使其聚集并产生TNF-α、IL-1和IL-6,释放活性氧、蛋白水解酶等,间接引起中性白细胞聚集。此外,MIP-1α可作为内生致热源而引起发热,加重卒中后脑损伤[13-14]。
1.2.3 黏附分子
1.2.3.1 选择素 选择素在白血球与缺血性脑微血管内皮细胞相互作用的早期(滚动黏附阶段)发挥重要作用,其有3种类型:L-选择素、P-选择素和 E-选择素,不同类型的选择素在此阶段发挥不同的作用。在缺氧缺血性脑病患者中进行的实验研究显示,给予抗E-选择素单克隆抗体后,对中性粒细胞招募至脑实质无显著影响,但阻断P-选择素产生时,白细胞募集程度被抑制了85%,表明E-选择素的作用弱于另外两种选择素[15]。1.2.3.2 免疫球蛋白超家族 在免疫球蛋白超家族中,与缺血性脑血管病关系密切且研究最多的主要有ICAM-1和VCAM-1。在体内,正常情况下,ICAM-1很少表达或不表达,但在一些病理情况下,其在内皮细胞中的表达上调,且一旦发生缺血,ICAM-1的表达会在数小时内升高。相比于健康人,急性缺血性中风患者体内有较高水平的可溶性ICAM-1,并且,死亡患者体内的可溶性ICAM-1水平更是显著高于存活患者[16]。
1.2.3.3 整合素 白细胞移行完成后,为了与内皮达到稳固的黏附,需要激活白细胞分泌的整合素和内皮细胞黏附分子之间的相互结合,且整合素必须结合到发炎的内皮细胞中表达的免疫球蛋白超家族受体上,包括ICAM-1、ICAM-2、VCAM-1以及晚期糖基化终产物的受体上。
以上炎症介质在脑缺血引发的炎症过程中发挥着不同的作用,它们能启动或增强不同的炎症通路,共同促进炎症的发展。由图1可知,不同炎症因子的作用不是孤立的,它们之间通过直接或间接的关系相互影响。
2 脑缺血所致炎症通路与其他病理生理通路的关联
脑缺血导致脑组织坏死的机制是一个复杂的病理生理过程。脑血流中断可造成脑组织缺血缺氧,同时又可能存在着血流对脑组织的再灌注,这均会使脑组织细胞产生损伤级联反应,包括能量代谢障碍、梗死周围缺氧去极化、钙超载、兴奋性氨基酸毒性、氧化应激损伤、炎症反应及细胞凋亡等,这些损伤级联反应发生在脑组织损伤的不同时期,却又彼此重叠,并相互联系,相互作用,且各自造成的脑损害互为因果,形成恶性循环,最终累加而造成脑组织的不可逆损伤。前面探讨了炎症在缺血后的发展过程以及不同炎症因子所发挥的作用,但是,炎症在脑缺血过程中不是孤立的存在与发展的,它会受到其他各种病理生理通路的影响,同时炎症的发生发展过程也会相应地影响到这些通路。
2.1 炎症与氧化应激
氧化应激是指机体在受到各种有害刺激时,体内会产生大量的高活性分子,如ROS和活性氮自由基(RNS),其产生速度超过了氧化物的清除速度,氧化系统和抗氧化系统失衡,导致组织损伤[17]。大量研究表明,氧化应激是脑缺血损伤发生发展和引起缺血级联反应的重要原因之一,其促进缺血半暗带发展,是造成脑缺血后不可逆损伤的主要因素。
ROS/RNS能诱导细胞和血管结构的过氧化、蛋白质氧化、DNA断裂和线粒体电子传递链损伤等[18]。ROS可通过直接下调紧密连接蛋白的表达,间接激活MMP,从而破坏血脑屏障。而氧化应激激活的MMP和水通道蛋白能水解位于血管上和血管周围的蛋白,促进血管或细胞水肿,使血脑屏障的破坏进一步加剧[19]。血脑屏障的破坏则能加速免疫细胞在脑实质的渗透和累积,导致炎症反应的发展。ROS还可通过诱导丝裂原活化蛋白激酶(MAPK)和核转录因子-κB (NF-κB)活化,调节多种促炎蛋白的表达[20]。研究发现,氧化应激水平升高时,NF-κB在神经元细胞中的表达增加,并伴有明显的神经损伤。说明,氧化应激可通过启动NF-κB介导的信号通路而发挥神经损伤作用[21]。NF-κB是调节炎症反应的中枢环节,也是细胞内信号转导途径的中间枢纽,其被激活后,可诱导细胞因子、黏附因子、MMP、iNOS、环氧化酶-2(COX-2)等的表达,促进炎症发展[22]。
在炎症发生发展的过程中,激活的小胶质细胞和星形胶质细胞是通过释放由NADPH氧化酶催化产生的ROS、细胞因子等细胞毒性物质来发挥脑损伤作用的。经研究证实,脑缺血后产生的炎症因子是胶质细胞表达iNOS的强烈刺激因素,而由此产生的大量NO则通过与超氧化物结合产生过氧化亚硝酸根离子(ONOO-)而发挥脑损伤作用。说明,炎症发展的同时,会促使氧化应激水平也随之升高。外周血白细胞进入并浸润脑部,被激活后可生成和释放大量的细胞毒性物质,其中包括iNOS、NO、自由基等。另外,花生四烯酸代谢为经典的炎症损伤通路之一,其主要代谢产物为炎性介质和过氧化物,其中COX能催化产生大量的过氧化物,而花生四烯酸的重要代谢产物前列腺素和白细胞三烯(白三烯)类物质则可引发炎症反应和启动凝血过程。体内的另一种物质——髓过氧化物酶(MPO)为具有促炎作用的氧化酶,在发炎组织中由激活的中性粒细胞和单核细胞分泌,在细胞化学上,一般将这种酶作为中性粒细胞浸润的指标,其功能为将过氧化氢转变为次氯酸,且在炎症状态下,其被释放进入细胞外液,参与低密度脂蛋白(LDL)的脂类氧化[23]。
综上可见,在脑缺血性疾病的进程中,炎症和氧化应激是密切相关并相互影响的,共同导致了脑损伤的加剧。
2.2 炎症与细胞凋亡
脑缺血发生后,缺血中心区神经细胞的死亡形式以坏死为主,而缺血半暗带神经细胞仍然具有代谢活力,其后续的死亡形式以凋亡为主。脑缺血后细胞的凋亡通路主要有3条:线粒体介导的凋亡通路、死亡受体介导的凋亡通路和非caspase依赖性凋亡通路—— PARP-1/AIF通路。
脑缺血后引发的炎症和细胞凋亡是相互关联及相互依存的[24]。炎症反应能导致细胞凋亡的发生,据报道,用黏附分子的抗体进行干预,能减弱缺血后炎症,并能减少细胞凋亡,说明,炎症的发展可诱导细胞凋亡(Dirnagl等, Trends Neurosci, 1999年)。众所周知,caspase家族包括具有不同作用机制的两个主要子族,一个可参与炎症的发展,另一个则参与细胞凋亡,而caspase-1、caspase-11和caspase-12则在两种机制中都发挥重要作用。caspase-1主要是通过对pro-IL-1β加工处理使之成为成熟的IL-1β而发挥促炎作用[25],且经证实,caspase-1 也直接参与神经细胞的死亡过程。据报道,抗炎药齐留通(Zileuton)能通过减弱NF-κB的激活、iNOS的表达以及细胞因子的释放,抑制缺血后的炎症反应,并主要通过抑制caspase-1和caspase-3的表达,实现对神经细胞凋亡的抑制作用,由此可见,齐留通可能通过抑制炎症反应而发挥神经保护作用,且根据caspase-1和炎症的关系,它也可能是通过下调caspase-1来抑制炎症反应[26]。
上述研究表明,NF-κB在炎症反应和细胞凋亡过程中均发挥重要作用,其参与多种凋亡相关基因的转录调节,具有抑制和促进细胞凋亡的双向作用[27]。缺血发生后,NF-κB被各种刺激因素激活,同时在炎症及细胞凋亡过程中发挥不同的作用,而炎症与细胞凋亡也通过关键性调节因子NF-κB,相互影响,相互作用。炎症反应是先天性免疫的一部分,能将坏死组织从缺血区移除。据报道称,由缺血再灌注引起的细胞凋亡反应能导致炎症细胞在缺血组织内聚集,促使缺血后炎症反应的发展[28]。凋亡细胞的清除是通过抗炎途径完成,而细胞凋亡后会产生某种信号并传递给吞噬细胞,引起炎症反应。另外,发炎组织内浸润的中性粒细胞及其释放的细胞毒性物质主要是通过凋亡途径而被激活的巨噬细胞所吞噬,促进中性粒细胞凋亡,则可缓解炎症反应所带来的神经毒性及脑损伤作用[29]。
2.3 炎症与兴奋性毒性
脑缺血后,在多种刺激的共同作用下,谷氨酸大量释放,释放的谷氨酸结合到相应受体上,致使钙通道打开,而在不同的谷氨酸受体中,N-甲基-D-天冬氨酸(NMDA)受体在兴奋性毒性中发挥最重要的作用。钙离子内流进入神经元,引起迟发兴奋性毒性。
中枢神经系统的损伤或炎症能刺激谷氨酸大量持续的释放,导致神经元细胞内钙离子水平升高,产生迟发兴奋性毒性[30]。另外,脑缺血所致钙超载的危害是多方面的,其中诱发炎症反应和细胞凋亡是主要方面,钙超载会刺激星形胶质细胞分泌炎性细胞因子IL-1β、IL-6和TNF-α等,加重炎症反应。钙离子内流可能通过钙离子依赖性蛋白激酶C而引发基因表达的改变,导致激活压力调节蛋白激酶(SAPK)和NF-κB。而且,钙超载能激活磷脂酶A和C,使膜磷脂降解,产生大量游离的脂肪酸,并导致花生四烯酸代谢加剧,产生大量氧自由基和炎性介质,加重细胞损害,且生成的血栓素和白三烯还可激活血小板,在缺血区形成微循环障碍,扩大梗死范围,加重脑损害。
综上所述,脑缺血过程中炎症的发生发展并不是孤立的,它与氧化应激、细胞凋亡和兴奋性毒性密切相关,尤其与氧化应激的关系最为密切,炎症和氧化应激两条通路相互影响,相互促进,共同导致脑缺血不可逆损伤。因此,对脑缺血炎症的研究不应局限于单纯的炎症通路,更应结合其他关联通路,用整体的思路开展研究。
3 炎症标记物在缺血性中风预后评价中的应用
以上介绍了脑缺血后炎症的发生机制及炎症通路和其他病理生理通路的相互作用,可见脑缺血后的炎症反应是导致脑缺血继发性损伤的关键机制之一。例如,脑缺血发生后,迅速发展的炎症反应会导致继发性脑水肿,严重威胁患者的生命安全[31]。炎症不仅直接参与脑损伤,而且与其他损伤通路相互关联,相互促进,共同导致不可逆转的脑组织损伤。因此,在脑缺血发生以后,采用炎症标记物对病情进行评价,不仅可为临床诊疗提供依据,还可提供一些预测及预后信息,具有重要的临床意义。
3.1 单炎症标记物的独立应用
目前,炎症标记物已作为缺血后中风的有效预测指标而广泛应用于临床诊断,其中TNF、IL-1和IL-6是众多炎症因子中研究较多的,它们也是未来治疗中风的潜在靶点。这3种细胞因子能调节啮齿类动物脑缺血后的梗死面积,在中风患者血液和脑脊液中的水平也会升高[32-33]。血浆IL-6的峰浓度与急性缺血性中风早期的严重程度显著相关,可作为脑缺血早期对疾病神经学功能评价的独立因素[34]。IL-6作为促炎细胞因子,能促进肝脏细胞分泌急性期蛋白,如CRP和纤维蛋白原。据报道,循环系统中CRP浓度的升高和急性缺血性中风患者的脑梗死程度显著相关。研究显示,血清CRP水平可独立用于预测中风发生后的复发性血管事件和死亡率[35-36]。纤维蛋白原及其降解产物能调节炎症反应,纤维蛋白原通过CD11b/CD18能激活促炎细胞因子(如NF-κB)通路, 而NF-κB通路的激活又能导致一系列炎症因子的产生,如TNF-α和 IL-1β。血浆中纤维蛋白原水平的持续升高与脑缺血发生后的不良预后显著相关[37]。
3.2 多炎症标记物的联合应用
脑缺血触发的炎症反应是一个十分复杂的生理病理过程,炎症的发生发展涉及到多条生理病理通路的变化,可引起体内多种炎症生物标记物水平的改变。同时,不同的炎症标记物也发挥不同生理功能,它们能启动或增强不同的炎症通路,共同促进炎症的发展。临床上对于复杂性疾病的诊断与预测通常采用“多标记物法”。例如,Kliper等[38]对368名首次发生轻微中风的患者进行研究时,通过同时测定患者的红细胞沉降速率(ESR)、CRP、纤维蛋白原、白细胞计数等炎症标记物,对患者脑缺血后的认知功能和海马区体积进行预测与评价。Whiteley等[39]对817名急性脑梗患者进行研究时,也选择炎症因子IL-6、CRP和纤维蛋白原以及白细胞计数等为炎症标记物,考察其与复发性血管事件的关联性。结果表明,应用IL-6、CRP与纤维蛋白原共同评价和预测中风后复发性血管事件的效果较好。
3.3 炎症标记物与其他病理生理通路标记物的联合应用
临床上,炎症标记物不仅可单独使用还可与其他病理生理通路的代表性标记物联合使用,用于评价或预测脑缺血性疾病的发生发展。Whiteley等[40]对270名急性缺血性脑血管病患者进行了研究,这些患者均在症状出现24 h内被招募,其间所监测的血浆标记物涉及4个方面:1)炎症标记物:脂联素(adiponectin)、CRP、IL-6、IL-10、MMP-9、TNF、血管假性血友病因子(von Willebrand factor)和白细胞计数;2)血栓形成标记物:D-二聚体、纤维蛋白原和组织型纤溶酶原激活物(t-PA);3)心肌应变标记物:N末端脑钠肽前体(NT-proBNP)和肌钙蛋白I (TnI);4)脑损伤标记物:tau蛋白、S100β和肌酐。该项研究将这些标记物与3个月后的预后结果进行多元线性回归分析,分析不同标记物与预后结果的相关性。
总之,上述大量研究实例表明,炎症标记物用于脑缺血预后的评价,具有重要的临床价值。单个炎症标记物可以作为独立评价指标应用于临床,而多个炎症标记物联合应用比单标记物法更具明显优势,它能对疾病提供足够有效的预测及预后信息,提高评价的准确性。因此,多炎症标记物法的使用将为脑缺血预后的评价提供新的思路。目前,临床上常用的炎症标记物主要包括CRP、TNF-α、IL-6、IL-1、纤维蛋白原和白细胞计数等,至于何种标记物能够对疾病的预后进行最准确的评价,不仅需要考虑中风后的不同时期,还需通过有效的数据分析手段筛选出最具临床价值的炎症标记物组合。
3.4 炎症标记物的选择
用于脑缺血预后评价的炎症标记物很多,但是由于不同的炎症分子在脑缺血的发生发展过程中所发挥的病理作用不同,所以炎症标记物的选择并不是随机的,与评价所涉及的缺血后不同时期有关。如前述Kliper等[38]对首次发生轻微中风的患者进行连续分析评价,分别于入院时(作为基准)、6个月后和1年后对患者的ESR、CRP、纤维蛋白原和白细胞计数进行测定,同时检测认知功能和海马区体积。结果发现,患者的CRP水平在刚入院时显著高于6个月及1年后的水平,而ESR水平在入院后的1年内无明显变化,这反映了慢性的炎症过程。且相关性分析显示,只有ESR水平和减小的海马区体积及认知功能显著相关。另外,炎症标记物的选择与中风后所导致的不良事件有关。如上述Whiteley等[39]选择4种炎症标记物——IL-6、CRP、纤维蛋白原和白细胞计数,对急性脑梗患者进行了长达4年的研究,其间还统计了患者中风后的复发性血管事件、死亡数(包括复发后血管性死亡、首次中风死亡及其他原因死亡)。结果显示,IL-6、CRP和纤维蛋白原与患者死亡数的相关性比与复发性血管事件的相关性更强,而白细胞计数则与复发性血管事件有更强的相关性。
可见,如果对中风后短期预后进行评价,应选择急性期炎症因子(如CPR、IL-6等)作为标记物;若对中风进行长期预后评价,则应选择慢性炎症标记物,如ESR等。但是,对不同的脑缺血后事件进行预后评价时,如何选择炎症标记物作为脑缺血预后的评价指标,目前尚无定论,只有根据脑缺血后病情的具体发展过程,运用合适的数据分析方法筛选出与疾病发展及脑缺血损伤最为相关的炎症标记物作为评价指标,才能对相应脑缺血预后作出准确的评估。临床考察中通常利用回归模型来筛选与疾病显著性相关的炎症标记物或标记物组合,用于脑缺血的预后评价,其中最为常用的回归模型为逐步回归(stepwise regression )[41-43]、多元回归(multivariable regression)[40,44]、Logistic 回归与Cox回归等[45]。
4 结语
临床研究表明,脑缺血诱导的炎症级联反应是一个非常复杂的病理生理过程,其发生发展涉及多条炎症途径及不同的炎性细胞和炎性介质,是导致脑缺血继发性损伤的关键性机制之一;炎症不仅直接参与脑损伤,而且与其他损伤机制相互联系,相互促进,共同导致不可逆转的脑组织损伤。且大量临床研究显示,炎症标记物在缺血性中风的诊断和预后评价中可提供重要信息,而多炎症标记物评价法较单炎症标记物评价法更具有明显优势,脑缺血发生以后,采用多个炎症标记物对缺血损伤进行评价,不仅可为临床诊疗提供依据,还可对缺血预后进行较为准确的评估。然而,目前在对缺血后的脑损伤程度进行预测和评价时,面对大量的炎症标记物,如何选用合适的炎症标记物或其组合作为指标,仍有待进一步的临床研究和探索。
[1]Ma Y, Li Y, Zhang C, et al. Neuroprotective effect of 4-methylcyclopentadecanone on focal cerebral ischemia/reperfusion injury in rats[J]. J Pharmacol Sci, 2014, 125(3): 320-328.
[2]Rosado-de-Castro P H, Pimentel-Coelho P M, Barbosa da Fonseca L M, et al. The rise of cell therapy trials for stroke: review of published and registered studies[J]. Stem Cells Dev, 2013, 22(15): 2095-2111.
[3]潘红, 孙芳玲, 王文. 缺血性脑卒中的治疗药物及其有效治疗时间窗的研究进展[J]. 中国康复理论与实践, 2013, 19(3): 201-203.
[4]Iadecola C, Anrather J. Stroke research at a crossroad: asking the brain for directions[J]. Nat Neurosci, 2011, 14(11): 1363-1368.
[5]Huang J, Li Y, Tang Y, et al. CXCR4 antagonist AMD3100 protects blood–brain barrier integrity and reduces infammatory response after focal ischemia in mice[J]. Stroke, 2013, 44(20): 190-197.
[6]Brouns R, De Deyn P P. The complexity of neurobiological processes in acute ischemic stroke[J]. Clin Neurol Neurosurg, 2009, 111(6): 483-495.
[7]Wang Q, Tang X N, Yenari M A. The inflammatory response in stroke[J]. J Neuroimmunol, 2007,184(1/2): 53-68.
[8]Li H, Yin J, Li L, et al. Isofurane postconditioning reduces ischemiainduced nuclear factor-κB activation and interleukin 1β production to provide neuroprotection in rats and mice[J]. Neurobiol Dis, 2013, 54: 216-224.
[9]Zeng L, Wang Y, Liu J, et al. Pro-inflammatory cytokine network in peripheral infammation response to cerebral ischemia[J]. Neurosci Lett, 2013, 548: 4-9.
[10]Huang J, Upadhyay U M, Tamargo R J, et al. Infammation in stroke and focal cerebral ischemia[J]. Surg Neurol, 2006, 66(3): 232-245.
[11]Strecker J K, Minnerup J, Schütte-Nütgen K, et al. Monocyte chemoattractant protein-1–deficiency results in altered blood–brain barrier breakdown after experimental stroke[J]. Stroke, 2013, 44(9): 2536-2544.
[12]Jin R, Liu L, Zhang S, et al. Role of infammation and its mediators in acute ischemic stroke[J]. J Cardiovasc Transl Res, 2013, 6(5): 834-851.
[13]Jiang L, Newman M, Saporta S, et al. MIP-1α and MCP-1 induce migration of human umbilical cord blood cells in models of stroke[J]. Curr Neurovasc Res, 2008, 5(2): 118-124.
[14]Cowell R M, Xu H, Galasso J M, et al. Hypoxic-ischemic injury induces macrophage inflammatory protein-1α expression in immature rat brain[J]. Stroke, 2002, 33(3): 795-801.
[15]Liu F, McCullough L D. Infammatory responses in hypoxic ischemic encephalopathy[J]. Acta Pharmacol Sin, 2013, 34(9): 1121-1130.
[16]Hadi N R, Hasan A M, Al-Hassani Z K, et al. Magnesium sulfate ameliorates cerebral ischemia reperfusion injury via interfering with inflammatory and oxidative pathways[J]. Am J Biomed, 2014, 2(9): 1079-1094.
[17]王钊, 黄雨蒙, 彭军. 氧化应激与脑缺血-再灌注损伤[J]. 国际病理科学与临床杂志, 2012, 4(2): 343-346.
[18]Cornelius C, Crupi R, Calabrese V, et al. Traumatic brain injury: oxidative stress and neuroprotection[J]. Antioxid Redox Signal, 2013, 19(8): 836-853.
[19]Abdul-Muneer P M, Chandra N, Haorah J. Interactions of oxidative stress and neurovascular infammation in the pathogenesis of traumatic brain injury[J]. Mol Neurobiol, 2014 May 28. [Epub ahead of print].
[20]Collino M, Aragno M, Mastrocola R, et al. Modulation of the oxidative stress and infammatory response by PPAR-γ agonists in the hippocampus of rats exposed to cerebral ischemia/reperfusion[J]. Eur J Pharmacol, 2006, 530(1/2): 70-80.
[21]张仁云, 李申, 刘丹. 氧化应激调控的神经细胞NF-kB表达[J]. 山东医药, 2011, 51(1): 90-92.
[22]何姜. 转录因子NF-κB 生物特性及应用前景[J]. 医学综述, 2009, 15(14): 2098-2100.
[23]Klebanoff S J. Myeloperoxidase: friend and foe[J]. J Leukoc Biol, 2005, 77(5): 598-625.
[24]Boyajyan A, Tsakanova G, Sim R. Collectins, C3 complement protein, annexin V and C-reactive protein in acute ischemic stroke: interrelation and implication to upregulated apoptosis and infammation [J]. Infamm Cell Signaling, 2014, 1: e82.
[25]Denes A, Lopez-Castejon G, Brough D. Caspase-1: is IL-1 just the tip of the ICE berg? [J]. Cell Death Dis, 2012, 3: e338.
[26]Shi S, Yang W, Tu X, et al. 5-Lipoxygenase inhibitor zileuton inhibits neuronal apoptosis following focal cerebral ischemia[J]. Infammation, 2013, 36(6):1209-1217.
[27]栾巍, 胡晓冬. 核转录因子-kappa B与炎症和凋亡的关系[J]. 内蒙古医学杂, 2010, 42(5): 48-50.
[28]Culmsee C, Zhu C, Landshamer S, et al. Apoptosis-inducing factor triggered by poly(ADP-ribose) polymerase and bid mediates neuronal cell death after oxygen-glucose deprivation and focal cerebral ischemia[J]. J Neurosci, 2005, 25(44):10262-10272.
[29]Jin R, Yang G, Li G. Infammatory mechanisms in ischemic stroke: role of infammatory cells[J]. J Leukoc Biol, 2010, 87(5): 779-789.
[30]Nguyen L, Kaushal N, Robson M J, et al. Sigma receptors as potential therapeutic targets for neuroprotection[J]. Eur J Pharmacol, 2014, 743(15): 42-47.
[31]Thrane A S, Thrane V R, Nedergaard M, et al. Drowning stars: reassessing the role of astrocytes in brain edema[J]. Trends Neurosci, 2014, 37(11): 620-628.
[32]Whiteley W, Jackson C, Lewis S, et al. Infammatory markers and pooroutcome after stroke: a prospective cohort study and systematic review of interleukin-6[J]. PLoS Med, 2009, 6(9): e1000145.
[33]Lambertsen K L, Biber K, Finsen B, et al. Infammatory cytokines in experimental and human stroke[J]. J Cereb Blood Flow Metab, 2012, 32(9): 1677-1698.
[34]Smith C J, Emsley H C, Gavin C M, et al. Peak plasma interleukin-6 and other peripheral markers of infammation in the frst weekof ischaemic stroke correlate with brain infarct volume, stroke severity and long-term outcome[J]. BMC Neurol, 2004, 4(1):1-8.
[35]Youn C S, Choi S P, Kim S H, et al. Serum highly selective C-reactive protein concentration is associated with the volume of ischemic tissue in acute ischemic stroke[J]. Am J Emerg Med, 2012, 30(1): 124-128.
[36]Abubakar S A, Okubadejo N U, Ojo O O, et al. Relationship between admission serum C-reactive protein and short term outcome following acute ischaemic stroke at a tertiary health institution in Nigeria[J]. Niger J Clin Pract, 2013, 16(3): 320-324.
[37]Swarowska M, Janowska A, Polczak A, et al. The sustained increase of plasma fibrinogen during ischemic stroke predicts worse outcome independently of baseline fibrinogen level [J]. Inflammation, 2014, 37(4): 1-6.
[38]Kliper E, Bashat D B, Bornstein N M, et al. Cognitive decline after stroke relation to infammatory biomarkers and hippocampal volume[J]. Stroke, 2013, 44(5): 1433-1435.
[39]Whiteley W, Jackson C, Lewis S, et al. Association of circulating inflammatory markers with recurrent vascular events after stroke: a prospective cohort study[J]. Stroke, 2011, 42(1): 10-16.
[40]Whiteley W, Wardlaw J, Dennis M, et al. The use of blood biomarkers to predict poor outcome after acute transient ischemic attack or ischemic stroke[J]. Stroke, 2012, 43(1): 86-91.
[41]O’Donoghue M L, Morrow D A, Desai N, et al. Multimarker risk stratifcation in patients with acute myocardial infarction[J]. Circulation, 2014, 130(Suppl 2): A17350.
[42]Gialanella B, Santoro R, Ferlucci C. Predicting outcome after stroke: the role of basic activities of daily living predicting outcome after stroke[J]. Eur J Phys Rehabil Med, 2013, 49(5): 629-637.
[43]Byun E, Riegel B J, Sommers M S, et al. Abstract NS6: factors affecting uncertainty in caregivers of stroke survivors[J]. Stroke, 2014, 45(Suppl 1): ANS6.
[44]Chollet F, Tardy J, Albucher J F, et al. Fluoxetine for motor recovery after acute ischaemic stroke (FLAME): a randomised placebo-controlled trial[J]. Lancet Neurol, 2011, 10(2): 123-130.
[45]Sabatine M S, Morrow D A, de Lemos J A, et al. Multimarker approach to risk stratification in non-ST elevation acute coronary syndromes simultaneous assessment of troponin I, C-reactive protein, and B-type natriuretic peptide[J]. Circulation, 2002, 105(15): 1760-1763.
Infammatory Markers and Prognosis Evaluation of Ischemic Stroke
WANG Yixuan, RAN Guimei, YAN Yidan, JIANG Huiyong, HE Hua, LIU Xiaoquan
( Center of Drug Metabolism and Pharmacokinetics, China Pharmaceutical University, Nanjing 210009, China)
Infammatory cascade triggered by ischemic stroke can not only cause secondary ischemic brain damage directly, but also interact with other pathophysiological pathways, resulting in irreversible brain damage. Therefore the infammatory markers used in the evaluation of cerebral ischemic injury and its prognosis have important clinical significance. In clinical studies it has been suggested that the assessment with multiinfammatory markers can provide more suffcient and more accurate information on the diagnosis and prognosis of ischemic stroke than singleinfammatory marker, and thus has greater advantages. The infammatory mechanism caused by cerebral ischemia, the association of the infammatory pathway induced by cerebral ischemia with other pathophysiological pathways such as oxidative stress, apoptosis and excitatory toxicity, and the application of infammatory biomarkers in prognostic evaluation of ischemic stroke were reviewed.
ischemic stroke; infammatory mechanism; infammatory marker; prognostic evaluation
R743.31
A
1001-5094(2014)12-0897-08
接受日期:2014-11-17
*通讯作者:何华,讲师;
研究方向:药物代谢动力学;
Tel:025-83271260;E-mail:huahe827@163.com
**通讯作者:柳晓泉,教授;
研究方向:药物代谢动力学;
Tel:025-83271260;E-mail:lxq@cpu.edu.cn
