2013年美国仿制药市场发展动态(II)
2014-03-10汤森路透
汤森路透
2013年美国仿制药市场发展动态(II)
汤森路透
报告介绍了2013年第4季度各国获得简化新药申请(ANDA)批准、《药品管理档案》(DMF)申报、遭遇专利挑战的情况,以及生物仿制药市场、仿制药行业交易和相关仿制药企业的进展。
仿制药;简化新药申请;药品管理档案;专利挑战
随着美国仿制药产业的长足发展,2014年将又是一个令人振奋之年。以下是汤森路透仿制药(Thomson Reuters Generics)研究组对最新重大事件的一些思考。
2014年,基于对专利挑战诉讼案的了解和企业集团间签订的各种协议,几种最畅销仿制药将面世,包括Copaxone(克帕松)、Lunesta(舒乐安定)、Nexium(拉唑美)、Renvela/Renagel(司维拉姆)和Exforge(氨氯地平缬沙坦)。2014年将见证Actavis公司的心血管病“重磅炸弹级”药物Micardis (telmisartan,替米沙坦)的仿制药和Roxane公司已获授权的仿制药的问世。
毫无疑问,行业观察员将会密切关注2013年最高法院针对“有偿延迟”(pay-for-delay)的相关决议所造成的影响。有了法院对其定位的支持,联邦贸易委员会(Federal Trade Commission,FTC)明确表示将持续研究正在执行及新签订的“有偿延迟”协议,且将为消费者寻求适当的补助。为确保这些法定标准的推进,FTC将按照既定步骤和策略如何做出改变以及做出怎样的改变等不确定性仍然存在。
2013年仿制药行业的协议众多。协议围绕向研发业务和品牌药领域扩张(Actavis,Perrigo和Valeant公司),获得制造特殊制剂的能力(Mylan和Agila公司)以及对过剩或不再需要的制造企业(Aspen和Aurobindo公司)的持续收购。在全球各地仿制药市场的持续价格压力下,我们期待在2014年看到更多领头的仿制药公司往多样化方向发展。作为潜在收购目标,Teva和Pfizer公司所建立的产品贸易仍将受到关注。
近年来美国仿制药行业的重大变化之一是用户向仿制药生产商支付费用的制度即《仿制药用户费用法案(Generic Drug User Fee Act,GDUFA)》的建立。目前,在这新体制下,有1 300多个付费的药品管理档案(Drug Master File,DMF)可供参考。和预测的一样,印度公司以拥有约40%的付费档案而名列前茅。相反,自新法案生效后,来自中国公司的档案急剧减少。新法案的实施正迅速消除以上市为目的而提交DMF的行为,但提高了那些立足于美国市场的公司地位。
最终我们必将看到生物仿制药和美国制药市场的更大发展。针对不同生产商关于产品命名争论的大量诉讼,今年将可通过美国食品与药品管理局(FDA)解决。
在我们展望2014年之时,先来回顾一下2013年第4季度仿制药发展动态。
1 简化新药申请获批
2013年的第4季度,11个国家(地区)的42家公司共获得90项简化新药申请(ANDA)最终批准。其中,印度公司所获批准数雄居榜首,16家企业集团共获41项批准;而美国的公司紧随其后,有14家共获得29项批准(见图1)。
与之相比,2013年第4季度,12个国家(地区)的43家公司共获得104项ANDA最终批准。其中,印度15家企业集团囊括42项批准,美国则有15家公司获得29项批准。
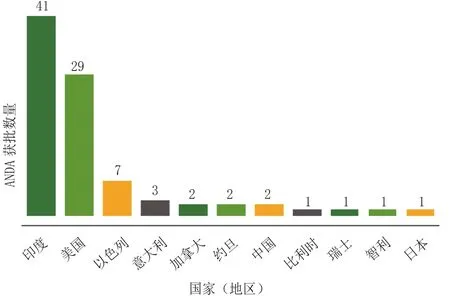
图1 2013年10—12月各申报国(地区)获得“A”级ANDA总数Figrue 1 Total ‘A’-rated ANDAs by country or region of origin of applicant for October through December in 2013
2013年第4季度,Actavis公司独占鳌头,获得8项ANDA最终批准;印度Emcure公司和以色列Teva公司并列其次,各获得7项批准(见图2)。
与之相比,2013年第3季度,印度Sun公司以10项ANDA批准而名列前茅,印度Lupin公司则以7项批准位居第2,而中国Novast公司位列第3,获得6项批准。
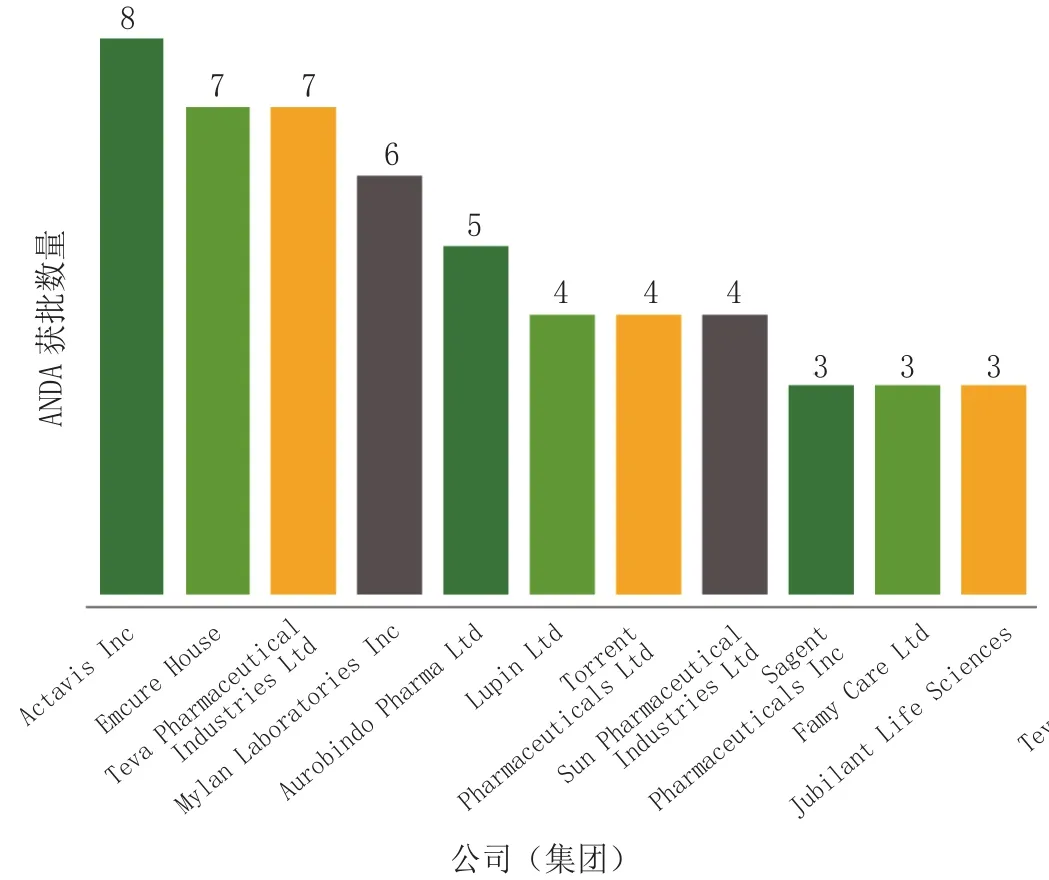
图 2 2013年10—12月获得最多“A”级ANDA批准的集团Figrue 2 Groups with the most ‘A’-rated ANDA approvals for October through December in 2013
2 药品管理档案申报
2013年第4季度末,印度公司持有有效Ⅱ类药品管理档案(DMF)数量最多,达3 077份,是美国企业(持有1 522份)的两倍多,而中国企业位列第3,持有973份(见图3)。
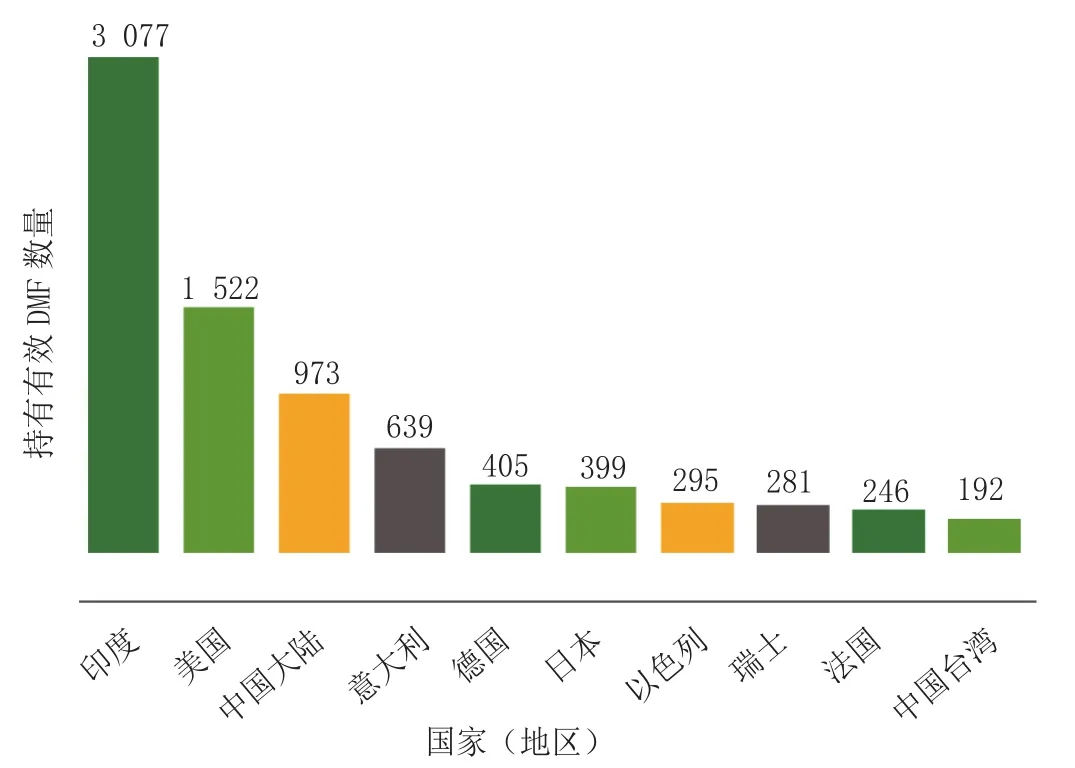
图3 截止2013年12月各国家(地区)申报有效Ⅱ类DMF的总数Figrue 3 Total active Type II Drug Master Files by country or region of origin of applicant through December in 2013
2013年12月,据FDA报道,Teva公司持有288份有效Ⅱ类DMF,依然位居第1;印度的Dr. Reddy’s 和Sun两家公司分别持有199份和191份,位居第2和第3;排名前10的公司中,印度公司就占7个(见图4)。
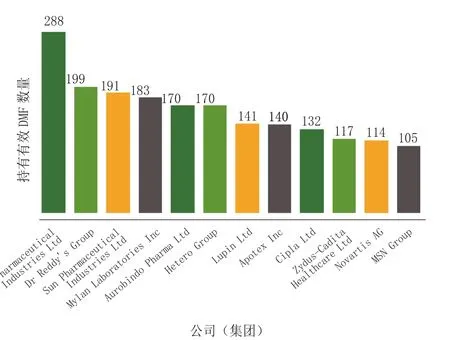
图4 截止2013年12月持有最多有效Ⅱ类DMF的集团Figrue 4 Groups with the most active Type II Drug Master Files through December in 2013
据GDUFA规定,缴纳相应用户费用后,即可进行Ⅱ类DMF的完整性评估,而一旦完成完整性评估,该 DMF就可定性为可供援引。截止2013年12月,Teva公司持有146份可供援引的 DMF,其持有量几乎是位居第2的Hetero公司(持有76份)的两倍,Aurobindo公司则持有47份而位居第3(见图5)。

图5 截止2013年12月持有最多可援引Ⅱ类DMF的集团Figrue 5 Groups with the most Type II Drug Master Files available for reference through December in 2013
3 PARAGRAPH IV 专利挑战
2013年第4季度,FDA通报2种新的原料药或复方药首次受到Paragraph IV 专利挑战,较上季度的9种挑战明显减少。
汤森路透获知2013年第4季度就有针对35种化合物或复合药而新提起的67宗Paragraph IV专利侵权诉讼,其中包括在不止一家法院提起的控诉以及早先诉讼可能涉及的 ANDA 诉讼。与之相比,2013年第3季度,有涉及44种化合物或复合药而新提起的84宗诉讼。
2013年10—12月,美国德拉瓦州地方法院是受理Hatch-Waxman诉讼最常选择的场所,共受理了33项新诉讼,而美国新泽西州地区法院以24个新诉讼成为第2常用受理地点。
Teva 公司仍是最多产的附带Paragraph IV专利认证的 ANDA 递交者,截至 2013年12月底,该公司涉及176种受挑战的化合物或复方药。Actavis 公司仍位居第2,涉及150 种受挑战的化合物或复方药。Mylan 公司和Novartis (Sandoz) 公司并列第3,均分别涉及144种受挑战的化合物或复方药(见图6)。

图6 截止2013年12月接受专利挑战最多的集团
FDA通 报 的 2013 年 10—12 月 间 首 次 受 到PARAGRAPH IV 专利挑战的化合物或复方药为乙炔雌二醇/依托孕烯(ethinyl estradiol/etonogestrel)和伊潘立酮(iloperidone)。
Warner Chilcott公司已针对NuvaRing(乙炔雌二醇/依托孕烯)阴道环递交了附带Paragraph IV专利认证的ANDAs申请。在涉及Warner Chilcott仿制NuvaRing的ANDA诉讼中,Merck Sharp & Dohme 公司宣称其侵犯了美国5,989,581号专利,这是《橙皮书》为NuvaRing列入的唯一专利。该项专利包括针对药物传送系统的权项,将于2018年4月8日到期。Gedeon Richter、Organon 和Sterling公司持有依托孕烯的有效DMF,包括Gedeon Richter和Organon公司在内的多家公司则持有乙炔雌二醇的有效DMF。
Roxane公司已针对仿制Fanapt(伊潘立酮)片剂递交了附带Paragraph IV专利认证的ANDA申请。在涉及Roxane公司仿制Fanapt片剂的ANDA诉讼中,Aventisub II和Novartis公司宣称其侵犯了美国RE39,198号专利,这是《橙皮书》为Fanapt片剂列入的唯一专利。该专利包括针对原料药、成品药及用于精神病治疗的权项,将于2016年11月15日到期。Aventisub II公司是该项专利所有人,Novartis公司持有独家许可权。Alembic、Formosa、Lupin、MSN、Mylan、Procos和Symed公司持有伊潘立酮的有效DMF。
2013年第4季度至少有一项产品受到Paragraph IV专利挑战而未经FDA通报。Par公司已针对仿制Samsca(托伐普坦)片剂递交了附带Paragraph IV专利认证的ANDA申请。Otsuka公司认为,Par公司应在FDA将其ANDA材料备案之前递交Paragraph IV专利认证。《橙皮书》目前列有2项专利涉及Samsca片剂,Par公司在诉讼中称,Otsuka公司侵犯了这2项专利。美国5,753,677号专利包括针对使用异苯并杂环(novel benzoheterocyclic)复合物(包括tolvaptan)来拮抗加压素(vasopressin)的权项,《橙皮书》指出该专利将于2015年5月19日到期,而诉讼记录中显示,Otsuka公司认为该专利将于2020年5月19日到期。美国8,501,730号专利包括针对制备异苯并杂环复合物(包括tolvaptan)的权项,该专利将于2026年9月1日到期。据FDA通报,Apotex、Hetero、MSN和浙江Huahai公司已提交了tolvaptan的DMF申请。
4 生物仿制药市场
2013年末,致力于生物仿制药的研发、生产和商业化的几家合作企业逐步走向规范化市场竞争,而其他企业正面临困境。
Coherus Bosciences公司与Baxter International合作开展有关Amgen公司Enbrel(etanercept,依那西普)仿制药的研制和商业化,于11月初宣布了临床研究的阳性结果。Coherus公司的etanercept仿制药(CHS-0214)符合美国、欧盟及日本市场的临床仿制药规范化标准,并将进入Ⅱ期临床研究,有望显示出与生物仿制候选药相似的安全性和疗效。
Coherus公司宣布上述结果的几周之后,仿制药产业巨擘Teva公司撤回了长效粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF)产品balugrastim的生物制品许可申请(BLA)。据报道,该公司需要提供更多的有关balugrastim的数据以获得FDA批准,这也促使Israeli公司撤回在美国的申报并重新评估。两周前,Teva在德国推出了另一种名为Lonquex(lipegfilgrastim)的长效G-CSF产品。
11月,美国仿制药公司Mylan宣布,其生物仿制药研制合作伙伴印度Biocon公司获得了印度药物管理部(Drugs Controller General of India)对一种trastuzumab(曲妥珠单抗)产品的批准。Biocon和Mylan两公司共享该产品在印度的经销权,且正在计划以七五折优惠价于2014年初将该品推向印度市场。根据双方达成的协议,Mylan公司享有该产品在美国、欧盟、日本、加拿大、新西兰以及其他欧洲自由贸易联盟(European Free Trade Association)成员国的独家经销权。由于曲妥珠单抗原研产品Herceptin在2015年前都收到美国专利保护,Biocon和Mylan公司的曲妥珠单抗产品几年后才有望在美国上市。因有大量的制药公司都在研制单克隆抗体仿制药,故Herceptin一旦专利失效,将会出现来自美国和世界各地的众多其仿制药竞争者。如,一家名为Hospira的公司正在与其韩国合作伙伴Celltrion公司进行曲妥珠单抗仿制药的Ⅲ期研发。
Biogen Idec公司于12月宣布将带头在欧洲进行抗肿瘤坏死因子(anti-TNF)生物仿制药(由其合作伙伴Samsung Bioepis公司研制)的商业化。目前Samsung Bioepis公司正在欧洲进行infliximab(英夫利昔)的候选仿制药SB2和etanercept(依那西普)的候选仿制药SB4的试验。Biogen Idec和Samsung Bioepis公司于2011年宣布针对生物仿制药进行初次合资开发。
瑞士Epirus GmbH公司是总部设在波士顿的Epirus Biopharmaceuticals公司的子公司,它将通过与巴西制药公司Eurofarma Laboratorios SA和Biolan Sanus Farmaceutica公司的合资公司Orygen Biotecnologia的新合作在预先支付、里程碑支付和特许支付中获利2.75亿美元。这些公司将致力于在巴西国家卫生监督局(Brazil’s National Agency of Sanitary Surveillance)对Remicade(英夫利昔)的仿制药BOW015进行注册。Epirus公司也将会把BOW015的生产技术传授给Orygen公司,供其在巴西生产。这一举措只是Epirus公司在各个药物目标市场布局策略的一部分,以便更有效地与行业巨头如Amgen公司、Pfizer公司和其他正在向生物仿制药领域迈进的大公司以及像Celltrion、Samsung Biologics等韩国公司竞争。在针对类风湿关节炎的一项成功的Ⅲ期临床试验中,Epirus公司将BOW015和Remicade对比后发现,BOW015组受试者在第16周的ARC20反应率为89.8%,而Remicade组为86.4%;且在安全性和免疫原性方面,二者无显著差异。
2013年12月,Baxter International公司经内部资产重组后,决定终止转让其开发的用于肿瘤治疗的单克隆抗体M511,且随后,Momenta制药和Baxter公司的合作出现倒退。2011年12月,这两家公司开始合作研制和上市6个生物仿制药产品,并于第2年合作开发出3个生物仿制候选药,分别是M932、M834和M511,目前两家公司仍将对M932和M834的进一步开发继续开展合作。
生物仿制药行业的先驱Sandoz公司宣布,已启动对AbbVie公司原研产品Humira(adalimumab,阿达木单抗)的仿制药进行Ⅲ期临床研究。目前,该阿达木单抗仿制候选药和Sandoz公司开发的另两个生物仿制药(依那西普和利妥昔单抗的仿制药)正处Ⅲ期临床试验阶段,而阿达木单抗仿制药的Ⅲ期临床研究将有助于其在美国和欧盟的注册。Sandoz公司已在欧盟、日本和加拿大等市场上市阿法依泊汀、非格司亭和重组人生长激素的仿制药。
据法律新闻报道,2013年11月美国加利福尼亚州北部地方法院驳回了Sandoz公司提出的针对Amgen公司原研产品Enbrel(依那西普)的专利诉讼,Sandoz本希望通过此诉讼,寻求法院判决其未侵权,而法院称Sandoz公司意欲向FDA提交申请而提出的申诉不足以立案。除非Sandoz公司在上诉中获胜,否则这个裁定清楚地表明,在美国,只有当公司提交了一份351k的申请,且当事者使用《生物价格竞争和创新法案》(Biologic Price Competition and Innovation Act)中的专利交换程序,才能实施对生物仿制药的专利挑战程序。
5 重大交易
2013年第4季度,诸多仿制药企业在继续扩大其产品知名度,使市场上仿制药和品牌药之间的界限愈加模糊,且对产品多元化和扩大公司研发能力的需求推动了仿制药领域的其他交易,而一些主要合资企业的创立将在不同程度上影响美国仿制药市场。此外,在印度制药商中,还有少量的私人股权投资交易,彰显了其对世界仿制药业的潜力持乐观态度。
5.1 合作提升产品价值
2013年10月,印度Sun制药公司宣布,与Intrexon公司成立合资企业,联合开发可控的基因疗法,用于治疗眼部疾病,如干性老年性黄斑变性(AMD或ARMD)、青光眼和视网膜色素变性。该合资企业将获得Intrexon公司的整套专有合成生物技术,并利用Sun公司的能力和经验来研制复杂剂型。
德国Pieris生物技术公司10月宣布,与印度Zydus Cadila公司达成协议,利用Pieris公司专有的Anticalin®技术,开发和上市多种新蛋白疗法。Zydus将率先推进候选药物从临床前研发进入临床研发阶段,且Zydus公司获得开发产品在印度和其他几个新兴市场的独家上市权,而Pieris公司则保留了主要发达国家市场的独家上市权。随后,印度Strides Arcolab公司的子公司Stelis Biopharma(之前的Agila Biotech公司)与Pieris公司宣布建立长期合作联盟,利用Anticalin®技术和Stelis公司强大的生物制药和临床开发优势,临床开发和上市多种新型眼治疗药物。
11月,Alvogen公司宣布,与Shionogi公司达成交易,获得375、500和750 mg Naprelan®(萘普生钠)控释片在美国的独家上市权。此外,在另一项交易中,Alvogen公司还获得Stat-Trade公司Naprelan产品NDA中的所有权利和利润。该产品将由Alvogen公司的子公司Almatica Pharma推向市场。
12月,Mylan公司宣布,已从Pfizer公司获得一种新型长效毒蕈碱拮抗剂(LAMA)化合物在全世界范围内的开发、生产和上市权,并将拥有该化合物在美国、加拿大、澳大利亚、新西兰、欧盟、欧洲自由贸易联盟成员国、印度和日本的独家上市权,且Mylan和Pfizer公司将获得该产品在世界其他地区的共同推广权。
5.2 拓展产品的研发和生产能力
2013年10月,总部设在新泽西州的Elite制药公司(Elite Pharmaceuticals)宣布与Epic Pharma公司签订了一项长达5年的产品生产和许可协议,Epic公司将拥有6种仿制药产品的独家生产权以及其他6种产品的非独家经营权,且负责所有与这些产品相关的监管和药物警戒事务,并获得许可费和里程碑付款。
11月,Par公司以1 900万美元现金和有偿付款方式购买了总部位于印度Chennai的原料药(API)开发和生产商Nuray Chemicals Private Limited公司。2013年5月,Nuray公司从Actavis公司收购了FDA批准的位于Tamil Nadu的API生产厂家。
印度片剂生产商Granules公司11月宣布,将以12亿卢比的价格收购API生产企业Auctus Pharma,从而获得Auctus公司为其提供的通过美国FDA认证的API生产基地,以支持其制剂生产部门。
12月,Alvogen公司宣布了一项协议,以约2亿美元收购台湾专业制药公司莲花制药公司(Lotus Pharmaceuticals)约67%的股份,莲花公司为其提供在台湾市场的立足点,有望为其在美国不断扩大的产品研发项目觅得机会,从而推动收益的增长。而且,Alvogen公司将通过莲花公司获FDA认证的生产设备获得较高生产效能和细胞毒素口服制剂生产能力,莲花公司则将利用此次交易的收益获得Alvogen公司的几项亚洲业务。不过,该交易尚须经股东和监管部门的批准,预计2014年2季度完成。
圣诞节过后,总部位于美国明尼苏达州的ANI制药公司宣布,以1.25亿美元现金和未来产品销售毛利润的1%从Teva制药公司收购31种已上市的仿制药产品,此交易涉及20种口服固体速释产品、4种缓释产品和7种液体产品。
5.3 联手提高产业效率
2013年11月,Royal DSM公司和私营股资公司JLL Partners宣布签订一项新合约,通过将DSM的医药产品贸易集团与药品研发和制造服务的龙头企业Patheon公司合并,成立一个集药物开发和生产于一身的机构,即这项价值26亿美元的合约将促成一个独立公司,其可提供多种产品服务,所涉及的产品包括来自北美、欧洲、拉丁美洲和大洋洲等23个地区的活性物质及药物成品。
12月,CVS Caremark公司和Cardinal Health公司决定创建一家合资企业,将两家公司的采购和供应链优势结合起来,以便更快速地从仿制药生产商手中获取产品,还可节省医疗系统的费用。该合约规定,两家公司将平等拥有该合资企业,且在此交易的10年期内,Cardinal Health将每季度支付给CVS公司2 500万美元。
5.4 在印度的投资
2013年10月,专攻非洲、亚洲和拉丁美洲市场的私营股权投资公司Actis花费4 800万美元收购了印度Symbiotec Pharmalab公司的股份。
11月,美国KKR & Co.收购公司同意投资约2亿美元购买印度Gland Pharma公司的少数股份。
12月,Blackstone投资公司宣布,将拥有的印度Emcure公司的少数股份以65亿卢比的实报价格卖给Bain Capital公司。
6 仿制药企业新动向
6.1 ANI 制药公司
如上所述(见第5部分:重大交易),ANI制药于2013年12月从Teva公司收购了31种已上市的仿制药,该交易将极大拓展该公司的仿制药产品组合。ANI公司还声称,已有几个产品正在等候FDA审批,另有其他产品也在开发中。该公司计划致力于针对疼痛、癌症和女性健康的药品以及缓释和复方产品的开发。
除了以自己的名义研发和销售药品外,该公司还擅长与数家掌握固体和液体剂型专业技术的制造商开展合作。ANI公司拥有需要特殊处置和储存的药品以及受管制药物的生产能力,比如激素、类固醇和抗肿瘤产品。2007年,ANI公司收购了位于明尼苏达州鲍德特的Solvay制药公司(Solvay Pharmaceuticals)的两个生产厂。
2013年6月,ANI公司完成了与专业制药公司BioSante的并购,后者开发的产品包括用于治疗女性性功能障碍的Libigel(transdermal testosterone gel,经皮睾酮凝胶),其自主研发的另一种经皮睾酮凝胶产品,已授权给Teva公司开展后期临床研究,并于2012年12月获得FDA批准。
6.2 Micro Labs公司
印度Micro Labs是一家综合性制药公司,为国内和国际市场生产成品制剂和API。该公司于1973年成立,在印度的制药公司中排名前20位,在30多个国家有分公司,并自称在印度拥有多个符合GMP的生产基地,能生产各种成品制剂,包括片剂、胶囊、混悬液、乳剂与溶液、粉剂、乳膏、软膏、水或水-醇凝胶、注射剂以及眼用制剂。该公司的API生产基地均符合美国和欧盟标准,公司持有几项有效的美国DMF,并计划利用其API产品,扩大其在全球市场的份额。自2005年起,Micro Labs公司已开始提供合约研究和生产服务,该项收入占该公司总收入近1/10。
Micro Labs公司在美国的产品都是在Goa和Bangalore公司最先进的FDA认证的生产厂生产。该公司拥有几项经批准的ANDA,最近获FDA批准的是2013年9月获批的UCB公司原研药Xyzal (二盐酸左旋西替利嗪)的仿制药。该公司称有20多份ANDA正在FDA审核中,且计划于2014年提交另外15份申请。因于12月份向Alcon公司通报了其就Travatan Z(曲伏前列素)滴眼液的仿制产品递交了一份附带Paragraph IV认证的ANDA,近期Micro Labs公司卷入到一场专利挑战诉讼中,但目前美国达拉华州地方法院对该专利侵权诉讼案仍悬而未决。
编译:中科院上海生命科学信息中心
江洪波 游文娟
Developing Status of American Generics Market in 2013(II)
Thomson Reuters
This article provides a comprehensive overview of ANDAs and DMFs by country of origin of applicant during the frst quarter of 2013, and groups with the most patent challenges. This includes covers markets and deals of biosimilars, these generics manufacturers are also discussed.
generics;ANDA;DMF;patent challenge
R97
A
1001-5094(2014)08-0615-06
