己烯雌酚及其代谢物在泥鳅体内的组织分布及药物代谢动力学研究
2014-03-08田秀慧薛敬林任传博徐英江刘慧慧宫向红
田秀慧,薛敬林,孙 岩,任传博,徐英江,刘慧慧,黄 会,宫向红,*
(1.山东省海洋资源与环境研究院,山东省海洋生态修复重点实验室,山东 烟台 264006;2.烟台山水海产有限公司,山东 烟台 264006)
己烯雌酚及其代谢物在泥鳅体内的组织分布及药物代谢动力学研究
田秀慧1,薛敬林2,孙 岩1,任传博2,徐英江1,刘慧慧1,黄 会2,宫向红1,*
(1.山东省海洋资源与环境研究院,山东省海洋生态修复重点实验室,山东 烟台 264006;2.烟台山水海产有限公司,山东 烟台 264006)
采用超高效液相色谱-串联质谱法,研究口服灌药给药方式下,己烯雌酚及其主要代谢物双烯雌酚在泥鳅(Misgurnus anguillicaudatus)体内的组织分布和药物代谢动力学。在(12±2)℃水温条件下,泥鳅口服灌药(以体质量计,下同)0.1、1.0、10.0 mg/kg后,其血浆、肌肉和肝脏中己烯雌酚含量-时间曲线关系符合一级吸收的二室开放动力学模型。以1.0 mg/kg为例,3 种组织中己烯雌酚峰值水平肝脏最高、肌肉次之、血浆最低,平均消除速率分别为22.46、3.32、5.05 μg/(kg·h),6、72、120 h后均降至检出限以下。双 烯雌酚在血浆、肌肉和肝脏中变化趋势与己烯雌酚基本相似,在血浆、肌肉和 肝脏中1、4、4 h达到最大浓度值,6、72、96 h降到检出限以下。采用DAS 2.0 药物代谢动力学参数计算程序,计算有关 药物代谢动力学参数。结果表明:己烯雌酚在泥鳅体内消除较快,血浆、肌肉、肝脏的含量-时间曲线下面积相差较大,说明不同组织对己烯雌酚的蓄积能力有 所差别;己烯雌酚在泥鳅体内各组织分布广,消除快。在本实验条件下,己烯雌酚在0.1、1.0、10.0 mg/kg口服灌药剂量下,建议其消除期分别定为3、5、5 d;并且水温高时可适当缩短消除期,水温低时可适当延长消除期。
己烯雌酚;双烯雌酚;泥鳅;药物代谢动力学;超高效液相色谱-串联质谱法
己烯雌酚(diethylstilbestrol,DES)和双烯雌酚(dienestrol,DS)是人工合成的非甾体雌激素物质,双烯雌酚已经被证实为己烯雌酚的代谢物[1-3],两物质均具有化学结构简单、易通过化学合成获得和成本低的特点[4-5]。在水产养殖中,其主要作用是添加到鱼类饲料中[6-9],刺激鱼类正常代谢,促进鱼类体内氮停留增加,加快鱼体内氨基酸合成蛋白质的速度,最终起到促进鱼类生长的作用[10-11]。但水产品中残留的己烯雌酚和双烯雌酚通过食物链进入人体后,会破坏人体的正常生理平衡,其对人类的危害被逐渐发现,且已被证实是一种致癌物质,严重危害人和动物的健康[12-15]。美国和欧盟已禁止使用己烯雌酚。2002年,农业部第193号公告禁止己烯雌酚在所有食用动物中使用[16-17];并在第235号公告中规定己烯雌酚在动物性食品中不得检出[18]。
目前国外对己烯雌酚代谢研究主要集中在哺乳动物[19-20],国内主要关注其毒性[21-22]。泥鳅作为我国重要的食用鱼类,不仅营养丰富,而且经济价值很高。本实验采用口服灌药法对常规养殖的泥鳅给药,在已建立的超高效液相色谱-串联质谱法测定己烯雌酚和双烯雌酚的基础上,分析己烯雌酚和代谢物双烯雌酚在泥鳅血浆、肌肉和肝脏中的组织分布和药物代谢动力学参数,以期全面了解其在泥鳅体内的残留、消除和药物动力学特征。本实验可为其他水生生物的药物代谢动力学提供参考,并为水产养殖提供科学用药依据。
1 材料与方法
1.1 材料与试剂
己烯雌酚(CAS:56-53-1)标准品、双烯雌酚(CAS:84-17-3)标准品(纯度99.5%)、内标D8-己烯雌酚(91318-10-4,纯度99.5%) 德国Dr. Ehrenstorfer公司;低分子质量肝素钠注射液(5 000 IU) 杭州九源基因工程有限公司;甲醇、乙酸乙酯、正己烷、乙腈(均为色谱纯),盐酸为优级纯,碳酸钠为分析纯,所用水为超纯水。
1.2 仪器与设备
TSQ Vantage超高效液相色谱-串联质谱仪 美国Thermo Scientific公司;Milli-Q Gradient超纯水仪、0.22 μm微孔滤膜 法国Millipore公司;TGL-10C高速离心机 上海安亭科学仪器厂;KQ-600E超声波清洗器 昆山市超声仪器有限公司;Laborota 4001旋转蒸发仪 德国Heidolph公司;N-EVAPTM112氮吹仪 美国Organomation Associates公司;HLB固相萃取小柱(60 mg,3 mL) 美国Waters公司。
1.3 方法
1.3.1 实验设计及采样程序
实验用泥鳅,体质量25~35 g,实验前抽样检查无己烯雌酚及代谢物双烯雌酚,实验前暂养3 d,每天换水1 次,期间不喂食 。挑选大小均匀、体质量正常个体进行实验。实验容器为长方形玻璃水槽(70 cm×40 cm×50 cm),连续充氧保持水中溶解氧大于5.0 mg/L,暂养期间泥鳅存活率大于95%。选择经过暂养的健康泥鳅,随机分为10 个组,每组约80 尾。
准确称量一定量己烯雌酚,用冷却的淀粉乳浊液溶解定容,并滴入少量食用色素溶液(配制方法:称取0.1 g苯酚红溶于100 mL水),使淀粉乳浊液呈红色。每尾鱼根据体质量口服相应体积己烯雌酚,按照0.1、1.0、10.0 mg/kg 3 个量口服灌药,实验过程中,记录时间,并且做好标签。具体操作方法:1 mL注射器上接长约为5 cm左右的软管,吸取适量己烯雌酚后,通到鱼的胃部,灌药后无红色液体吐出,即可作为实验用,否则弃之。每个添加量组在相同的实验条件下设置3 个重复组。分别在口服灌药后的0.1、0.25、0.5、1、2、3、4、6、8、10、12、16、20、24、48、72、96、120、144、168、192、216 h采样,每天记录水温和泥鳅的死亡情况。
对于控制室设置有流量计算机的计量系统应根据涡轮流量计的检定结果,及时修改计算机中设置的仪表系数,确保工况流量传输的准确。要根据现场工艺情况以及仪表性能,正确选择小流量切除的工况点,对于具有压力、温度传输故障自动补偿功能的流量计算机要根据工况设置压力、温度的预设值,同时要合理选取压力、温度、流量的上下限报警点,以确保流量计算机的正常运行。
血液样品采集:泥鳅用抄网捞起,用干净纱布擦干鱼体,插入鳃下心脏取血,放入离心管中(离心管事先放人少量肝素钠),混合均匀后离心,取上层血浆,置于-18 ℃保存。肌肉和肝脏样品采集:去除泥鳅内脏、皮和骨骼等,取肌肉搅碎,装入密封袋;将整个肝脏取出,装入离心管。肌肉和肝脏均置于-18 ℃保存,测定前将其在室温条件下解冻。
1.3.2 样品前处理及净化
血液样品:取适量血液样品于离心管中,加3 mL 10 g/100 mL碳酸钠溶液,20 mL乙酸乙酯,均质30 s,超声波提取10 min,离心取上清液于梨形瓶中,残渣再加入10 mL乙酸乙酯,重复提取1 次,合并上清液,于40 ℃旋转蒸发至近干,用1 mL甲醇溶解残留物,加9 mL水稀释备用。肌肉和肝脏样品:称取适量样品于离心管中,加3 mL 10 g/100 mL碳酸钠溶液,20 mL乙酸乙酯,均质30 s,超声波提取10 min,离心取上清液于梨形瓶中,残渣再加入10 mL乙酸乙酯,重复提取1 次,合并上清液,于40 ℃旋转蒸发至近干,用1 mL甲醇溶解残留物,加9 mL水稀释备用。
依次用10 mL乙酸乙酯、10 mL甲醇和10 mL pH 3.0的盐酸溶液活化HLB固相萃取小柱,取备用液过柱,控制流速不超过2 mL/min,用10 mL水-甲醇(9∶1,V/V)淋洗小柱,将固相萃取柱抽干,用10 mL正己烷淋洗小柱,将固相萃取柱抽干,最后用5 mL乙酸乙酯洗脱,控制流速不超过2 mL/min。收集洗脱液,40 ℃水浴中氮吹至近干后用流动相再次溶解,过0.22 μm滤膜,待测。
1.3.3 超高效液相色谱-串联质谱分析方法
1.3.3.1 液相色谱条件
色谱柱:Thermo C18柱(2.1 mm×100 mm,1.9 μm);流动相:甲醇和水;流速:0.25 mL/min;进样量:10 μL;柱温:35 ℃;梯度洗脱程序见表1。

表1 流动相梯度洗脱程序Table1 Program of gradient elution
1.3.3.2 质谱条件

表2 己烯雌酚和双烯雌酚母离子、子离子和碰撞能量Table2 Parent ions, product ions and collision energy of diethylstilbestrol and dienestrol
1.4 数据处理
每个时间点的测定值取重复组的平均值,采用DAS 2.0药物代谢动力学参数计算程序,在计算机上处理口服灌药后泥鳅体内的己烯雌酚含量-时间数据,计算出有关药物代谢动力学参数。
2 结果与分析
2.1 己烯雌酚及其代谢物双烯雌酚的定量分析及回收率
配制质量浓度分别为5.0、10.0、25.0、50.0、100.0、200.0 ng/mL己烯雌酚及其代谢物双烯雌酚的混合标准溶液,流动相定容,测定结果采用内标法定量,己烯雌酚标准曲线方程为y=0.632 8×10-2x-0.110 2×10-1,相关系数R2=0.993 8;双烯雌酚标准曲线方程为y=0.125 5×10-1x-0.445 9×10-2,相关系数R2= 0.990 2。上述两方程中,x代表己烯雌酚或双烯雌酚的质量浓度,y代表己烯雌酚或双烯雌酚与内标物D8-己烯雌酚的峰面积比值。需要注意的是,因己烯雌酚具有顺反结构,且其比例会因前处理条件和标准品放置时间而发生变化,且在本实验条件下,无法测定其比例,所以己烯雌酚与内标物D8-己烯雌酚的峰面积均取顺反异构体的峰面积之和。在空白泥鳅样品中添加己烯雌酚标准溶液,添加水平为0.5 μg/kg时,信噪比大于10,表明己烯雌酚检测下限可以达到0.5 μg/kg;在空白样品中添加双烯雌酚标准溶液,添加水平为1.0 μg/kg时,信噪比大于10,表明双烯雌酚定量下限可以达到1.0 μg/kg。
以空白泥鳅样品为基质,己烯雌酚在0.5、5.0、25.0 μg/kg 3 个水平,双烯雌酚在1.0、10.0、50.0 μg/kg 3 个水平分别进行方法回收率实验,每个水平组平行测定6 次,结果表明:己烯雌酚在上述3 个水平的平均回收率在74.6%~106%之间,组内相对标准偏差(n=6)在5.13%~7.89%之间;双烯雌酚在上述3 个水平的平均回收率在74.1%~90.2%之间,组内相对标准偏差(n=6)在5.62%~8.50%之间;本方法结果稳定可靠,可以用于泥鳅实际样品的分析测定。
2.2 口服灌药后己烯雌酚及其代谢物双烯雌酚在泥鳅血浆中的分布和消除
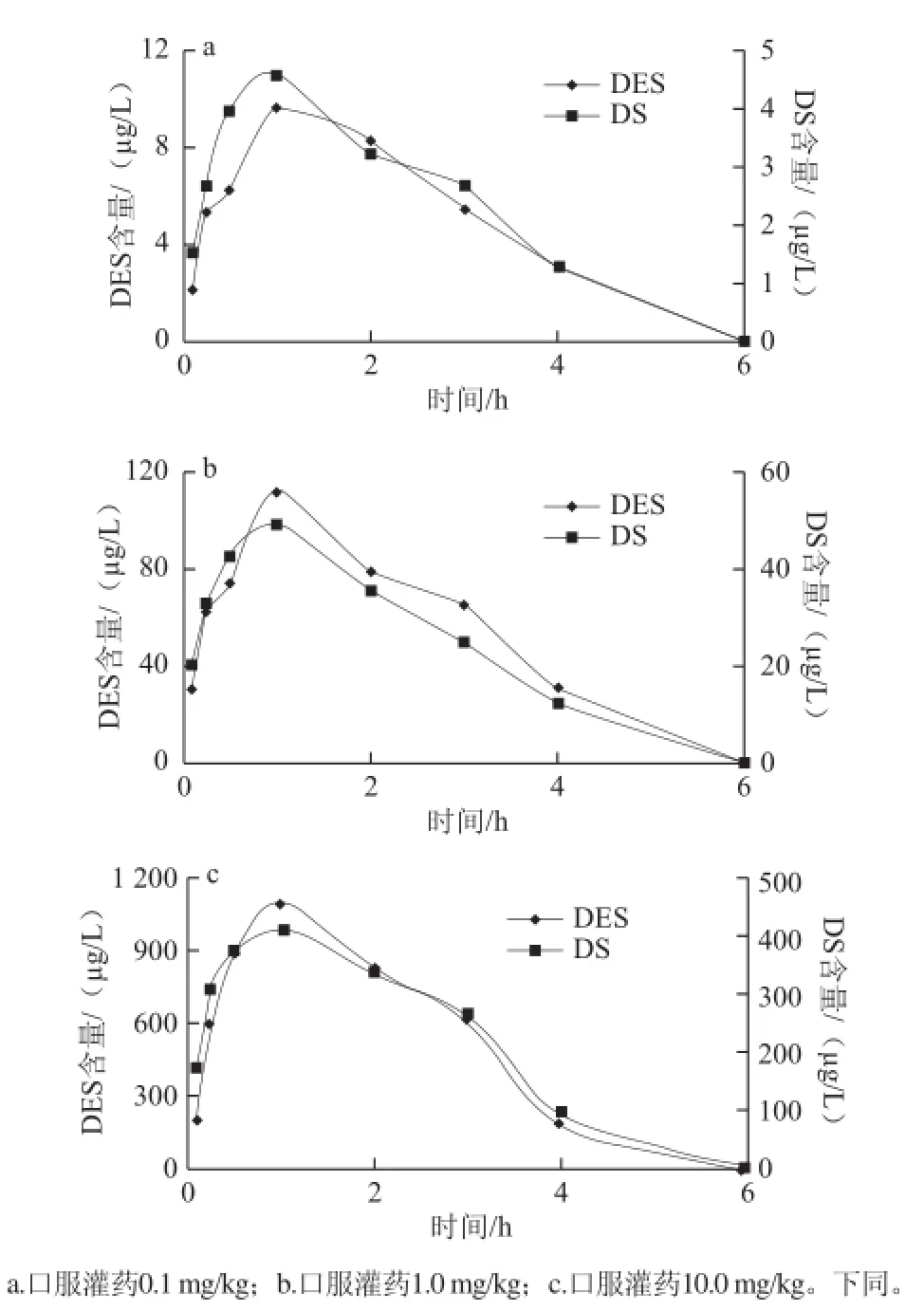
图1 口服灌药后己烯雌酚及其代谢物双烯雌酚在泥鳅血浆中的含量-时间关系Fig.1 Contents of diethylstilbestrol and its metabolite dienestrol in plasma versus time
泥鳅口服灌药0.1、1.0、10.0 mg/kg己烯雌酚后,血浆中己烯雌酚及代谢物双烯雌酚含量-时间曲线如图1所示。自口服灌药后,泥鳅体内己烯雌酚含量逐渐增大,上述3 个剂量组均在第1小时达到最大值,最大值分别为9.57、112.3、1 097 μg/L,相当于灌药剂量的0.095 7、0.112、0.110倍;随后泥鳅血浆内己烯雌酚含量逐渐减少,上述3 个剂量组均在6 h降至检出限以下,均出现前期消除速率快、后期消除速率相对减缓的趋势,己烯雌酚平均消除速率分别1.914、22.46、219.4 μg/(L·h)。代谢物双烯雌酚呈现与己烯雌酚相似的变化趋势,在给药后0.1 h检测出双烯雌酚,给药后1 h达到最大含量,分别为4.57、49.2、408 μg/L,均在6 h降至检出限以下,消除速率趋势与己烯雌酚一致,其平均消除速率分别0.914、9.84、81.6 μg/(L·h);含量越高,平均消除速率越大;双烯雌酚平均消除速率均小于相同条件下己烯雌酚的平均消除速率。
2.3 口服灌药后己烯雌酚及其代谢物双烯雌酚在泥鳅肌肉中的分布和消除

图2 口服灌药后己烯雌酚及其代谢物双烯雌酚在泥鳅肌肉中的含量-时间关系Fig.2 Contents of diethylstilbestrol and its metabolite dienestrol in muscle versus time
泥鳅口服灌药0.1、1.0、10.0 mg/kg己烯雌酚后,肌肉中己烯雌酚及代谢物双烯雌酚含量-时间曲线如图2所示。自一次口服灌药后,肌肉中己烯雌酚含量逐渐增大,上述3 个剂量组均在第4小时达到最大水平,分别为20.9、225.8、2 368 μg/kg,相当于灌药剂量的0.209、0.226、0.237 倍;随后泥鳅体内己烯雌酚含量逐渐减少,上述3 个剂量组分别在24、72、96 h降至检出限以下,均出现前期消除速率快、后期消除速率相对减缓的趋势;至实验第24小时,己烯雌酚已降至0、3.06、34.7 μg/kg,仅为最高水平的0%、1.36%和1.47%,己烯雌酚平均消除速率分别1.045、3.32、25.74 μg/(kg·h)。说明高剂量组己烯雌酚平均消除速率明显大于低剂量组;若剂量减少百分比相同的条件下,高剂量组所需时间更短。代谢物双烯雌酚呈现与己烯雌酚相似的变化趋势,分别在给药后0.5、0.1、0.1 h检测出双烯雌酚,给药后4 h达到最大含量,分别为9.03、87.3、899 μg/kg,并在24、72、96 h降至检出限以下,消除速率趋势与己烯雌酚一致,双烯雌酚平均消除速率分别0.45、1.28、9.77 μg/(kg·h)。
类似血浆,己烯雌酚及代谢物双烯雌酚在泥鳅肌肉中均出现先增高后降低的趋势。随着口服灌药剂量升高,己烯雌酚和双烯雌酚含量也逐渐上升。对于不同口服灌药剂量下的泥鳅,肌肉的消除情况与血浆中趋势相似,且相比血浆中含量,相同消除时间后,肌肉中含量高于血浆中含量。在相同灌药剂量下,己烯雌酚和双烯雌酚在肌肉中的平均消除速率均小于血浆,可能是由于代谢物易于结合泥鳅肌肉中的蛋白质,导致消除速率减慢。
2.4 口服灌药后己烯雌酚及其代谢物双烯雌酚在泥鳅肝脏中的分布和消除
泥鳅口服灌药0.1、1.0、10.0 mg/kg己烯雌酚后,肝脏中己烯雌酚及代谢物双烯雌酚含量-时间曲线如图3所示,相比较己烯雌酚在血浆及肌肉中的分布和消除,肝脏表现出明显的富集能力。自口服灌药后,肝脏中己烯雌酚含量逐渐增大,上述3 个剂量组均在第4小时达到最大值,最大值分别为50.5、585.6、6 785 μg/kg,相当于灌药的0.505、0.586、0.678 倍;随后泥鳅体内己烯雌酚含量逐渐减少,上述3 个剂量组分别在72、120、120 h降至检出限以下,均出现前期消除速率快、后期消除速率相对减缓的趋势;至实验第24小时,己烯雌酚已降至7.52、45.2、250 μg/kg,仅为最高浓度的14.9%、7.72%和3.68%,己烯雌酚平均消除速率分别为0.74、5.05、58.5 μg/(kg·h)。说明在肝脏中,高剂量组己烯雌酚消除速率明显大于低剂量组;若剂量减少百分比相同的条件下,高剂量组所需时间更短。代谢物双烯雌酚呈现与己烯雌酚相似的变化趋势,在给药后0.25、0.1、0.1 h检测出双烯雌酚,给药后4 h达到最大含量,分别为30.8、298.2、2 435 μg/kg,并在72、96、96 h降至检出限以下,消除速率趋势与己烯雌酚一致,其平均消除速率分别0.45、3.24、26.47 μg/(kg·h)。
随着己烯雌酚口服灌药剂量的升高,肝脏中己烯雌酚含量上升;这一点与血浆和肌肉中的变化趋势相同,而且在相同口服灌药剂量下,肝脏中含量是最大的。对于不同口服灌药剂量下的泥鳅,经相同消除时间后,肝脏中己烯雌酚含量最高。相比较在血浆和肌肉中的分布和消除,在泥鳅肝脏中主要表现在以下几个方面:1)在相同口服灌药剂量时,相同取样时间下,肝脏内含量要远高于血浆和肌肉中含量;2)在相同口服灌药剂量时,肝脏的平均消除速率、含量最高值以相对于灌药剂量的倍数均高于血浆和肌肉,说明其富集能力远大于血浆和肌肉;3)虽然肝脏中平均消除速率最大,但其降至检出限以下所需时间最长。

图3 口服灌药后己烯雌酚及其代谢物双烯雌酚在泥鳅肝脏中的含量-时间关系Fig.3 Contents of diethylstilbestrol and its metabolite dienestrol in liver versus time
2.5 己烯雌酚在泥鳅血浆、肌肉和肝脏中的药物代谢动力学参数
采用DAS2.0药物代谢动力学参数计算程序,处理口服灌药后泥鳅血浆、肌肉和肝脏中己烯雌酚含量-时间数据,计算有关泥鳅血浆、肌肉和肝脏的药物代谢动力学参数;取其中一组己烯雌酚含量-时间数据,用对数图进行初步判断,可见lgC与t呈双指数函数特征,因此选择二室模型。结果如表3所示。

表3 己烯雌酚在泥鳅血浆、肌肉和肝脏中的药物代谢动力学参数Table3 Pharmacokinetic parameters of diethylstilbestrol in plasma, muscle and liver off Misgurnus anguillicaudatus
t1/2β为己烯雌酚的消除相半衰期,指己烯雌酚消除到一半所用的时间,是描述泥鳅对己烯雌酚的消除快慢、决定消除程度的重要指标。在血浆中,随着口服灌药剂量的增大,t1/2β值异常,可能与实验过程中取样时间点数、软件本身的设 置程序或本实验室的分析测定条件有关,此结论有待进一步研究。在肌肉中出现随灌药剂量增大,t1/2β逐渐减小的趋势,但相差不大。肝脏在1.0 mg/kg条件下,t1/2β值明显小于其他两个剂量组,此原因有待进一步探讨。
AUC为己烯雌酚含量-时间曲线下面积,指己烯雌酚进入泥鳅体内药量的多少,是衡量己烯雌酚在泥鳅体内各组织器官吸收量的重要参数。以口服灌药剂量1.0 mg/kg己烯雌酚为例,血浆、肌肉和 肝脏中AUC由高到低依次为:肝脏(5 517.853 μg/(kg·h))>肌肉(1 479.485 μg/(kg·h))>血浆(288.565 μg/(L·h));数据显示血浆、肌肉和肝脏中AUC值相差很远,肝脏对己烯雌酚的吸收量约是肌肉吸收量的4 倍和血浆吸收量的20 倍,说明己烯雌酚的蓄积能力因组织的不同有较大差别。
CL/F为总体清除率,即单位时间内泥鳅各组织能消除相当于多少容积血中所含的己烯雌酚,CL/F与t1/2β都是衡量己烯雌酚在泥鳅各组织消除快慢的指标。以口服灌药1.0 mg/kg己烯雌酚为例,血浆、肌肉和肝脏的CL/F值依次为2.708、0.675、0.181 L/(h·kg),在0.1、10.0 mg/kg剂量组CL/F值变化规律与1.0 mg/kg剂量组一致。上述数值均较小,说明己烯雌酚在泥鳅体内分布广,消除较快。己烯雌酚低的清除率有利于其药效在泥鳅体内长时间维持。
当口服灌药后,泥鳅血浆、肌肉和肝脏中己烯雌酚含量逐渐增大,当达到Cmax后,其含量逐渐下降,在口服灌药的3 个剂量条件下,血浆中己烯雌酚含量均在6 h下降至检出限以下;肌肉中己烯雌酚含量分别在20、16、 12 h后下降了90%以上;肝脏中己烯雌酚含量分别在48、24、16 h后下降了90%以上;值得注意的是,上述数据表明口服灌药后,己烯雌酚在一定时间内可以消除绝大部分,所用时间短,说明所研究时间内平均消除速率较快,但并不代表其最终在体内完全消除所用时间越短。
双烯雌酚作为代谢物,部分相关吸收参数无法使用软件计算,因此本研究仅借鉴使用了消除实验部分的参数CL/F,可表明双烯雌酚在泥鳅体内消除速率的快慢,以口服灌药1.0 mg/kg己烯雌酚为例,血浆、肌肉和肝脏中CL/F值分别为5.851、0.917、0.16 L/(h·kg)。在0.1、1.0、10.0 mg/kg剂量组CL/F值变化规律一致。表明双烯雌酚在泥鳅体内分布广且易于消除。
2.6 己烯雌酚休药期的规定
己烯雌酚通过口服灌药方式进入泥鳅体内,在血浆、肌肉和肝脏中的分布 和消除能力均不相同,并且随口服灌药剂量的增大,己烯雌酚的蓄积量逐渐增加。泥鳅肝脏为主要解毒器官。口服灌药后己烯雌酚渗透到血液中再经肝脏,大部分己烯雌酚被肝脏截留积蓄,因此在血浆、肌肉和肝脏3 个组织中,肝脏己烯雌酚Cmax最大,富集能力最强,而且表现出最快的平均消除速率。当泥鳅肝脏不能对己烯雌酚进行全部截留时,部分己烯雌酚通过血液循环而被泥鳅其他 肌肉组织蓄积。所以建议尽量不要食用泥鳅肝脏。从饮食安全角度来讲,食用泥鳅肌肉部分比食用泥鳅整体更安全。
目前水产品残留限量标准对己烯雌酚残留限量做出了要求,规定己烯雌酚在水产品中不得检出。因己烯雌酚在泥鳅肝脏内消除时间最长,因此将肝脏定为代谢靶组织,泥鳅口服灌药0.1、1.0、10.0 mg/kg己烯雌酚后,泥鳅肝脏内己烯雌酚和双烯雌酚分别在3、5、5 d后均降至检出限以下,因此在本实验室条件下,其休药期可定为3、5、5 d。但在实际养殖过程中,存在多次重复给药或投喂含己烯雌酚饲料的情况,投喂直至停药期满,泥鳅起池为止。所以本实验室条件下得出的休药期比实际情况要短,综合考虑可将其休药期适当延长。值得注意的是,影响己烯雌酚在泥鳅体内代谢的影响因素很多,但水温影响最大。在某特定温度范围内,水温升高,己烯雌酚代谢强度增强;水温降低,代谢强度减弱。水温升高1 ℃,药物的代谢和消除速率一般提高10%左右,因此在生产过程中,应根据实际情况和养殖习惯适当缩短或延长休药期。
3 结 论
本实验采用泥鳅作为实验对象,在口服灌药给药方式下,采用超高效液相色谱-串联质谱法分析测定己烯雌酚及其代谢物双烯雌酚在血浆、肌肉和肝脏中的分布和残留情况。同时规定了在本实验室条件下己烯雌酚和双烯雌酚的休药期,但在生产过程中,应根据实际情况和养殖习惯适当缩短或延长休药期,以保障食用者身体健康。
[1] 李俊锁, 邱月明, 王超. 兽药残留分析[M]. 上海: 上海科学技术出版社, 2002: 589.
[2] 柳爱春, 刘超, 徐晓丹, 等. 水产品中己烯雌酚快速检测方法试验分析[J]. 现代农业科技, 2009(15): 353-354.
[3] TOKUMOTO T, TOKUMOTO M, HORIGUCHI R, et al. Diethylstilbestrol induces fish oocyte maturation[J]. Proceedings of the National Academy of the Sciences of the United States of America, 2004, 101(10): 3686-3690.
[4] 樊德厚. 中国药物大全: 西药卷[M]. 3版. 北京: 人民卫生出版社, 2006: 254-255.
[5] 林子俺, 庞纪磊, 黄慧, 等. 水产品中己烷雌酚、己烯雌酚与双烯雌酚残留的毛细管电泳测定[J]. 分析测试学报, 2010, 29(1): 55-58.
[6] 吴翠琴. 己烯雌酚和辛基酚对真鲷幼鱼的雌激素效应研究[J]. 水产科学, 2008, 27(12): 611-614.
[7] 陈金雄. 己烯雌酚的临床应用、毒负作用及其残留检测方法研究进展[J]. 福建畜牧兽医, 2005, 27(2): 13-15.
[8] 丁雅韵, 徐晓云, 谢孟峡, 等. 动物组织中己烯雌酚残留的基体固相扩散-气相色谱-质谱分析方法研究[J]. 分析化学, 2003, 31(11): 1356-1359.
[9] TAIKO O, MOTOHISA K. Formation of active oxygen species from diethylstilbestrol, a synthetic estrogen, and its metabolite in the presence of RAW 264.7 cells[J]. Biological and Pharmaceutical Bulletin, 2002, 25(10): 1311-1314.
[10] JAROSŁAW K, WOJCIECH P, TOMASZ B, et al. Effect of diethylstilbestrol (DES) and 17β-estradiol (E2) on growth, survival and histological structure of the internal organs in juvenile European catfish Silurus glani (L.)[J]. Aquaculture International, 2014, 22(1): 53-62.
[11] ZHANG Xuan, LI Jianhong, MA Lian, et al. Diethylstilbestrol impairs the morphology and function of mouse gubernaculum testis in culture[J]. Cell Biology and Toxicology, 2012, 28(6): 397-407.
[12] 钟雪萍, 徐盈, 梁勇, 等. 稀有鮈鲫生命早期的己烯雌酚暴露对生长发育与繁殖的影响[J]. 水生生物学报, 2005, 29(6): 667-672.
[13] YANG Lihua, LIN Li, WENG Shaoping, et al. Sexually disrupting effects of nonylphenol and diethylstilbestrol on male silver carp (Carassius auratus) in aquatic microcosms[J]. Ecotoxicology and Environmental Safety, 2008, 71: 400-411.
[14] HUTCHINSON T H, YOKOTA H, HAGINO S, et al. Development of fi sh tests for endocrine disruptors[J]. Pure and Applied Chemistry, 2003, 75(11/12): 2343-2353.
[15] HANS O A, PAGONA L, DIMITRIOS T. Breast cancer following diethylstilbestrol exposure in utero: insights from a tragedy[J]. European Journal of Epidemiology, 2012, 27(1): 1-3.
[16] 李凯年, 姜荃. 国外对食品药物残留控制的发展趋势[J]. 世界农业, 2003(5): 44-46.
[17] 中华人民共和国农业部. 中华人民共和国农业部公告 第193号[EB/OL]. http://www.moa.gov.cn/zwllm/tzgg/gg/201104/t20110422_1976324.htm.
[18] 中华人民共和国农业部. 中华人民共和国农业部公告 第235号[EB/OL]. http://www.moa.gov.cn/zwllm/nybz/200803/ t20080304_1028649.htm.
[19] EDWARD J M, SIDNEY R. Disposition of diethylstilbestrol in the rhesus monkey[J]. Journal of Pharmacokinetics and Biopharmaceutics, 1975, 3(5): 303-327.
[20] ASCHBACHER P W. Metabolism of 14C-diethylstilbestrol in sheep[J]. Journal of Animal Science, 1972, 35: 1031-1035.
[21] 马爱团, 陈耀星, 王子旭. 己烯雌酚对成年雄性金色中仓鼠的生殖毒性与氧化损伤的关系[J]. 动物学报, 2007, 53(6): 1076-1082.
[22] 端正花, 朱琳, 宫知远. 己烯雌酚在斑马鱼胚胎中的生物蓄积及毒性机制研究[J]. 环境科学, 2009, 30(2): 522-526.
Tissue Distribution and Pharmacokinetics of Diethylstilbestrol and Its Metabolite Dienestrol in Misgurnus anguillicaudatus
TIAN Xiu-hui1, XUE Jing-lin2, SUN Yan1, REN Chuan-bo2, XU Ying-jiang1, LIU Hui-hui1, HUANG Hui2, GONG Xiang-hong1,*
(1. Shandong Provincial Key Laboratory of Restoration for Marine Ecology, Shandong Marine Resource and Environment Research Institute, Yantai 264006, China; 2. Yantai Shanshui Seafood Co. Ltd., Yantai 264006, China)
Tissue distribution and pharmacokinetics of diethylstilbestrol and its metabolite dienestrol in plasma, muscle and liver of Misgurnus anguillicaudatus under laboratory conditions using single oral administration were studied by ultra-performance liquid chromatogram tandem mass spectrometry in this work. After a single oral administration with diethylstilbestrol at 0.1, 1.0 and 10.0 mg/kg, diethylstilbestrol concentrations in plasma, muscle and liver versus time were well described by a twodepartment open model with first-order absorption. For example, after single oral administration at 1.0 mg/kg, the concentration of diethylstilbestrol in liver was highest, followed successiv ely by that in muscle and plasma. The average elimination speed was 22.46, 3.32 and 5.05 øg/(kg·h) in plasma, muscle and liver, respectively. Diethylstilbestrol was not detected at 6, 72 and 120 h after oral administration. The changes in dienestrol concentrations were similar those with diethylstilbestrol. Dienestrol concentration in plasma, muscle and liver reached a peak at 1, 4 and 4 h, respectively, after oral administration, and was not detected at 6, 72 and 96 h after administration, which was shorter than that of diethylstilbestrol. DAS 2.0 pharmacokinetic parameter calculation program was used to process the data and calculate the relevant pharmacokinetic parameters. The results indicated that the area under concentration-time curve (AUC) differe d greatly in plasma, muscle and liver and these tissues had different accumulation capabilities. Diethylstilbestrol was eliminated fast. Distribution was dispersed and elimination was fast. Under the experimental conditions, the recommended withdrawal periods were 3, 5 and 5 d respectively. When the water temperature was higher than the experimental conditions, th e withdrawal period could be shortened and extended at lower water temperature. The concentrations versus time curves of diethylstilbestrol in Misgurnus anguillicaudatus provided useful information for studying decontamination of Misgurnus anguillicaudatus that had diethylstilbestrol contamination.
diethylstilbestrol; dienestrol; Misgurnus anguillicaudatus; pharmacokinetics; ultra performance liquid chro matogram tandem-mass spectrometry
S 948
A
1002-6630(2014)21-0234-06
10.7506/spkx1002-6630-201421046
2014-01-14
烟台市科技发展计划资助项目(2012134);山东省水生动物营养与饲料泰山学者岗位资助项目(ts20080208)
田秀慧(1982—),女,助理研究员,硕士,研究方向为水产品质量与安全。E-mail:tianxiuhui127@163.com
*通信作者:宫向红(1968—),女,研究员,学士,研究方向为水产品质量与安全。E-mail:ggxxhh123@163.com
