预处理对胶原蛋白水解和血管紧张素转化酶抑制肽段释放的影响
2014-03-08张宇昊
刘 轶,马 良,2,3,张宇昊,2,3,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学 国家食品科学与工程实验教学示范中心,重庆 400715;3.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
预处理对胶原蛋白水解和血管紧张素转化酶抑制肽段释放的影响
刘 轶1,马 良1,2,3,张宇昊1,2,3,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学 国家食品科学与工程实验教学示范中心,重庆 400715;3.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715)
以胰蛋白酶为工具酶,研究短时热处理、超高压处理对胶原蛋白水解和血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制肽段释放的影响。结果表明:热处理可显著促进胰蛋白酶对胶原蛋白的水解和ACE抑制活性肽段释放,超高压处理组水解物水解度(degree of hydrolysis,DH)与无处理组无显著差异,ACE抑制活性显著低于无处理组。水解物DH和ACE抑制活性关系研究显示,胰蛋白酶水解胶原蛋白过程中,水解度小于5%时,ACE抑制率随水解度呈明显上升趋势,水解度大于5%后,其上升趋势不再明显。肽谱分析进一步证明热处理可有效促进胶原蛋白的水解,超高压处理可改变胰蛋白酶作用位点。热处理组水解物序列分析显示,获得序列均来源于胶原蛋白三螺旋区域,且大部分序列都具有潜在的ACE抑制活性。说明短时热处理可以有效破坏胶原蛋白的三螺旋结构,促进ACE抑制肽段的释放。
胰蛋白酶;胶原蛋白;预处理;水解;ACE抑制活性
动物性食品加工过程中会产生皮、骨等大量副产物,这些副产物中含有大量胶原蛋白。因此以动物加工副产物为原料,通过酶解制备胶原多肽,提高副产物的附加值已经成为目前研究热点[1-2]。血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制肽构效研究表明,C末端含有Pro或Hyp的多肽,如Gly-Pro-Hyp-Gly-Thr-Asp-Gly-Ala-Hyp、Gly-Pro-Pro-Gly-Ala-Hyp、Gly-Pro-Pro-Gly-Ala-Hyp、Gly-Ala-Hyp、Gly-Phe-Hyp-Gly-Pro等,通常具有较强的ACE抑制活性(其半抑制浓度范围为8.6~200 μmol/L)[3-4]。胶原蛋白富含脯氨酸(Pro)和羟脯氨酸(Hyp),因此被大量应用于ACE抑制肽的制备和研究[5-8]。然而,天然的胶原蛋白具有稳定的三螺旋结构,很难被金属基质蛋白酶(matrix metallo protease,MMP)以外的蛋白酶水解[9],而胶原蛋白中Pro和Hyp全部存在于三螺旋区域,因此胶原蛋白中潜在的ACE抑制肽段很难通过酶解被有效释放。目前有关胶原ACE肽制备方面的报道,大部分均以明胶为底物[10]或者酶解前对胶原蛋白进行3 h以上的热处理[5-8,10],以破坏胶原的三螺旋结构。对胶原前处理方法进行研究,构建可有效制备胶原ACE抑制肽的短时预处理方法具有重要意义。
超高压技术近年来被广泛应用于蛋白质改性,适度的超高压作用可破坏蛋白质的三级和四级结构,破坏其疏水键和离子键等非共价键,使蛋白质肽链伸展,立体结构松散[11-12]。研究表明,采用超高压作用可有效破坏胶原蛋白非共价键平衡,诱导胶原蛋白明胶化[11,13]。因此,超高压预处理有可能暴露胶原蛋白内部位点,促进内部活性肽段的释放。
热处理是常用的蛋白水解预处理方法,但短时热处理对胶原蛋白水解产物影响方面的研究鲜见报道。本实验拟选择难以水解天然胶原蛋白的胰蛋白酶为工具酶,研究短时热处理和超高压处理对胰蛋白酶水解胶原蛋白释放ACE抑制活性肽段的影响,旨在为胶原ACE肽的高效制备奠定理论基础。
1 材料与方法
1.1 材料与试剂
牛Ⅰ型胶原蛋白、胰蛋白酶、A C E、A C E作用底物(ABZ-Gly-Phe(NO2)-Pro)、邻苯二甲醛(o-pthaldialdehyde,OPA)、N-乙酰半胱氨酸(N-acetyl cysteine,NAC) 美国Sigma公司;乙腈、三氟乙酸(trifluoroacetic acid,TFA)(均为色谱纯) 德国Fisher公司;其余试剂为分析纯。
1.2 仪器与设备
UV-2100型分光光度计 澳大利亚Mulgrave公司;荧光酶标仪 美国Tecan Genios Plus公司;QFP-6超高压处理设备 瑞典Avure Technologies公司;Agilent 1100 MSD Trap液质联用仪 美国Agilent公司。
1.3 方法
1.3.1 样品预处理
称取一定量牛Ⅰ胶原蛋白,按料液比1∶100(m/V)加入0.1 mol/L磷酸盐缓冲液(pH 8.0),于4 ℃过夜后分别用热和超高压进行预处理,其中热处理组于100 ℃处理5 min后立即用蒸馏水冲洗冷却至室温;超高压处理组样品用塑料袋封装,于600 MPa处理15 min后立即转移至烧杯中;以无处理组作为对照。
1.3.2 酶解液制备
预处理后的样品于37 ℃预热10 min,以酶与底物质量比1∶100加入胰蛋白酶,酶解时间在1 min、30 min、1 h、2 h、3 h、4 h时分别取出一定量水解液,立即于90 ℃水浴15 min进行灭酶处理。冷却至室温后于11 000 ×g离心5 min,取上清液过0.45 μm滤膜后于-18 ℃冻藏备用。
1.3.3 水解度(degree of hydrolysis,DH)测定
参照Spellman等[14]的方法,略有改进。按文献方法配制OPA试剂,现配现用,将酶解液稀释10 倍后取2.4 mL于10 mL试管中,加入2.4 mL浓度为5 mmol/L的OPA/NAC溶液,反应进行10 min达到平衡后,将反应液转移至3 mL的比色管中,于340 nm波长处测定其吸光度。空白组以水代替水解液。通过Peptide Cutter Software(http://web.expasy.org/peptide_cutter/)预测胰蛋白酶水解牛Ⅰ型胶原蛋白的作用位点,并利用公式(1)计算胰蛋白酶水解牛Ⅰ型胶原蛋白的理论水解度。
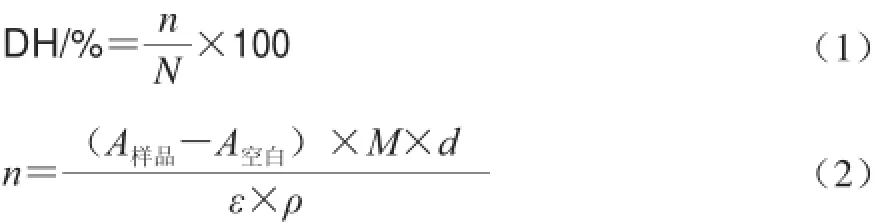
式中:n为水解断裂肽键平均数;N为每个蛋白分子总肽键数;A样品、A空白分别为样品和空白组在340 nm波长处的吸光度;M为蛋白分子质量/D;d为稀释系数;ε为OPA在340 nm波长处的消光系数,此处为6 000/(mol·cm);ρ为蛋白质质量浓度/(g/L)。查询UniProt数据库计算可得,牛Ⅰ型胶原蛋白分子质量为406.940 D,肽键数为4 287。
1.3.4 ACE抑制率测定
采用荧光酶标法测定ACE抑制率[15]。向黑色微量酶标板加50 μL酶解液,加入6 mU/mL ACE溶液50 μL后,将微量酶标板置于荧光酶标仪振板10 s,于37 ℃条件下反应10 min,之后向滴定板每个反应孔中加入200 μL 0.45 mmol/L ABZ-Gly-Phe(NO2)-Pro,在37 ℃进行动力学测定,1 h内每隔1.5 min测定一次激发波长为360 nm、吸收波长为415 nm所对应的荧光值,绘制曲线并计算斜率。以pH 8.3 Tris缓冲液代替酶解液作阳性对照组,阴性对照、空白用Tris缓冲液替代ACE溶液。所有样品均需重复5 次。ACE抑制率按公式(3)测定。

1.3.5 多肽序列测定
参照Otte等[16]的LC-MS/MS法进行测定。分析柱Zorbax 300SB C18柱(2.1 mm×150 mm,5 μm);进样量25 μL;柱温40 ℃;流速0.25 mL/min;采用梯度洗脱,其中前5 min用A流动相洗脱(A为含0.1% TFA的超纯水),后70 min采用0%~60%流动相B线性梯度洗脱(B为90%含0.1% TFA的乙腈)。离子化方式为ESI+;气体流速9 L/min;雾化器压力50 psi;干燥气温度300 ℃;扫描范围50~2 000 m/z,目标质量数为1 521。采用Bruker Daltonics 3.3数据分析软件处理数据;用Mascot Version 2.1软件对水解物经质谱分析后所得组分与蛋白序列进行匹配,此外,Biotools Software软件被用于分析胶原多肽分子质量。牛Ⅰ型胶原蛋白的序列可从UniProt数据库获得,用于确定所得多肽序列的来源。
1.4 数据处理
采用SPSS 13.0进行数据分析。样品DH和ACE抑制活性的显著性分析采用图基检验法(Tukey’s test);DH与ACE抑制活性关系分析主要利用SPSS中提供的各种模型进行拟合,以相关系数为指标选择最优拟合模型。
2 结果与分析
2.1 不同预处理胶原蛋白水解产物DH和ACE抑制活性分析
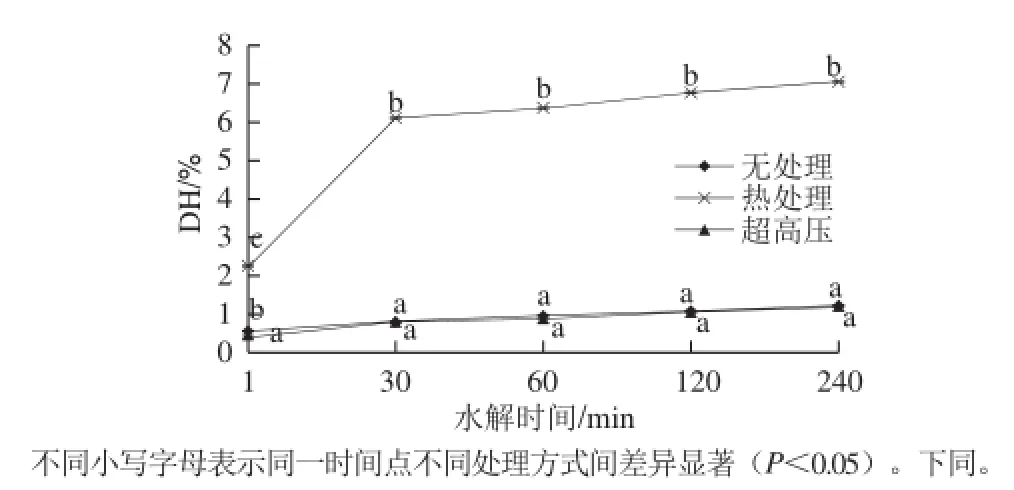
图1 不同预处理对DH的影响Fig.1 Effect of pretreatments on DH
胰蛋白酶对于胶原蛋白的理论水解度为8.5%,但由图1可知,胰蛋白酶对未经处理的胶原蛋白水解非常有限,酶解240 min后水解度仅为1.46%。600 MPa超高压预处理对于胰蛋白酶水解胶原蛋白同样没有促进作用,酶解240 min后水解度与无处理组无显著差异(P>0.05)。而热处理可显著提高胰蛋白酶水解胶原蛋白的能力(P<0.05),水解1 min后水解度即达到2.44%,240 min后达到6.96%,接近胰蛋白酶对胶原蛋白的理论水解度。Zhang Zhongkai等[17]研究表明,胶原蛋白具有稳定的三螺旋结构,很难被胰蛋白酶水解,但如果以明胶为底物,其水解度会大幅提高,主要是因为明胶中三螺旋结构已被破坏。由此可见,对于纯牛皮胶原蛋白,100 ℃、5 min的预处理已足够破坏其三螺旋结构,使之暴露内部酶切位点,提高胰蛋白酶的水解度。
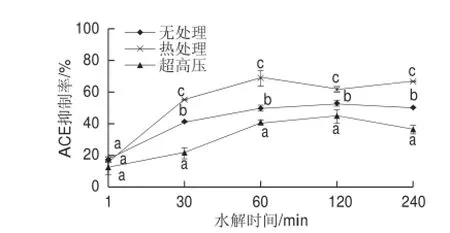
图2 不同预处理对水解物ACE抑制活性的影响Fig.2 Effect of pretreatments on ACE inhibitory activity of hydrolysates
由图2可知,热处理胶原蛋白的胰蛋白酶水解物同样具有较高的ACE抑制活性,其中最高活性出现在水解60 min后,其ACE抑制率达到68.55%。尽管无处理组水解液的水解度与超高压处理组相近,但其ACE抑制活性显著高于超高压处理组(P<0.05),这可能是因为超高压导致了胶原蛋白的聚集[15,18],改变了胰蛋白酶的作用位点,抑制了ACE抑制活性肽段的释放。
2.2 胶原胰蛋白酶水解物DH与ACE抑制活性的关系
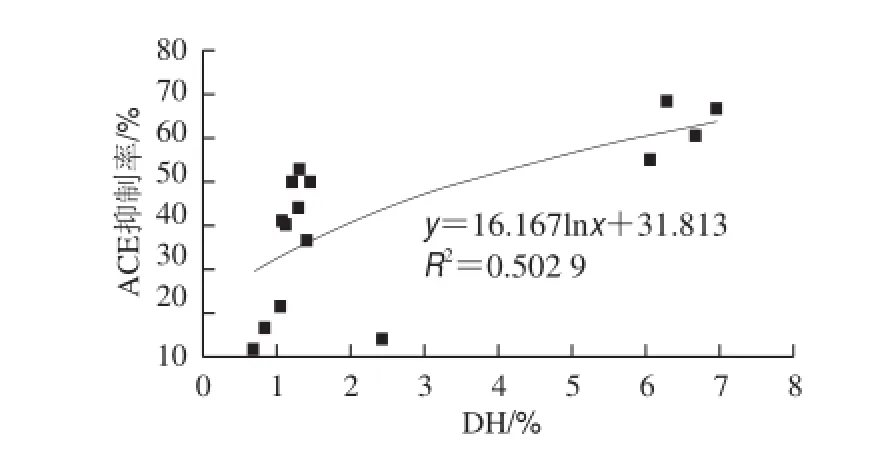
图3 胶原蛋白水解物DH与ACE抑制活性关系Fig.3 Correlation between DH and ACE inhibitory activity
由图3可知,胰蛋白酶水解物水解度小于5%时,ACE抑制率随水解度呈明显上升趋势,水解度大于5%后,其上升趋势不再明显,这可能是因为在水解初始阶段,随着水解度的升高多肽浓度大幅增加,而在高水解度阶段,水解度继续上升,多肽浓度增加不明显。采用对数模型可对该散点图进行较好拟合。Walsh[19]和Nielsen[20]等对对乳源ACE抑制肽的水解度和ACE抑制活性关系进行研究,结论与本实验一致。超高压预处理和无处理组胶原蛋白水解度均小于5%,因此无法有效释放胶原内部的ACE抑制活性肽段。
2.3 不同预处理胶原蛋白水解物肽谱分析
对热处理、超高压处理、无处理组酶解60 min样品进行肽谱分析,由图4可知,水解60 min后,热处理组多肽明显多于无处理组和超高压组,与水解度分析结论一致,进一步说明100 ℃、5 min的预处理可有效促进胰蛋白酶水解胶原蛋白。无处理组和超高压处理组产物中多肽含量较少,同时肽谱具有一定差异性,如保留时间在50~70 min时,无处理组多肽含量更高,说明超高压预处理部分改变了胰蛋白酶的作用位点,这可能是导致二者水解物ACE抑制活性差异的原因。
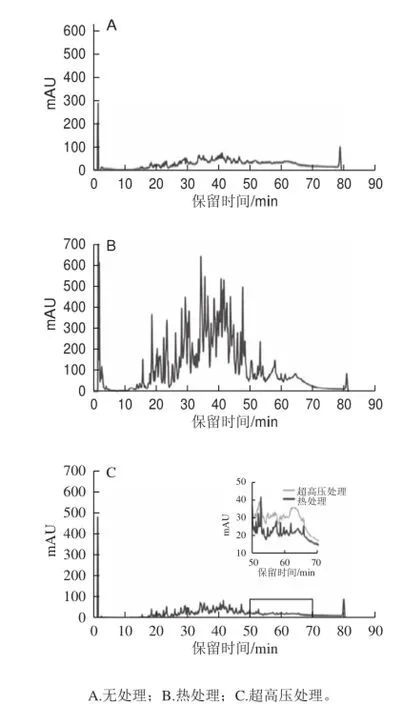
图4 不同预处理水解物肽谱Fig.4 Peptide pro fi le of hydrolysates obtained with different pretreatments
2.4 热处理胶原蛋白水解物中潜在ACE抑制肽序列
鉴于热处理组60 min水解物ACE抑制活性最高,对其多肽序列进行分析,结果见表1。ACE抑制肽多为小分子肽,因此主要对其中分离度较高的小分子组分进行序列分析。所有获得的序列均来源于胶原蛋白三螺旋结构中的α1链和α2链,说明热处理充分暴露了胶原蛋白内部位点。胰蛋白酶切割的位点是主要是Lys和Arg的C末端[21],表1中大部分多肽C末端均为Arg或Lys,与胰蛋白酶的作用位点相一致。其中部分序列已经被鉴定报道,如GPPGSAGSPGK[22]、GDAGPAGPK[23]、GPPGPQGAR[24]、GSEGPQGVR[25]、GPAGPQGPR[26]、GETGPAGPAGPIGPVGAR[27],所有报道的序列均来源于胶原蛋白,但对于其ACE抑制活性还未见报道。ACE抑制肽构效研究表明,当Lys、Arg或者极度疏水氨基酸位于C末端时,多肽通常具有较强的ACE抑制活性[28]。从表中还以看出,8 个多肽序列在C末端后3 位含有Pro或者Hyp,而Ichimura[3]和Byun[6]等研究表明,当多肽C末端3 位含有Pro或者Hyp时,通常具有较强的ACE抑制活性,因此,所鉴定多肽中绝大部分可能具有较强的ACE抑制活性,这也是热处理组60 min水解物具有较高ACE抑制活性的原因。
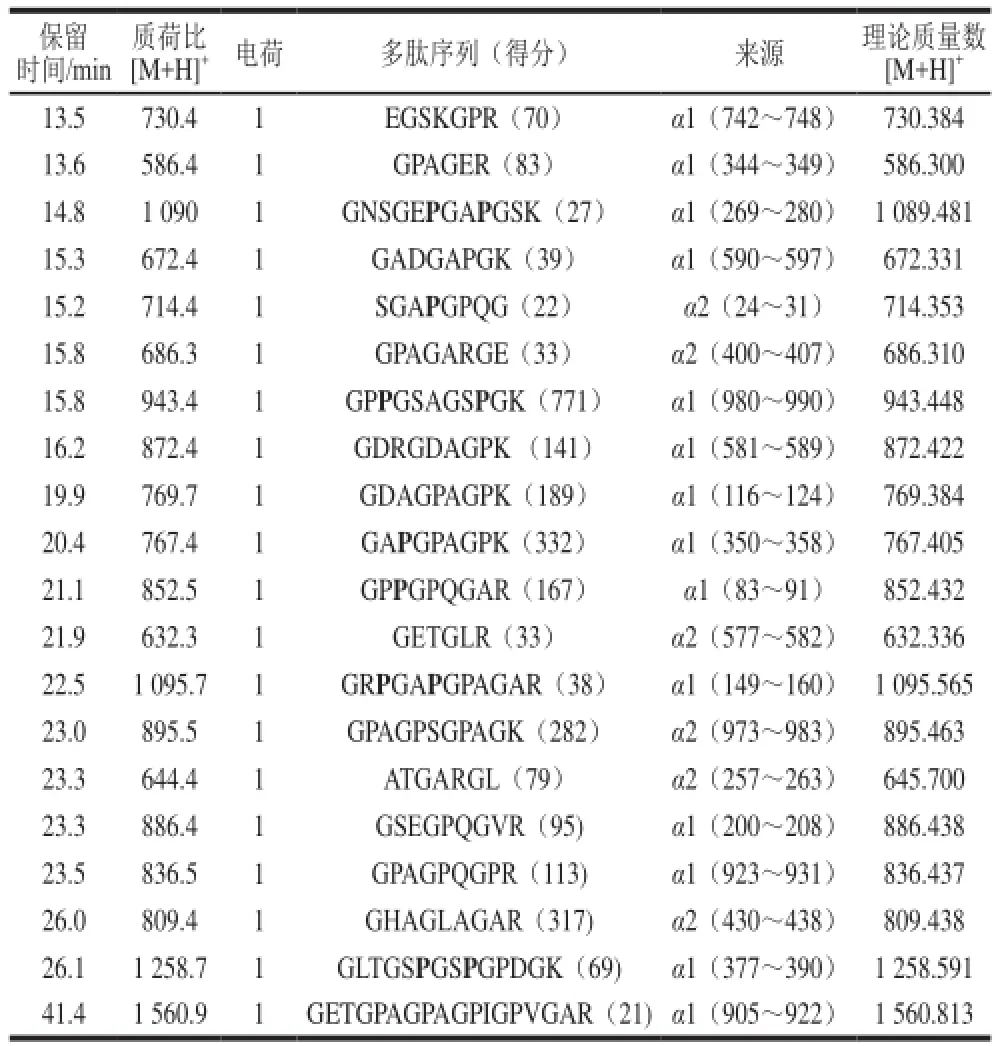
表1 热处理胶原水解60 min后水解物质谱分析Table1 Mass spectrometric analysis of major peptides in 60 min hydrolysates of boiled collagen
3 结 论
本研究表明,100 ℃、5 min的预处理可有效促进胰蛋白酶对胶原蛋白的水解和ACE抑制活性肽段的释放,其水解产物的DH和ACE抑制活性均显著提高(P<0.05);600 MPa、15 min的超高压预处理无法促进胰蛋白酶对胶原蛋白的水解,其水解产物DH与无处理组无显著差异(P>0.05),ACE抑制活性显著低于无处理组(P<0.05);胶原胰蛋白酶水解物DH与ACE抑制活性的关系研究表明,胰蛋白酶水解物水解度小于5%时,ACE抑制率随水解度增大呈明显上升趋势,水解度大于5%后,其上升趋势不再明显;胰蛋白酶酶解胶原蛋白60 min后水解物肽谱与水解度测定结果一致,超高压预处理组与无处理组水解物呈现一定差异,证明超高压预处理部分改变了胰蛋白酶的作用位点;对热处理组酶解60 min水解物中部分多肽进行序列分析显示,所鉴定序列均来源于胶原蛋白三螺旋区域,且大部分序列都具有潜在的ACE抑制活性。
参考文献:
[1] KIDA K, MORIMURA S, NODA J, et al. Enzymatic-hydrolysis of the horn and hoof of cow and buffalo[J]. Journal of Fermentation and Bioengineering, 1995, 80(5): 478-484.
[2] MORIMURA S, NAGATA H, UEMURA Y, et al. Development of an effective process from livestock and for utilization of collagen fish waste[J]. Process Biochemistry, 2002, 37(12): 1403-1412.
[3] ICHIMURA T, YAMANAKA A, OTSUKA T, et al. Antihypertensive effect of enzymatic hydrolysate of collagen and Gly-Pro in spontaneously hypertensive rats[J]. Bioscience Biotechnology and Biochemistry, 2009, 73(10): 2317-2319.
[4] OSHIMA G, SHIMABUKURO H, NAGASAWA K. Peptide inhibitors of angiotensinⅠ-converting enzyme in digests of gelatin by bacterial collagenase[J]. Biochimica et Biophysica Acta, 1979, 566(1): 128-137.
[5] ALEMAN A, GIMENEZ B, PEREZ-SANTIN E, et al. Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J]. Food Chemistry, 2011, 125(2): 334-341.
[6] BYUN H G, KIM S K. Purification and characterization of angiotensinⅠconverting enzyme (ACE) inhibitory peptides from Alaska pollack (Theragra chalcogramma) skin[J]. Process Biochemistry, 2001, 36(12): 1155-1162.
[7] KIM S K, BYUN H G, PARK P J, et al. AngiotensinⅠconverting enzyme inhibitory peptides purified from bovine skin gelatin hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2001, 49(6): 2992-2997.
[8] SAIGA A, IWAI K, HAYAKAWA T, et al. Angiotensin Ⅰ-converting enzyme-inhibitory peptides obtained from chicken Collagen hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2008, 56(20): 9586-9591.
[9] CHUNG L D, DINAKARPANDIAN D, YOSHIDA N, et al. Collagenase unwinds triple-helical collagen prior to peptide bond hydrolysis[J]. The Embo Journal, 2004, 23(15): 3020-3030.
[10] CHENG F Y, LIU Y T, WAN T C, et al. The development of angiotensinⅠ-converting enzyme inhibitor derived from chicken bone protein[J]. Animal Science Journal, 2008, 79(1): 122-128.
[11] 张宇昊, 马良, 师萱. 鱼皮明胶的超高压辅助提取工艺[J]. 食品科学, 2011, 32(6): 99-103.
[12] 陈丽清, 马良, 张宇昊. 现代加工技术在明胶制备中的应用展望[J].食品科学, 2010, 31(19): 418-421.
[13] 陈丽清, 张宇昊, 周梦柔, 等. 猪皮明胶提取过程中的超高压预处理工艺优化[J]. 农业工程学报, 2012, 28(19): 262-269.
[14] SPELLMAN D, MCEVOY E, O’CUINN G, et al. Proteinase and exopeptidase hydrolysis of whey protein: comparison of the TNBS, OPA and pH stat methods for quantif i cation of degree of hydrolysis[J]. International Dairy Journal, 2003, 13(6): 447-453.
[15] SENTANDREU M A, TOLDRA F. A fluorescence-based protocol for quantifying angiotensin-converting enzyme activity[J]. Nature Protocols, 2006, 1(5): 2423-2427.
[16] OTTE J, SHALABY S M, ZAKORA M, et al. Angiotensin-converting enzyme inhibitory activity of milk protein hydrolysates: effect of substrate, enzyme and time of hydrolysis[J]. International Dairy Journal, 2007, 17(5): 488-503.
[17] ZHANG Zhongkai, LI Guoying, SHI B L. Physicochemical properties of collagen, gelatin and collagen hydrolysate derived from bovine limed split wastes[J]. Journal of the Society of Leather Technologists and Chemists, 2006, 90(1): 23-28.
[18] CHEN Liqing, MA Liang, ZHOU Mengru, et al. Effects of pressure on gelatinization of collagen and properties of extracted gelatins[J]. Food Hydrocolloids, 2014, 36: 316-322.
[19] WALSH D J, BERNARD H, MURRAY B A, et al. in vitro generation and stability of the lactokinin beta-lactoglobulin fragment (142-148)[J]. Journal of Dairy Science, 2004, 87(11): 3845-3857.
[20] NIELSEN M S, MARTINUSSEN T, FLAMBARD B, et al. Peptide prof i les and angiotensin-Ⅰ-converting enzyme inhibitory activity of fermented milk products: Effect of bacterial strain, fermentation pH, and storage time[J]. International Dairy Journal, 2009, 19(3): 155-165.
[21] OTTE J, SHALABY S M, ZAKORA M, et al. Angiotensin-converting enzyme inhibitory activity of milk protein hydrolysates: Effect of substrate, enzyme and time of hydrolysis[J]. International Dairy Journal, 2007, 17(5): 488-503.
[22] YILMAZ M T, KESMEN Z, BAYKAL B, et al. A novel method to differentiate bovine and porcine gelatins in food products: NanoUPLCESI-Q-TOF-MSE based data independent acquisition technique to detect marker peptides in gelatin[J]. Food Chemistry, 2013, 141(3): 2450-2458.
[23] TAGA Y, KUSUBATA M, OGAWA-GOTO K, et al. Site-specific quantitative analysis of overglycosylation of collagen in osteogenesis imperfecta using hydrazide chemistry and SILAC[J]. Journal of Proteome Research, 2013, 12(5): 2225-2232.
[24] WILSON J, van DOORN N L, COLLINS M J. Assessing the extent of bone degradation using glutamine deamidation in collagen[J]. Analytical Chemistry, 2012, 84(21): 9041-9048.
[25] PATARIDIS S, ECKHARDT A, MIKULIKOVA K, et al. Identif i cation of collagen types in tissues using HPLC-MS/MS[J]. Journal of Separation Science, 2008, 31(20): 3483-3488.
[26] PATARIDIS S, ECKHARDT A, MIKULIKOVA K, et al. Determination and quantification of collagen types in tissues using HPLC-MS/MS[J]. Current Analytical Chemistry, 2009, 5(4): 316-323.
[27] ZHANG G F, LIU T, WANG Q, et al. Mass spectrometric detection of marker peptides in tryptic digests of gelatin: a new method to differentiate between bovine and porcine gelatin[J]. Food Hydrocolloids, 2009, 23(7): 2001-2007.
[28] HERNANDEZ-LEDESMA B, CONTRERAS M D, RECIO I. Antihypertensive peptides: production, bioavailability and incorporation into foods[J]. Advances in Colloid and Interface Science, 2011, 165(1): 23-35.
Inf l uence of Pretreatment on Enzymatic Hydrolysis of Collagen and Release of Angiotensin Converting Enzyme (ACE) Inhibitory Peptides
LIU Yi1, MA Liang1,2,3, ZHANG Yu-hao1,2,3,* (1. College of Food Science, Southwest University, Chongqing 400715, China; 2. National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400715, China; 3. Laboratory of Quality and Safety Risk Assessment for Agro-products on Storage and Preservation (Chongqing), Ministry of Agriculture, Chongqing 400715, China)
Trypsin was used to hydrolyze bovine type Ⅰ collagen with trypsin for the preparation of angiotensin converting enzyme (ACE) inhibitory peptides. The inf l uence of pretreatment by heating or high-pressure (HP) treatment for a short time on the degree of hydrolysis (DH) and ACE inhibitory activity of hydrolysates was studied. Heating could improve hydrolysis of collagen and release of ACE inhibitory peptides. HP pretreatment caused no signif i cant difference in DH from the untreated control, but exhibited signif i cantly lower ACE inhibitory activity than the control. The correlation between DH and ACE inhibition implied that ACE inhibition rose rapidly as DH increased, until reaching a plateau at a DH level of 5%. The peptide prof i le showed that collagen could be hydrolyzed effectively after heating and the sites hydrolyzed by trypsin could be changed after HP pretreatment. Sequence analysis of peptides from collagen with heating pretreatment showed that all sequences were from the triple-helix of collagen and most of them could have strong ACE inhibitory activity, which implied the triple-helix of collagen could be damaged and ACE inhibitory peptides could be released effectively after shorttime heating pretreatment.
trypsin; collagen; pretreatment; hydrolysis; ACE inhibitory activity
TS209
A
1002-6630(2014)21-0021-05
10.7506/spkx1002-6630-201421005
2014-04-06
国家自然科学基金青年科学基金项目(31301425);中央高校基本科研业务费专项资金项目(XDJK2011B001);中国博士后科学基金面上项目(2014M562267)
刘轶(1990—),女,硕士研究生,研究方向为食品化学与营养学。E-mail:penganliuyi@126.com
*通信作者:张宇昊(1978—),男,副教授,博士,研究方向为蛋白质与生物活性肽。E-mail:zyh1203@163.com
