烟熏液对卤煮牛肉中9 种杂环胺含量的影响
2014-03-08蔡克周卢进峰孟俊祥姜绍通潘丽军
杨 潇,蔡克周,*,卢进峰,孟俊祥,姜绍通,潘丽军
(1.合肥工业大学生物与食品工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009;2.安徽宝迪肉类食品有限公司,安徽 淮北 235000)
烟熏液对卤煮牛肉中9 种杂环胺含量的影响
杨 潇1,蔡克周1,*,卢进峰2,孟俊祥2,姜绍通1,潘丽军1
(1.合肥工业大学生物与食品工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009;2.安徽宝迪肉类食品有限公司,安徽 淮北 235000)
本实验研究了烟熏液对卤煮牛肉中9 种杂环胺含量的影响。结果显示:鲜牛肉只检测出PHIP、MeIQx 2 种杂环胺,含量只有0.16 ng/g,随着卤煮时间延长,检出杂环胺种类和含量均显著增加(P<0.05),卤煮4 h后,9 种杂环胺含量达到21.18 ng/g;添加烟熏液可以显著抑制卤煮牛肉中杂环胺的形成(P<0.05),0.05 mg/mL烟熏液可以将卤煮牛肉中杂环胺含量从92.72 ng/g降低到7.35 ng/g,效果显著(P<0.05),但是随着烟熏液浓度的增加,对各杂环胺形成的影响不一;烟熏液对卤煮牛肉杂环胺形成的抑制作用可能与其抗氧化性有关。
烟熏液;抗氧化性;杂环胺;卤煮牛肉
杂环胺(heterocyclic aromatic amine)是一类由碳、氢及氮原子组成且具有多环芳香族结构的化合物,1977年由Sugimura等[1]首次在烤鱼中发现,后期经动物学实验证实杂环胺具有强烈的致突变性和致癌性[2-3]。早期研究表明杂环胺极易在高蛋白肉类制品过程中产生,至今已有30余种杂环胺相继在各类肉制品中被发现。肉制品在加工过程中会产生大量的氨基酸、糖类、肌酸和肌酸酐等小分子化合物,这些杂环胺前体物质在高温下反应产生杂环胺[4],此外,大分子蛋白也会在高温条件下直接热解成杂环胺类化合物[5]。
肉制品中杂环胺的形成受到多种因素的影响,如肉的种类、加工方式、加热温度和时间、前体物浓度和脂质种类以及水分含量等,此外,在特定烹饪工艺的基础上加入天然物质或者一些催化因子,可以降低杂环胺的生成[6-8]。
卤煮是我国牛肉传统加工方法,具有营养、味美的特点,备受人们喜爱,但有研究[9]表明牛肉在沸水中加热45 min后,检测到杂环胺含量高达35.72 ng/g。通过添加香辛料提取液可以有效抑制加工过程中杂环胺的形成,这种作用可能与其抗氧化性有一定关系[10]。烟熏液是一种以天然性硬木材料为原料经过高温干馏、提纯精炼等工序制成的烟熏香味料[11],这种香辛料是从天然性物质中提纯出来的,本身未加有任何化学试剂,且在加工过程中一些有毒有害物质被去除掉,使得它成为一种绿色香味料。前期研究发现烟熏液表现出良好的抗氧化性,这种性质与其酚类物质含量呈依赖性关系[12],本实验研究了添加烟熏液对牛肉卤煮过程中杂环胺形成的影响,以期为烟熏液的使用提供更多理论支持。
1 材料与方法
1.1 材料与试剂
新鲜牛后腿肉、金龙鱼调和油、特制食盐、白砂糖、海天生抽酱油,均购自附近家乐福超市;山楂核烟熏香味液Ⅰ号 济南华鲁食品有限公司。
杂环胺标准品:2-氨基-1-甲基-6-苯基咪唑(4,5-b)吡啶(2-amino-1-methyl-6-phenylimidazo(4,5-b)pyridine,PHIP)、3-氨基-1-甲基-5H-吡啶(4,3-b)吲哚(3-amino-1-methyl-5H-pyrido(4,3-b)indole acetate,Trp-p-2)、2-氨基-3,4,8-三甲基-3H-咪唑并(4,5-f)喹噁啉(2-amino-3,4,8-trimethyl-3H-imidazo(4,5-f)quinoxaline,4,8-DimeIQX)、3-氨基-1,4-二甲基-5H-吡啶(4,3-b)吲哚乙酸(3-amino-1,4-dimethyl-5H-pyrido(4,3-b)indole acetate,Trp-p-1)、2-amino-3,4-dimethyl-3H-imidazo(4,5-f)quinoxaline(MeIQ)、2-氨基-3,8-二甲基咪唑并(4,5-f)喹恶啉(2-amino-3,8-dimethylimidazo(4,5-f)quinoxaline,MeIQX)、Harman、2-氨基-9H-吡啶(2,3-b)吲哚(2-amino-9H-pyrido(2,3-b)indole,Aac)、2-amino-3-methyl-3H-imidazo(4,5-f)quinoxaline,IQ) 加拿大TRC公司;甲醇、乙腈为色谱纯;醋酸、醋酸铵、二氯甲烷、氨水、乙醇等均为分析纯。
1.2 仪器与设备
G 1 3 1 5 A紫外检测器、G 1 3 1 2荧光检测器、Agilent1100高效液相色谱仪、硅藻土Bond Elut-PRS柱(500 mg/3 mL)、Bond Elut-C18柱(500 mg/3 mL) 美国Agilent公司;电动绞肉机 石家庄晓进机械制造科技有限公司;电子分析天平 深圳市怡华新电子有限公司;SHZ-D(Ⅲ)循环水式真空泵 巩义市予光仪器有限责任公司;CR15RT型台式高速冷冻离心机 上海天美生化仪器设备工程有限公司;HH-2型数显恒温水浴锅 江苏金坛市荣华仪器制造有限公司;紫外分光光度计 北京普析通用仪器有限责任公司;固体微萃取装置 郑州宝晶科技有限责任公司;TSK gel ODS-80色谱柱 日本Tokyo公司。
1.3 方法
1.3.1 牛肉的卤煮工艺
原料肉预处理→预煮→卤液配制→煮制
原料肉的预处理:将原料肉去除可见脂肪和筋膜后用5 mm孔径绞肉机制成肉条。
预煮:将预处理好的肉条用温水冲洗干净,放入水浴锅中,煮沸,注意撇除浮沫和杂物,煮3 min,取出牛肉块,用清水冲洗干净,将肉条以50 g为标准分装收集在塑封袋里面。
卤液的配制:白砂糖1 g、盐1 g、酱油5 mL以及蒸馏水150 mL。
煮制:在卤液中对牛肉直接进行卤煮,卤煮时始终保持卤液微沸。
1.3.2 烟熏液卤煮牛肉样品的制备
取15 份预煮后牛肉肉条,分为5 组,分别加入质量浓度为0.0、0.05、0.1、0.3、1 mg/mL的烟熏液,每组在100 ℃卤液中卤制2 h。再取15 份预煮后牛肉肉条,分为3 组,加入质量浓度为0.1 mg/mL烟熏液,分别在100 ℃卤液中卤制0、1、2、3、4 h。重复3 次。
1.3.3 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH)自由基清除率的测定
根据Stjepan等[13]的方法,向3.9 mL 浓度为0.1 mmol/L的DPPH乙醇溶液中加入0.1 mL不同质量浓度(0.1、0.2、0.3、0.4、0.5 mg/mL)的烟熏液稀释液,混匀,暗处放置1 h,在515 nm波长处测定吸光度A1。以0.1 mL蒸馏水代替烟熏液做空白对照,515 nm波长处测定吸光度A0。重复3 次。按公式(1)计算DPPH自由基清除率。
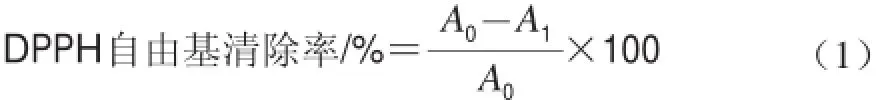
根据Re等[14]的方法并稍做修改。取3 mL 0.05 mol/L Tris-HCl缓冲液(pH 8.2),置于25 ℃水浴20 min,分别加入0.5 mL不同质量浓度(0.2、0.4、0.6、0.8、1.0 mg/mL)的烟熏液稀释液,0.6 mL 30 mmol/L邻苯三酚溶液,混匀后于25 ℃水浴精确反应5 min后,加入0.5 mL 3 mol/L HCl终止反应,于325 nm波长处测吸光度A1;以0.5 mL蒸馏水代替烟熏液稀释液做空白对照,325 nm波长处测吸光度记为A3。考虑不同烟熏液稀释液自身在325 nm波长处的吸光度本底值,将邻苯三酚替换为蒸馏水测其吸光度记为A2。重复3 次。按公式(2)计算清除率。
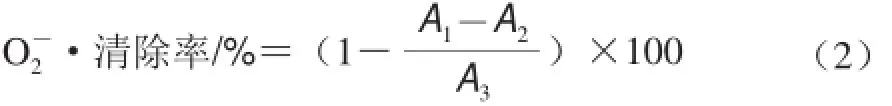
1.3.5 杂环胺的提取[15-17]
处理方法参考Cross等[17]方法。取2 g切碎的待测牛肉样品于空管中,加入12 mL 2 mol/L的NaOH,混合后用高速均质机将样品打碎匀浆,匀浆于4 ℃、10 000 r/min离心20 min。移取上清液到装有10 g硅藻土的烧杯中,充分混合后转移到Elut NT20空柱中,压实后连接上经5 mL二氯甲烷(含有5%甲苯)活化后的PRS阳离子交换柱,用70 mL二氯甲烷(含有5%甲苯)洗脱硅藻土,使杂环胺由空柱洗脱至PRS柱。取下空柱,用6 mL 0.01 mol/LHCl、15 mL 0.3 mol/L HCl-甲醇(1∶1,V/V)、2 mL水依次洗脱,将非极性杂环胺由PRS柱洗脱至烧杯中。加入25 mL双蒸水和0.5 mL氨水,混合后经C18柱抽滤,然后经2 mL水洗脱杂质后用1 mL甲醇-氨水(9∶1,V/V)将非极性杂环胺洗脱至离心管中。将残留在PRS柱中的极性杂环胺用20 mL 0.5 mol/L醋酸铵洗脱至活化后的C18小柱中,经2 mL水洗脱杂质后用1 mL甲醇-氨水将极性杂环胺洗脱至离心管中,将两次洗脱的杂环胺充分混合后经22 μm微孔滤膜过滤至高效液相色谱(high performance liquid chromatography,HPLC)进样瓶,待分析[18]。
1.3.6 杂环胺检测分析
杂环胺是一种不易挥发的化学物质,所以很难用质谱检测,对杂环胺的检测使用的是串联有紫外检测器和荧光检测器的高效液相色谱法[19]。荧光检测器的检测限比紫外检测器的检测限要高,9 种杂环胺均通过这种HPLC检测出来。
样品中痕量杂环胺的定量检测依托于待测化合物标准曲线的绘制,本实验杂环胺标准溶液的配制及标准曲线的绘制参考万可慧等[18]的方法。
色谱条件:色谱柱为T S K-G e l O D S-8 0TM(250 mm×4.6 mm,5 μm);流速:1 mL/min;进样量:20 μL;柱温:30 ℃;采用二元流动相体系:流动相A为乙腈,流动相B为0.05 mol/L 醋酸-醋酸胺缓冲液(pH 3.6);DiMeIQx、MeIQx、MeIQ和IQ通过紫外检测器在263 nm波长激发下检测;Harman、Trp-p-1、Trp-p-2、Aac和PHIP则利用荧光检测器进行检测,激发光波长为300 nm,散射光波长为440 nm。
1.4 数据分析
2 结果与分析
2.1 9 种杂环胺的HPLC色谱及其标准品检测曲线
IQ、MeIQ、MeIQx、DiMeIQx 4 种极性杂环胺由紫外检测器检出,其出峰时间分别为8.2、10.4、14.2、15.3 min,非极性杂环胺Harman、Trp-p-2、Trp-p-1和Aac由荧光检测器检测出,其出峰时间分别为12.6、13.6、20.5、25.3 min,极性杂环胺PHIP也由荧光检测器检出,其出峰时间为15.2 min,见图1。9种杂环胺标准品的检测曲线、相关系数及线性范围见表1。


图1 9种杂环胺标准品混合溶液的紫外检测(A)及荧光检测(B)色谱图Fig.1 HPLC chromatograms of 9 HAs mixed standards detected by ultraviolet detection (A) and fl uorescence detection (B)
2.2 9 种杂环胺的检测品标准曲线

表1 9 种杂环胺标准品的线性关系、相关系数及线性范围Table1 Regression equations, correlation coeff i cients and linear ranges of 9 HAs
2.3 烟熏液的DPPH自由基清除能力
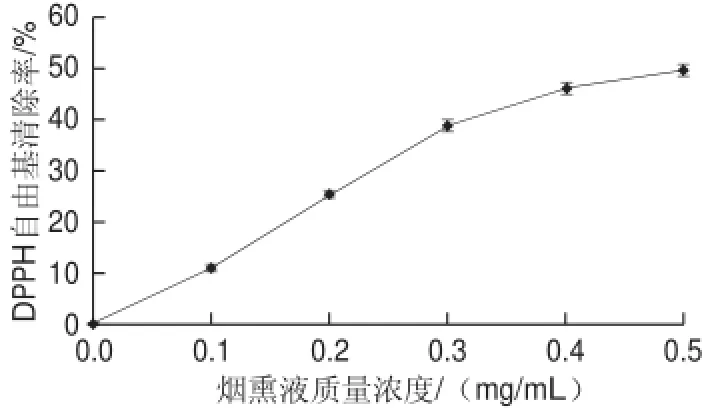
图2 DPPH自由基清除率随烟熏液不同质量浓度变化趋势Fig.2 DPPH radical scavenging activity of liquid smoke as a function of concentration
由图2可知,DPPH自由基清除率随着烟熏液质量浓度的增加而增加,烟熏液质量浓度和DPPH自由基清除率呈正相关。烟熏液质量浓度为0.1~0.3 mg/mL时DPPH自由基清除率增加较快,这是由于烟熏液刚加入时,烟熏液中各种酚类物质可以和DPPH自由基充分接触反应;烟熏液质量浓度为0.3~0.5 mg/mL时DPPH自由基清除率增速降低,随着烟熏液的不断加入,DPPH自由基已经被大量消耗,DPPH自由基与烟熏液之间的反应减少。
2.4 烟熏液的O2-·清除能力
由图3可知,烟熏液的O2-·清除能力与其质量浓度呈明显正相关。烟熏液质量浓度为0.2~0.6 mg/mL时清除率的增长较为迅速,而质量浓度为0.6~1.0 mg/mL时清除率的增长则较为缓慢。清除率增速先快后缓的趋势与DPPH自由基清除率一致,这是由于不论是清除DPPH自由基还是清除都是烟熏液中酚类物质在起作用,从而导致了两个结果的相似性。
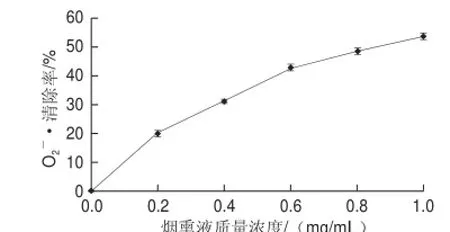
图3 清除率随烟熏液不同质量浓度变化趋势Fig.3 Superoxide anion radical scavenging activity of liquid smoke as a function of concentration
2.5 不同质量浓度烟熏液对卤煮牛肉中杂环胺含量的影响

表2 不同质量浓度烟熏液对卤煮牛肉中极性杂环胺含量的影响Table2 Effect of liquid smoke concentration on the contents of polar heterocyclic amines
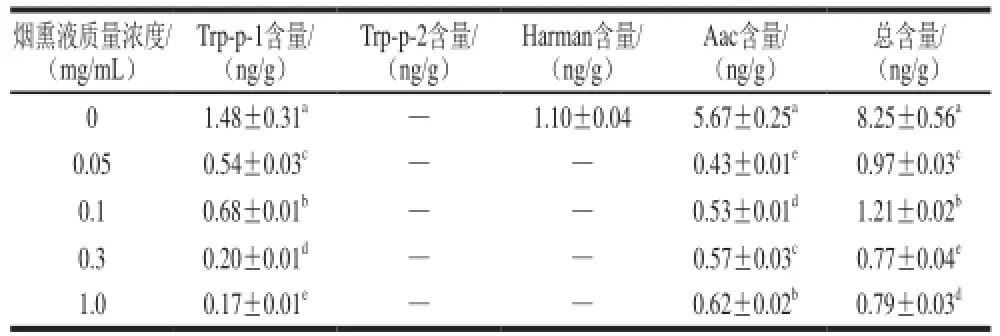
表3 不同质量浓度烟熏液对卤煮牛肉中非极性杂环胺含量的影响Table3 Effect of liquid smoke concentration on the contents of nonpolar heterocyclic amines
由表2、3可知,加有0 mg/mL烟熏液的样品(对照组)中含有8 种杂环胺,只有Trp-p-2未检测到,而有报道的研究结果[20]显示Trp-p-2的含量较高。加入烟熏液后非极性杂环胺和极性杂环胺总含量均显著下降(P<0.05)。对照组卤煮产生的PHIP最多,为56.47 ng/g,其次是MeIQx,为18.69 ng/g,其余6 种杂环胺含量均大于1 ng/g。
烟熏液的加入对于卤煮牛肉中杂环胺产生抑制作用,但是这些作用又不尽相同。加入0.05 mg/mL烟熏液后PHIP含量急剧下降,从56.47 ng/g下降到0.19 ng/g,说明烟熏液中的还原性成分极大地抑制了杂环胺的生成,但是随着烟熏液添加质量浓度的继续增长,PHIP的含量又显著增加(P<0.05)。烟熏液质量浓度对IQ、Aac含量的影响与PHIP类似。对于这3 种杂环胺,烟熏液的加入对其有极大的抑制作用,可以大幅降低其在卤煮牛肉中的生成,但是高质量浓度烟熏液中某些成分在卤煮的过程中可能会诱发这3 种杂环胺的产生。
加入0.05 mg/mL烟熏液后,卤煮牛肉中MeIQx的含量显著下降(P<0.05),从18.69 ng/g下降到0.67 ng/g。增大烟熏液的质量浓度,其含量继续下降,当加入1 mg/mL烟熏液后,卤煮牛肉中则检测不到MeIQx。DiMeIQx变化趋势也是如此,这说明烟熏液对于卤煮过程中这2 种杂环胺抑制效果与其质量浓度呈依赖性关系,加入烟熏液的质量浓度越高则对于这2 种杂环胺的抑制效果越好。
对照组中Harman的含量为1.10 ng/g,但是加入不同质量浓度烟熏液后,均没有检测到其存在,可能是因为烟熏液对于卤煮牛肉中Harman的生成具有很低的有效浓度。
综上,烟熏液可以抑制卤煮牛肉中的杂环胺的产生,且与其他天然或化学试剂[21-23]的抑制作用不同,加入其他物质后,能够抑制某些杂环胺的产生,但同时对于另一些杂环胺反而有促进产生的作用,但是烟熏液则对于实验中的9种杂环胺都有抑制作用。
2.6 不同卤煮时间对卤煮牛肉中杂环胺含量的影响

表4 不同卤煮时间对牛肉中极性杂环胺含量的影响Table4 Effect of stewing time on the contents of polar heterocyclic amines

表5 不同卤煮时间对牛肉中非极性杂环胺含量的影响Table5 Effect of stewing time on the contents of nonpolar heterocyclic amines
由表4、5可知,卤煮加工可以诱发杂环胺的大量产生,未经任何处理的鲜牛肉(0 h组),只检测出PHIP和MeIQx,而经卤煮后,9 种杂环胺均可检测出。
冯云等[24]研究烘烤对于肉制品中杂环胺的影响时得出结论:烘烤时间越长,产生的杂环胺越多。由表4、5可知,卤煮1 h时,非极性杂环胺总量仅为5.46 ng/g,而卤煮4 h后非极性杂环胺总量为14.25 ng/g,极性杂环胺也从1 h的0.96 ng/g增加到6.93 ng/g。卤煮1 h各种杂环胺产生量较低,而Trp-p-2和Harman均未被检测到;卤煮2 h时,各种杂环胺的量均有所上升,但上升程度并不是很大;当卤煮时间超过3 h时,各种杂环胺的产生量则急剧上升,Aac的产生量更是从0.39 ng/g上升到1.57 ng/g,增加了4 倍左右;卤煮4 h产生杂环胺的量相对于3 h也有较大的上升,但是上升的幅度有所降低。所以卤煮时间越长,产生的杂环胺越多,2 h是一个关键点,当卤煮时间低于2 h时,产生的杂环胺以及杂环胺的上升量并不多,但是卤煮时间超过2 h时,产生的杂环胺量则成倍增加,说明2~3 h这段时间是卤煮过程中杂环胺的累积期,为了避免这段累积期,平时卤煮食物时尽量不要超过2 h。
3 结 论
烟熏液作为一种从天然硬木干馏提取出来的香料物质,不仅能使肉类制品产生传统的烟熏味,而且在液熏的过程中减少传统加工有害物质的产生[25]。本实验测定了烟熏液的DPPH自由基清除率和超氧阴离子自由基清除率,发现少量的烟熏液就具有极高的清除效率。将烟熏液加入到牛肉中进行卤煮时,可以在很大程度上抑制卤煮过程中各种杂环胺的产生。在同样加入0.1 mg/mL烟熏液的情况下,卤煮时间越长,产生的杂环胺越多,卤煮2 h是一个分界点,少于2 h产生的杂环胺较少,超过2 h则会产生大量的杂环胺,因此在平时卤煮牛肉时尽量将时间控制在2 h之内。
[1] SUGIMURA T, NAGAO M, KAWACHI T, et al. Mutagens carcinogens in food, with special reference to highly mutagenic pyrolytic products in broiled foods[M]. State of New York: Cold Spring Harbor Laboratory Press, 1977.
[2] WARD M H, SINHA R, HEINEMAN E F, et a1. Risk of adenocarcinoma of the stomach and esophagus with meat cooking method and doneness preference[J]. International Journal of Cancer, 1997, 71(1): 14-19.
[3] HIROSE M, NISHIKAWA A, SHIBUTANI M, et a1. Chemoprevention of heterocyclic amin-induced mammary carcinogenesis in rats[J]. Environmental and Molecular Mutagenesis, 2002, 39(23): 27l-278.
[4] PAIS P, SALMON C P, KNIZE M G, et al. Formation of mutagenic/ carcinogenic heterocylic amines in dry-heated model systems, meats and meat drippings[J]. Journal of Agricultural and Food Chemistry, 1999, 47: 1098-1108.
[5] 何计国, 甄润英. 食品卫生学[M]. 北京: 中国农业大学出版社, 2003.
[6] ROHRMANN S, HERMANN S, LINSEISEN J. Heterocyclic aromatic amine intake increases colorectal adenoma risk: findings from a prospective European cohort study[J]. The American Journal of Clinical Nutrition, 2009, 89(5): 1418-1424.
[7] OZ F, KABAN G, KAYA M. Effects of cooking methods on the formation of heterocyclic aromatic amines of two different species of trout[J]. Food Chemistry, 2007, 104(1): 67-72.
[8] PUANGSOMBAT K, GADGIL P, HOUSER T A, et al. Heterocylic amine content in commercial ready to eat meat products[J]. Meat Science, 2011, 88(2): 227-233.
[9] 姚瑶, 彭增起, 邵斌, 等. 20种市售常见香辛料的抗氧化性对酱牛肉中杂环胺含量的影响[J]. 中国农业科学, 2012, 45(20): 4252-4259.
[10] KIKUGAWA K, KATO T, HIRAMOTO K, et a1. Participanon of the pyrazine cation radical in the formation of mutagens in the reaction of glucos/glycine/creatinine[J]. Mutation Rcsearch/Genetic Toxicology and Environmental Mutagenesis, 1999, 444(1): 133-144.
[11] 王旗, 姜绍通, 蔡克周, 等. 液熏灌肠质构改良配方的研究[J]. 肉类研究, 2012, 26(9): 9-14.
[12] 姜绍通, 王旗, 蔡克周, 等. 顶空固相微萃取-气质联用法测定山楂核烟熏液的挥发性风味物质[J]. 食品科学, 2013, 34(18): 206-211.
[13] STJEPAN M, DAMIR I, BOZIDAR S G. A novel amperometric method for antioxidant activity determination using DPPH free radical[J]. Bioelectrochemistry, 2005, 68(2): 175-180.
[14] RE R, PELLEGTINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J]. Free Radical Biology and Medicine,1999, 26(9): 1231-1237.
[15] 孙晓明, 卢凌, 张佳程, 等. 牛肉化学成分的近红外光谱检测方法的研究[J]. 光谱学与光谱分析, 2011, 31(2): 379-383.
[16] 姚瑶. 牛肉食品中的杂环胺[J]. 肉类研究, 2011, 25(5): 73.
[17] CROSS G A, GRUTER A. Quantitation of mutagegnic/carcinogenic heterocyclic aromatic amines in food products[J]. Journal of Chromatography A, 1992, 592(1): 271-278.
[18] 万可慧, 彭增起, 邵斌, 等. 高效液相色谱法测定牛肉干制品中10种杂环胺[J]. 色谱, 2012, 30(3): 285-291.
[19] 秦川, 郑宗平, 曾茂茂, 等. 加工肉制品中杂环胺的检测方法及抑制措施的研究进展[J]. 食品工业科技, 2013, 34(3): 370-374.
[20] 邵斌, 彭增起, 杨洪生, 等. 固相萃取-高效液相色谱法同时测定传统禽肉制品中的9种杂环胺类化合物[J]. 色谱, 2011, 28(8): 755-761.
[21] TAI C Y, LEE K H, CHEN B H. Effect of various additives on the formation of heterocyclic amines in fried fi sh fi bre[J]. Food Chemistry, 2001, 75(3): 309-316.
[22] GIBIS M, WEISS J. Antioxidant capacity and inhibitory effect of grape seed and rosemary extract in marinades on the formation of heterocyclic amines in fried beef patties[J]. Food Chemistry, 2012, 134(2): 766-774.
[23] QUELHAS I, PETISCA C, VIEGAS O, et al. Effect of green tea marinades on the formation of heterocyclic aromatic amines and sensory quality of pan-fried beef[J]. Food Chemistry, 2010, 122(1): 98-104.
[24] 冯云, 彭增起, 崔国梅, 等. 烘烤对肉制品中多环芳烃和杂环胺含量的影响[J]. 肉类工业, 2009(8): 27-30.
[25] 何宇洁, 蔡克周, 刘梦杰, 等. 液熏灌肠产品加工工艺研究[J]. 肉类研究, 2011, 25(11): 14-19.
Effect of Liquid Smoke on the Contents of Nine Heterocyclic Amines in Stewed Beef
YANG Xiao1, CAI Ke-zhou1,*, LU Jin-feng2, MENG Jun-xiang2, JIANG Shao-tong1, PAN Li-jun1
(1. Key Laboratory for Agricultural Products Processing of Anhui Province, School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China; 2. Anhui Baodi Meat Food Co. Ltd., Huaibei 235000, China)
In the present study, the effects of liquid smoke on the contents of 9 heterocyclic amines in stewed beef were studied. The results showed that only PHIP and MeIQx were detected and the total amount was 0.16 ng/g. The kinds and amounts of heterocyclic amines (HAAs) were signi fi cantly increased with the extension of stewing time (P < 0.05). Totally 9 kinds of HAAs at a level of 21.18 ng/g were detected after 4 h stewing. The addition of liquid smoke could decrease the amount of HAAs from stewed beef. The amount of HAAs in stewed beef was remarkably decreased from 92.72 to 7.35 ng/g with the addition of 0.05 mg/mL liquid smoke (P < 0.05). This study demonstrated that the capability of liquid smoke in decreasing the production of HAAs was probably correlated with its antioxidant properties.
liquid smoke; antioxidant; heterocyclic amine; stewed beef
TS251.52
A
1002-6630(2014)21-0068-05
10.7506/spkx1002-6630-201421014
2014-07-01
中央高校基本科研业务费专项资金项目(2012HGQC0017);淮北市重大科技攻关项目(20120103)
杨潇(1991—),男,硕士研究生,研究方向为肉制品加工。E-mail:13866148072@163.com
*通信作者:蔡克周(1980—),男,副教授,博士,研究方向为畜禽产品加工与副产物综合利用。E-mail:kzcai@hfut.edu.cn
