布氏菌活疫苗皮内与皮下接种的免疫效果评价
2014-02-28解晓露李恪梅付丽丽黄长江王国治
解晓露,陈 成,魏 东,李恪梅,付丽丽,黄长江,王国治,
(1.温州医科大学环境与公共卫生学院,浙江温州 325035;2.中国食品药品检定研究院结核病疫苗室,北京 100050)
布氏菌活疫苗皮内与皮下接种的免疫效果评价
解晓露1,陈 成1,魏 东2,李恪梅2,付丽丽1,黄长江2,王国治1,2
(1.温州医科大学环境与公共卫生学院,浙江温州 325035;2.中国食品药品检定研究院结核病疫苗室,北京 100050)
将布氏减毒活疫苗通过皮内注射和皮下注射方式免疫小鼠,比较2种方式的免疫效果。用布氏菌活疫苗,通过皮内和皮下注射免疫小鼠,免疫4周后分离血清及脾脏淋巴细胞。E L I SA法检测免疫动物血清中总Ig G抗体;E L I SP 0 T法检测分泌I F N-γ、I L-4的脾脏淋巴细胞数目,同时用E L I SA方法检测体外再刺激后小鼠脾细胞分泌I F N-γ、I L-4的水平;用流式细胞仪对T淋巴细胞亚群进行分类;用羊布鲁氏菌弱毒株M 5攻击免疫动物,通过脾脏细菌计数评价布氏活疫苗的免疫保护作用。E L I SA、E L I SP 0 T和T淋巴细胞亚群分类结果显示,2种免疫途径均能诱导较强的体液免疫和细胞免疫应答,但两者间无显著差异;B A L B/c小鼠攻毒试验显示皮内注射组脾脏中布氏菌数量的对数值为0,皮下注射组为2.27±0.21,阴性对照组为5.13±0.16。由此可知,2种免疫方法均能诱导较强的体液免疫和细胞免疫应答,但皮内注射组的免疫保护作用显著优于皮下注射组,提示通过皮内注射布氏疫苗可能是安全、高效的免疫途径。
布氏疫苗;免疫途径;体液免疫;细胞免疫;保护力
布鲁菌属(B r uc e l l a),又称布鲁斯菌属,因最早由美国医师D a v i d B r uc e首次分离而得名。布鲁菌属细菌是人畜共患传染病的病原菌,有6个生物种,19个生物型,但经DNA-DNA杂交研究证明本属只有1个生物种,其他均为生物变种[1]。布鲁氏菌具有侵袭力强、传染途径多、引起多器官损伤的特点。家畜感染后若得不到良好的治疗可引发母畜流产和不育,人感染则主要引起波浪热和转化为慢性感染[2-3]。流行病学调查显示,我国畜间布病流行情况大致经历了3个阶段:20世纪50-70年代为高发期,部分省区疫情相当严重,尤其是在牧区,严重地区的人畜感染率达到60%~70%;80-90年代为基本控制期,由于增加了投入,布病疫情得到基本控制,布病阳性率大幅下降;2000年后为反弹期,布病疫情出现上升趋势,家畜布病总的阳性率高达75%[4],每年造成近千万元损失。
疫苗接种是防治布病最有效、最经济的手段。目前,我国采用的人用布氏菌活疫苗[5]为牛种弱毒株104M菌株,接种方式为皮上划痕。该方法操作复杂、不能定量接种,接种阳转率低且保护效果有限,被接种者因划痕产生疼痛不易被接受,从而影响疫苗的广泛使用。鉴于布病疫情控制的需要,本研究采用皮下和皮内2种注射方式免疫小鼠,从体液免疫、细胞免疫和保护力试验3个方面的结果全面评价不同免疫途径的免疫效果。
1 材料与方法
1.1 材料
SP F级B A L B/C小鼠30只,6~8周,白色雌性,中国食品药品检定研究院(简称中检院)试验动物中心提供(试验动物生产许可证号SC X K(京)2009-0017),饲养于中国食品药品检定研究院清洁级动物室。
皮内和皮下注射用布氏活疫苗和羊布氏菌M 5弱毒株均由中检院结核病疫苗室保存。
B r-P P D蛋白由中检院结核病疫苗室提供,制备方法见参考文献[6]。
仪器试剂有生物安全柜(telstar bio-Ⅱ-A)、酶标仪(Labsys tmsDragon-MK 3)、恒温培养箱(天
津市泰斯特仪器-D H 6000A B型)、高速离心机(德国eppendorf-5415D)、Immuno Spot Analy zer(CTLImm unSpot)、C 02培养箱(Napco Scientific company)和ELISP0T斑点读数仪(Cellµ L a r T e c hno l og yL t d.)。
布氏菌培养基(脑心琼脂购自美国B D公司),牛血清白蛋白(B SA)和C o nA(美国Sig m a公司),E L I SP 0 T试剂盒(Mo us e I F N-γ及I L-4 E L I Spo t K i t)购自美国B D公司,达优-淋巴细胞分离液、无血清培养基、I F N-γ及I L-4 E L I SA预包被试剂盒均购自深圳达科为公司,碱性磷酸酶标记羊抗小鼠Ig G(美国B e t hy l公司),pN P P底物显色液(Sur Mo di c s)。
1.2 方法
1.2.1 分组及免疫
将30只6~8周龄SP F级B A L B/C小鼠随机分成3组,每组10只。第1组为皮内注射组(5 x 107个·只-1),第2组为皮下注射组(5 x 107个·只-1),第3组为阴性对照组(生理盐水)。免疫4周后,摘眼球取血,4℃放置4 h后分离血清(3 000 r·m i n-1,20 min),-20℃保存。
1.2.2 抗体水平检测
用间接E L I SA法检测小鼠血清中Ig G的效价。以B r-P P D蛋白4µg·m L-1的浓度包被96孔酶标板,4℃过夜;T B S-T300µL洗板5次,用1%的B SA封闭(200µL·孔-1),37℃静置2 h;每孔加入100µL的20倍开始倍比稀释的待检血清,37℃静置2 h;按1∶2 500稀释的碱性磷酸酶标记抗小鼠Ig G,洗板后每孔加入100µL,37℃静置1 h;洗板,每孔加入100 µL的pN P P底物显色液,室温避光60 min后,在波长为405 nm处检测吸光值。
1.2.3 细胞免疫检测
分泌I F N-γ、I L-4的脾脏淋巴细胞数目检测。免疫4周后,分离小鼠脾脏淋巴细胞。取96孔细胞培养板,每孔添加混有2.0 x 106个·m L-1浓度细胞100 µL,分别加入100µL布氏P P D抗原和布氏B p26抗原(终浓度均为10µg·m L-1)2种抗原刺激。每种抗原刺激物做复孔,另用细胞培养液作阴性对照,1孔加C o nA作阳性对照(终浓度为5µg·m L-1)。共同孵育22 h后,按E L I SP 0 T操作,依次加入检测抗体等试剂,洗板,显色,计数斑点数。
体外再刺激免疫小鼠脾细胞因子产生水平检测。取48孔细胞培养板,每孔中加2.0 x 106个· m L-1浓度细胞400µL,每孔分别加入50µL布氏P P D抗原和布氏B p26抗原(终浓度为10µg· m L-1)2种抗原刺激。分别以C o nA(终浓度为5 µg·m L-1)和培养基为阳性和阴性对照。37℃, 5%C 02培养箱中孵育22 h,孵育完毕后,对培养物进行离心,取各孔细胞培养液上清,用小鼠I F N-γ、I L-4 E L I SA试剂盒检测体外不同刺激物刺激小鼠脾细胞分泌I F N-γ、I L-4的情况。
1.2.4 T淋巴细胞亚群分类
将1.2.3中分离的脾脏细胞调整细胞数为1.0 x 107个·m L-1,每孔分别加入10µL的刺激物和200µL的细胞,刺激物为布氏P P D抗原和布氏B p26抗原(终浓度为10µg·m L-1)2种抗原,分别用P MA/离子霉素和培养基为阳性和阴性对照,共同孵育3 h后,每孔加入10µL的阻断剂。12 h后进行胞外C D 3和C D 4及胞内I F N-γ、I L-4的染色,流式细胞仪测定,C e l l que s t软件分析。
1.2.5 布鲁氏菌活疫苗免疫保护力检测
对每组剩余的5只动物皮下攻击羊种布氏菌M 5弱毒株,攻击剂量为5 x 108个·只-1,攻击部位为后肢皮下。4周后断颈处死动物,无菌取脾脏,通过每个脾脏细菌计数比较布鲁氏菌活苗2种免疫方式的保护效果。
试验数据以ˉX±S表示,各组免疫动物的抗体和细胞因子效价取以10为底的对数后进行t检验;用G r a phP a d P r i s m 6绘图及SP SS统计软件分析。结果以P<0.05表示差异显著,具有统计学意义。
2 结果与分析
2.1 血清中总IgG水平
图1显示,阴性小鼠组检测不到特异性抗体,皮内注射组和皮下注射组均能产生高滴度抗体, Ig G效价分别为642.23和640.00,分析表明,两者间差异不显著(t=0.006,n=10)。
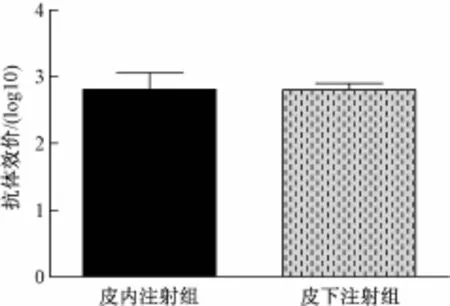
图1 血清Ig G抗体效价
2.2 酶联免疫斑点(E L I S OP T)
2.2.1 P P D和B p26抗原刺激后分泌I F N-γ的脾脏淋巴细胞数目
将已形成斑点的96孔板终止反应,自然风干过夜后上计数仪计数并拍照,对每孔内的斑点进行质控。最终斑点计数显示(图2),皮内注射组和皮下注射组在P P D和B p26抗原刺激下分泌的I F N-γ的脾脏淋巴细胞数均明显高于阴性对照组,差异显著;但在P P D抗原刺激下,皮内组与皮下组相比差异不显著(t=3.069,n=10),在B p26抗原刺激下,皮内组与皮下组相比,差异显著(t= -2.914,n=10)。

图2 不同刺激物对淋巴细胞分泌I F N-γ斑点数的影响
2.2.2 P P D和B p26抗原刺激后分泌I L-4的脾脏淋巴细胞数目
将已形成斑点的96孔板终止反应,自然风干过夜后上计数仪计数并拍照,对每孔内的斑点进行质控。最终斑点计数显示(图3),皮内注射组和皮下注射组在P P D和B p26抗原刺激下分泌的I L-4的脾脏淋巴细胞数均明显高于阴性对照组,差异显著;但在P P D抗原刺激下,皮内组与皮下组相比差异不显著(t=1.986,n=10),在B p26抗原刺激下,皮内组与皮下组相比差异不显著(t= 1.752,n=10)。
2.3 体外再刺激免疫小鼠脾细胞因子
利用E L I SA方法检测以P P D抗原和B p26抗原体外刺激小鼠脾细胞分泌I F N-γ、I L-4水平。图4显示,在P P D和B p26抗原刺激下,分泌I F N-γ的含量明显高于阴性组,差异显著;但在P P D抗原刺激下,皮内组与皮下组相比差异不显著(t=1.714,n=10),在B p26抗原刺激下,皮内组与皮下组相比差异不显著(t=-1.878,n=10)。I L-4含量很低,超出了标准曲线的检测限,结果无统计学意义。

图3 不同刺激物对淋巴细胞分泌I L-4斑点数的影响

图4 不同刺激物体对小鼠脾细胞分泌I F N-γ含量的影响
2.4 T细胞亚群分类
2.4.1 P P D和B p26抗原刺激后C D 4+I F N-γ淋巴细胞比例
图5显示,由流式细胞分析仪分析后得到,皮内注射组和皮下注射组在P P D和B p26抗原刺激下小鼠的C D 4+I F N-γ细胞比例均高于阴性组,差异显著;但在P P D抗原刺激下,皮内组与皮下组相比差异不显著(t=0.429,n=10),在B p26抗原刺激下,皮内组与皮下组相比差异不显著(t=-0.555,n=10)。
2.4.2 P P D和B p26抗原刺激后C D 4+I L-4淋巴细胞比例
图6显示,由流式细胞分析仪分析后得到,皮内注射组和皮下注射组在P P D和B p26抗原刺激下,小鼠的C D 4+I L-4细胞比例均高于阴性组,差异显著;但在P P D抗原刺激下,皮内组与皮下组相比差异不显著(t=-0.429,n=10),在B p26抗原刺激下,皮内组与皮下组相比差异不显著(t=0.2.372,n=10)。
2.5 布鲁氏菌活苗免疫保护性
为比较2种免疫方式的免疫保护力,用羊布氏
菌M 5弱毒株皮下攻击,以脾脏布氏菌载量为指标,评价免疫保护力。表1显示,皮内注射组脾组织含菌数对数值的平均数为0,皮下注射组为2.27 ±0.21,阴性对照组为5.13±0.16。
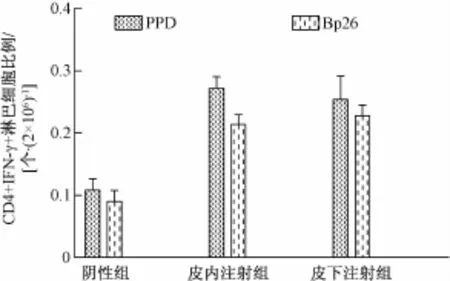
图5 不同刺激物刺激小鼠C D 4+I F N-γ淋巴细胞比例

图6 不同刺激物刺激小鼠C D 4+I L-4淋巴细胞比例

表1 2种方法免疫豚鼠在羊M 5攻击感染后脾脏细胞中的细菌载量
3 小结和讨论
目前,接种疫苗是世界公认的能够降低布病发生和传播的最有效和最经济的方法。我国采用的是牛种弱毒株104M菌株制成的减毒活疫苗,一般只需接种1次,剂量较小,副反应轻微或无,且免疫效果优于灭活疫苗,免疫较持久,能同时产生细胞免疫和体液免疫,是应用最广泛的疫苗形式之一。但该疫苗的接种方式为皮上划痕,不仅接种复杂,不能定量,还经常伴有局部或异常反应,使被接种者皮肤有损伤且划痕时疼痛,同时会遗留疤痕,因此改善布氏疫苗的免疫途径成为研究的热点,国内外均有学者正在对布氏疫苗的免疫方法进行深入的研究和探索[7-8]。
本试验用E L I SA法检测免疫动物血清中总Ig G抗体的含量,结果显示,皮内组和皮下组Ig G抗体效价分别为642.23和640.00,说明抗体效价并不高,这与试验预期是相符合的,因为布氏菌是一种胞内寄生菌,对其清除起关键作用的是细胞免疫,而体液免疫仅起辅助作用。同时,用E L I SP 0 T法检测分泌I F N-γ、I L-4的脾脏淋巴细胞数目时发现,分泌I F N-γ的脾脏淋巴细胞数高于分泌I L-4的脾脏淋巴细胞数;用E L I SA方法检测体外再刺激后小鼠脾细胞分泌细胞因子的情况时发现,I F N-γ的分泌水平远远高于I L-4;这说明T h1细胞是参与细胞免疫的主要免疫细胞,这与减毒活疫苗的作用机理相符[9-10]。
疫苗的效力测定试验是评价疫苗免疫保护性最可靠指标。传统对布氏疫苗的研究主要是使用豚鼠,效力试验用强毒株攻击,本研究参照中国药典效力测定的方法[11],以小鼠为动物模型,羊布氏菌M 5弱毒株攻击,大大提高了试验的经济性和安全性。结果显示,皮内注射组脾脏中布氏菌数量的对数值为0,皮下注射组为2.27±0.21,该数据说明皮内注射可大大增强机体对抗布氏菌的保护力,提示通过皮内注射布氏疫苗可能是安全、高效的免疫途径,为研究布氏菌活疫苗接种途径奠定基础。
虽然皮下和皮内2种免疫途径均能诱导显著高于对照组的体液免疫和细胞免疫应答,但两者在诱导体液和细胞免疫应答的强度上并无显著差异,而在保护力试验中,皮内注射组却显著优于皮下注射组,这说明保护力的高低和免疫应答的强度之间并无明显正相关联系,本课题组会就该课题继续进行深入研究。
[1] 贾文祥.医学微生物学[M].北京:人民卫生出版社, 2010:177.
[2] 郭玉金,田桂芹,普燕芳,等.临床药师参与1例布鲁氏菌病诊疗过程分析[J].中国病原生物学杂志,2011,6(11):845-847.
[3] 许彦萍,芦文明,卫学东.浅谈布鲁氏菌病的流行及防控[J].中国畜牧兽医文摘,2013(12):81.
[4] 任光文,柳根潭.布鲁氏菌病的防控[J].中国畜牧兽医文摘,2013(11):80-81.
[5] 刘景福,李恪梅,佘菲菲,等.四唑鎓盐法快速检测布氏菌疫苗活菌含量的建立[J].中国地方病防治杂志, 2011,26(2):103-106.[6] 李恪梅,王国治,黄健,等.布氏菌素纯蛋白衍生物的研制[J].中国地方病防治杂志,1995,10(5):268.
[7] 陈成,魏东,李恪梅,等.注射用布氏菌活疫苗免疫学评价[C]//中国药学会.2013年中国药学大会暨第十三届中国药师周论文集.北京:中国药学会,2013:7.
[8]WangZ, Wu Q.Research progressin liveattenuated brucellavaccine development [ J]. Current PharmaceuticalBiotechnology, 2013.
[9] 姚俊峰.禽沙门氏菌病、疫苗和免疫保护机制:现状和前景[J].国外畜牧学:猪与禽,2013(1):34-38.
[10] 谢勇飞.布鲁氏菌减毒活疫苗株a dh缺失标记及其鉴别诊断研究[D].南京:南京农业大学,2011.
[11] 国家药典委员会.中国人民共和国药典[M].3部.北京:化学工业出版社,2005:77-79.
(责任编辑:张瑞麟)
S 829.1文献标志码:A文章编号:0528-9017(2014)05-0767-04
2014-03-17
重大新药创制科技重大专项(2014Z X 09304311-002)
解晓露(1989-),女,安徽合肥人,硕士生,研究方向为免疫学。E-mail:x i a o l ux i e 126@126.com。
王国治。E-mail:t bt e s t l a b@v i p.t o m.com。
黄长江。E-mail:c j hua ng 5711@163.com。
文献著录格式:解晓露,陈成,魏东,等.布氏菌活疫苗皮内与皮下接种的免疫效果评价[J].浙江农业科学,2014(5):767-770,779.
