RGD修饰的腺病毒介导的ING4对人鼻咽癌细胞裸鼠移植瘤的影响
2014-02-27王奕鸿刘济生盛伟华杨吉成
王奕鸿,刘济生,盛伟华,杨吉成
RGD修饰的腺病毒介导的ING4对人鼻咽癌细胞裸鼠移植瘤的影响
王奕鸿,刘济生,盛伟华,杨吉成
目的研究RGD修饰的腺病毒介导的ING4对人鼻咽癌细胞(CNE)裸鼠移植瘤的影响并探讨其可能调节机制。方法 用RGD修饰的ING4单基因腺病毒载体(Ad.RGD-ING4)及腺病毒空载体(Ad.RGD-GFP)感染CNE细胞,RT-PCR法及Western blot法检测ING4基因的表达水平。采用CNE细胞株来建立15只人鼻咽癌裸鼠模型,分为PBS组、Ad.RGD-GFP及Ad.RGD-ING4组,每组5只。分别对瘤体内局部注射相应的干预用药,动态测量肿瘤体积,免疫组化检测Caspase-3基因的表达。结果 CNE细胞感染Ad.RGD-ING4 72 h后,ING4在CNE细胞中过表达,Ad.RGD-ING4组肿瘤体积明显小于PBS组及Ad.RGD-GFP组(P<0.01),免疫组化结果显示Ad.RGD-ING4组比其余两组Caspase-3基因的表达明显上调(P<0.01)。结论 Ad.RGD-ING4抑制人鼻咽癌细胞裸鼠移植瘤的生长,可能的机制是通过上调Caspase-3基因促进肿瘤细胞凋亡。
Ad.RGD-ING4;鼻咽肿瘤;基因,肿瘤;Caspase-3;裸鼠
鼻咽癌为我国发病率较高的肿瘤之一,大多为 低分化鳞癌,治疗以放疗或放化疗结合为主,但因其位置隐蔽,早期症状不典型,所以早期诊断及治疗比例低,远处转移率及复发率均较高。且因放疗或放化疗毒性作用及并发症较多,患者的依从性、耐受性仍然较差。随着科研水平的提高,我们对鼻咽癌的研究也越来越深入,生物基因治疗鼻咽癌的作用也日渐引起普遍关注。基因治疗是一种具有巨大潜力的新型肿瘤治疗策略。尤以腺病毒基因重组表达载体的肿瘤基因治疗研究应用较多。近年来发现和命名的 ING4是一种新型抑癌基因,于2003年被Shiseki等[1]鉴定,2004年在Nature杂志正式被认定为一种重要的肿瘤生长抑制因子[2],其可以通过多种途径发挥特异性抗肿瘤效应,靶向诱导肿瘤细胞凋亡。因此,本研究用RGD修饰的ING4单基因腺病毒载体(Ad.RGD-ING4)感染人鼻咽癌细胞(CNE)裸鼠移植瘤,观察肿瘤的生长情况,并探讨其可能的机制。
1 材料和方法
1.1 动物及试剂 雌性BALB/c裸鼠15只,4周龄,体重18~22 g,购自上海斯莱克实验动物有限责任公司。Ad.RGD-ING4和RGD修饰的腺病毒空载体(Ad.RGD-GFP)由苏州大学基础医学院细胞和分子生物学教研室提供。CNE购自南京凯基生物有限公司,小牛血清及RPMI-1640购自GIBGO公司;各上下游引物购自南京金斯瑞生物技术有限公司;小鼠抗人ING4抗体购自Santa Crutz公司;β-actin抗体购自上海碧云天生物技术有限公司,Dylight 800-Labeled Antibody荧光二抗购自美国KPL公司。Caspase-3抗体购自ABCAM公司。
1.2 实验方法
1.2.1 细胞培养:含10%小牛血清的1640培养液培养CNE细胞,置37℃、5%CO2的细胞培养箱中,待细胞长满培养瓶,用0.25%胰酶进行消化传代。
1.2.2 测定RGD修饰的重组腺病毒对CNE的最佳感染复数(MOI):将对数生长期的CNE稀释成浓度为105/ml的细胞悬液,按每孔100μl接种于96孔板,继续培养。于24 h后将 Ad.RGD-GFP(1×109pfu/ml)分别以 MOI为 1、10、25、50、100、200 感染CNE,继续培养。每组各设5个复孔,72 h后观察细胞,细胞形态正常、以荧光强度达80%以上的最低感染剂量组为最佳MOI,实验重复3次。
1.2.3 RT-PCR及Western blot鉴定ING4基因的转录及翻译:将细胞分为CNE细胞对照组(PBS组):1 ×105/ml CNE+0.1 mol/L PBS;腺病毒空载体对照组(Ad.RGD-GFP组):1×105/ml CNE+最佳MOI Ad.RGD-GFP;ING4单基因治疗实验组(Ad.RGD-ING4组):1×105/ml CNE+最佳 MOI Ad.RGD-ING4。按上述分组用 PBS、Ad.RGD-GFP、Ad.RGD-ING4处理处于对数生长期的CNE细胞,感染72 h收集细胞用Trizol法分别抽提总RNA,按逆转录试剂盒说明书进行逆转录合成cDNA,用GAPDH-F:5'-TGATGACATCAAGAAGGTGGTGAA-3'、GAPDH-R:5'-TCCTTGGAGGCCATGTGGGCC-3';ING4-F:5'-GCAAGCTTCTATTTCTTCTTCCGTTCTTGGGAG-3'、ING4-R:5'-ATTTGCGGCCGCATGGGGGTACTGCTCACACAGA-3'引物,参考PCR说明书并摸索退火温度进行PCR,检测腺病毒介导的外源性ING4基因在CNE细胞中的转录,实验重复3次。同上收集上述细胞,提取总蛋白上清,以4∶1比例与5×SDS蛋白上样缓冲液充分混匀,100℃煮沸5 min,然后进行SDS-PAGE电泳(浓缩胶、分离胶浓度分别为5%、12%),再把蛋白转移至PVDF膜上,用5%脱脂奶粉将PVDF膜封闭后,分别用鼠抗人-actin抗体和鼠抗人ING4稀释液作用,用TBST洗涤3次,再分别加Dylight-800标记的荧光二抗,37℃避光1 h,TBST避光洗涤3次/5 min;最后在荧光成像仪上进行拍照,以上实验重复3次。
1.2.4 CNE裸鼠移植瘤模型的建立:用含10%小牛血清的RPMI-1640培养基培养CNE细胞,放置在5%CO2、37℃的培养箱中。先用PBS洗涤处于对数生长期的CNE细胞,用0.25%胰酶消化,并离心5 min,收集细胞,并制备5.0×107/ml的细胞悬液。取4周龄SPF级BALB/c雌性裸鼠15只,裸鼠右前腋下用安尔碘常规消毒后,每只裸鼠皮下注射100μl的细胞悬液,并观察CNE细胞在裸鼠右前腋下成瘤情况。
1.2.5 实验的分组及处理方法:裸鼠皮下接种CNE 2周左右,待肿瘤长至200 mm3左右时,计为第0天,将裸鼠随机分成3组,每组5只,瘤体内多点注射干预药物,隔日1次,共注射6次。PBS组:每次注射100μl PBS;Ad.RGD-GFP组:每次注射1×109pfu/ml Ad.RGD-GFP 100 μl;Ad.RGD-ING4 组:每次注射1×109pfu/m l Ad.RGD-ING4 100 μl。
1.2.6 瘤体体积观察:第1次治疗前(记为0 d)及开始治疗后每隔1 d用游标卡尺测量各组裸鼠瘤体的长径(a)、短径(b),从而计算肿瘤体积V=(a×b2)/2,共测量8次,观察不同时间移植瘤体积变化,并进一步分析Ad.RGD-ING4对裸鼠CNE移植瘤的抑瘤作用。
1.2.7 免疫组化检测:治疗15 d后,将裸鼠脱颈处死摘取瘤体,将各实验组的瘤体组织以10%中性福尔马林固定,石蜡包埋并行组织切片,进行HE染色和免疫组化检测。HE染色用来观察各瘤体组织中细胞形态的变化,初步判断CNE细胞的凋亡情况。用免疫组化检测Caspase-3在CNE移植瘤中表达,以细胞质或细胞核内出现棕褐色或棕黄色颗粒为阳性细胞。将每组的每张切片随机挑选3个200倍视野进行拍照。应用Image-Pro Plus 6.0软件对每张照片进行分析,从而得出每张照片的累积光密度值即IOD值。IOD值越大,表示阳性表达越强。而每组所有照片的平均IOD值代表该实验组的IOD值。
1.3 统计学方法 应用SPSS 16.0软件进行数据分析,计量资料以均数±标准差(±s)表示,采用单因素方差分析,α=0.05为检验水准。
2 结果
2.1 RGD修饰的重组腺病毒的最佳MOI Ad.RGD-GFP 组中,MOI为 1、10、25、50、100 的 CNE 细胞荧光强度分别为5%、20%、55%、95%、98%,所感染的CNE细胞形态均正常,且生长良好,而MOI为200组中CNE细胞出现脱落、细胞形态发生变化,出现细胞毒性作用,并呈现强荧光100%;而MOI为50、100组均未见细胞毒性,并且有>90%的CNE表达GFP荧光蛋白,提示腺病毒感染CNE细胞的最佳MOI为50剂量组。
2.2 ING4在CNE细胞中的表达 RT-PCR结果显示,Ad.RGD-ING4组在750 bp位置可检测到1条ING4特异性条带;Western blot显示Ad.RGD-ING4在相应位置可产生和抗ING4抗体结合的特异性条带,而PBS组和Ad.RGD-GFP组均没有出现相应的上述条带,见图1。RT-PCR及 Western blot鉴定Ad.RGD-ING4能介导外源性ING4基因在CNE细胞中成功转录及翻译。
2.3 CNE细胞裸鼠模型的建立 在裸鼠右前腋下的皮下接种CNE细胞,3 d内可见接种处皮丘慢慢变小,5 d后变成实性结节并逐渐增大,8 d后瘤体直径约1 cm,裸鼠成瘤率为100%(15/15)。
2.4 移植瘤体积的变化 治疗2周后,Ad.RGDING4组肿瘤体积增长缓慢,出现明显的抑瘤作用,从治疗第8天开始,Ad-ING4组的肿瘤体积与PBS组、Ad.RGD-GFP组比较差异有统计学意义(P<0.01),而PBS组和Ad.RGD-GFP组比较差异无统计学意义(P>0.05),见图2、表1。
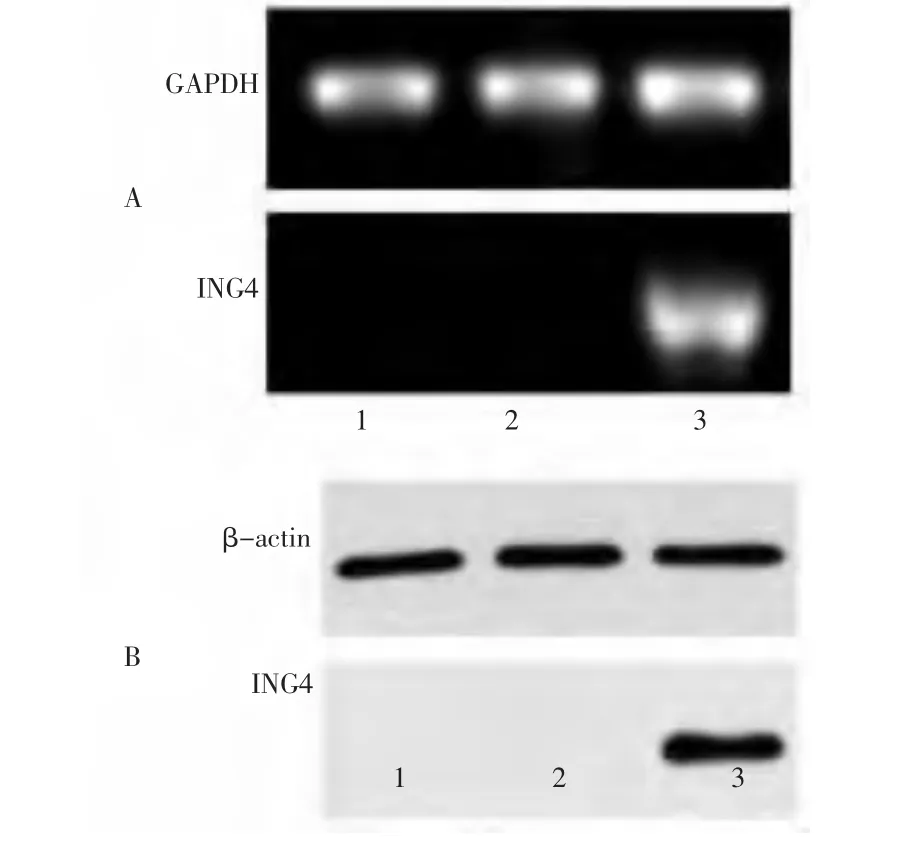
图1 RGD修饰的重组腺病毒介导的ING4在人鼻咽癌细胞中的表达
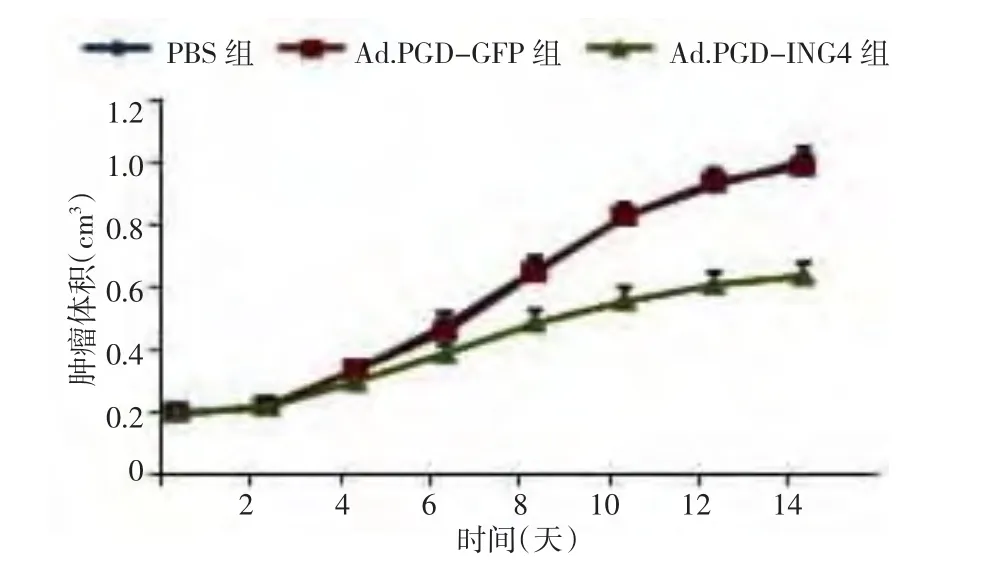
图2 3组裸鼠移植瘤体积-时间变化曲线
表1 3组裸鼠移植瘤体积随时间变化情况(±s,cm3)
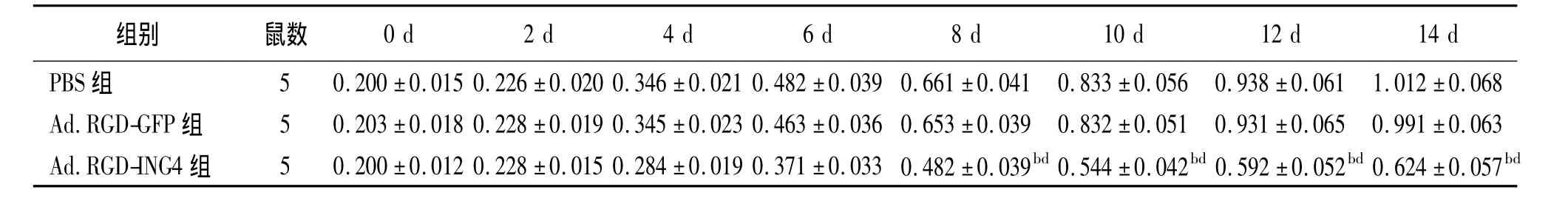
表1 3组裸鼠移植瘤体积随时间变化情况(±s,cm3)
注:PBS组为CNE细胞对照组,Ad.RGD-GFP组为空病毒载体对照组,Ad.RGD-ING4组为ING4单基因治疗实验组;与PBS组同时间比较,b P <0.01,与 Ad.RGD-GFP 组同时间比较,d P <0.01
0 d 2 d 4 d 6 d 8 d 10 d 12 d 14 d组别 鼠数PBS 组 5 0.200 ±0.015 0.226 ±0.020 0.346 ±0.021 0.482 ±0.039 0.661 ±0.041 0.833 ±0.056 0.938 ±0.061 1.012 ±0.068 Ad.RGD-GFP 组 5 0.203 ±0.018 0.228 ±0.019 0.345 ±0.023 0.463 ±0.036 0.653 ±0.039 0.832 ±0.051 0.931 ±0.065 0.991 ±0.063 Ad.RGD-ING4 组 5 0.200 ±0.012 0.228 ±0.015 0.284 ±0.019 0.371 ±0.033 0.482 ±0.039bd 0.544 ±0.042bd 0.592 ±0.052bd 0.624 ±0.057 bd
2.5 移植瘤组织细胞形态学 PBS组和Ad.RGDGFP组中肿瘤细胞基本上形态正常,包膜完整,而Ad.RGD-ING4组中有部分细胞出现细胞膜不完整,细胞质浓缩,细胞核固缩、裂解或溶解,组织间有空泡形成,见图3。
2.6 移植瘤组织中Caspase-3的表达 Caspase-3的 IOD 值 PBS 组为 1801.30 ±167.36,Ad.RGDGFP组为 1829.73 ±165.23,Ad.RGD-ING4 组为6350.61 ±548.15。Ad.RGD-ING4 组 Caspase-3 的IOD值显著高于 PBS组和 Ad.RGD-GFP组(P<0.01)。RGD-ING4组 Caspase-3阳性细胞数多于PBS组和 Ad.RGD-GFP组,见图4。
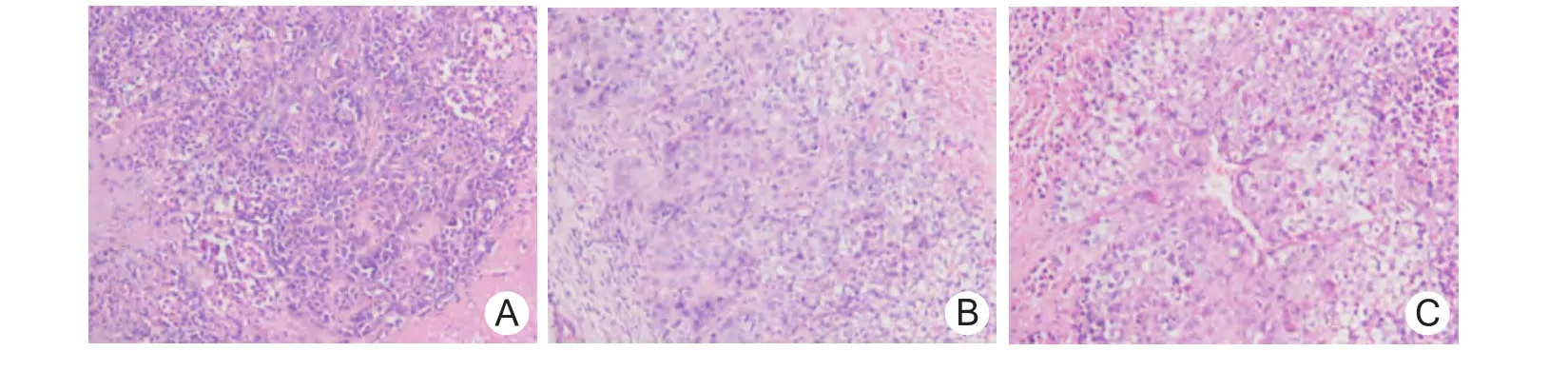
图3 裸鼠人鼻咽癌细胞移植瘤组织细胞形态学观察(HE×200)
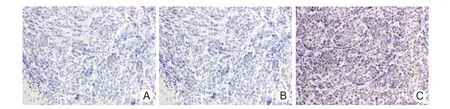
图4 裸鼠人鼻咽癌细胞移植瘤中Caspase-3的表达(EnVision×200)
3 讨论
目前基因治疗与放疗、化疗及细胞因子等联合应用已成为研究热点之一,而选择合适的治疗基因是鼻咽癌基因治疗的关键。ING4基因在神经胶质瘤、头颈癌细胞等多种肿瘤中表达水平明显降低,而且与肿瘤发生、恶性程度、增殖和预后密切相关。在本实验中可以看到,鼻咽癌CNE细胞中ING4基因已基本失去表达,故我们选择重组腺病毒介导的ING4基因感染鼻咽癌细胞,使ING4基因在鼻咽癌细胞中出现过表达,从而发挥其抑癌功效。
前期已有文献[3-5]显示,ING4对肺癌、胰腺癌等肿瘤具有抑制生长、促进肿瘤细胞凋亡等作用。在本实验中,我们选择RGD修饰的腺病毒介导的ING4来研究ING4对鼻咽癌裸鼠移植瘤影响。RGD肽是一类含有精氨酸-甘氨酸-天门冬氨酸(Arg-Gly-Asp)的短肽,在肿瘤细胞及肿瘤血管内皮细胞表面通常呈高表达[6],而在很多正常细胞膜表面αvβ3表达缺失[7]。因此,通过对腺病毒载体进行改造,使其衣壳蛋白表面表达RGD,可以明显提高载体的感染效率。
目前研究表明,细胞凋亡是一个受严格调控的能量依赖性的自杀程序,细胞凋亡的途径主要有两条:内源性途径(线粒体)和外源性途径(死亡受体途径)。外源性途径通过细胞表面的死亡受体配体结合而活化,主要管理免疫选择和炎症。内源性途径通过一些细胞内的刺激如电离辐射、化疗药物激活,通过Bcl-2家族中促凋亡基因(如Bax)及抗凋亡基因(如Bcl-2)的调控,特别是有研究发现,Bcl-2/Bax比率的升高可以引起细胞线粒体膜的通透性增加,释放出细胞色素C(Cyt-c),介导凋亡体的生成,从而激活细胞质中含半胱氨酸的天冬氨酸蛋白水解酶(Caspases)[8-14]。最终,这两种途径所诱发的细胞凋亡都是通过起始 Caspase(如 Caspase-2,8,9,10)在外来蛋白信号的作用下被切割激活,起始Caspase激活执行者 Caspase(如 Caspase-3,6,7),从而导致程序性细胞死亡[15-16]。其中,Caspase-3基因是Caspase大家族中重要的功能执行者,是细胞凋亡中的主要效应因子,也是细胞凋亡过程中的关键酶,大多数触发细胞凋亡的因素,最终均需要通过Caspase-3活化成Cleaved-Caspase-3,从而介导信号传导途径导致细胞凋亡[17-20]。本实验结果表明,Ad.RGD-ING4组裸鼠移植瘤较PBS组和Ad.RGDGFP组生长明显受到抑制,HE染色提示细胞凋亡数增多,免疫组化示Caspase-3的表达明显升高。
综上所述,Ad.RGD-ING4可以明显抑制人鼻咽癌细胞CNE裸鼠移植瘤的生长,其机制可能与明显上调凋亡基因Caspase-3表达有关。本文为 Ad.RGD-ING4基因治疗鼻咽癌提供了依据,为其临床应用奠定了基础。
[1] Shiseki M,Nagashima M,Pedeux R M,et al.p29ING4 and p28ING5 bind to p53 and p300,and enhance p53 activity[J].Cancer Res,2003,63(10):2373-2378.
[2] Garkavtsev I,Kozin SV,Chernova O,et al.The candidate tumor suppressor protein ING4 regulates brain tumour growth and angiogenesis[J].Nature,2004,428(6980):328-332.
[3] Xie Y,ShengW,Miao J,etal.Enhanced antitumor activity by combining an adenovirus harboring ING4 with cisplatin for hepatocarcinoma cells[J].Cancer Gene T-her,2011,18(3):176-188.
[4] Ling C,Xie Y,Zhao D,et al.Enhanced radiosensitivity of non-small-cell lung cancer(NSCLC)by adenovirusmediated ING4 gene therapy[J].Cancer Gene Ther,2012,19(10):697-706.
[5] Zhao Y,Su C,ZhaiH,etal.Synergistic antitumor effect of adenovirus-mediated hING4 gene therapy and(125)I radiation therapy on pancreatic cancer[J].Cancer Lett,2012,316(2):211-218.
[6] Schnell O,Krebs B,Wagner E,et al.Expression of integrin alphavbeta3 in gliomas correlates with tumor grade and is not restricted to tumor vasculature[J].Brain Pathol,2008,18(3):378-386.
[7] Schnell O,Krebs B,Carlsen J,etal.Imaging of integrin alpha(v)beta(3)expression in patients with malignant glioma by[18F]Galacto-RGD positron emission tomography[J].Neuro Oncol,2009,11(6):861-870.
[8] Korsmeyer SJ,Shutter JR,Veis D J,etal.Bcl-2/Bax:a rheostat that regulates an anti-oxidant pathway and cell death[J].Semin Cancer Biol,1993,4(6):327-332.
[9] Katiyar S K,Roy A M,Baliga M S.Silymarin induces apoptosis primarily through a p53-dependent pathway involving Bcl-2/Bax,cytochrome crelease,and caspase activation[J].Mol Cancer Ther,2005,4(2):207-216.
[10] Zhou C,Li X,Du W,etal.Antitumor effects of ginkgolic acid in human cancer cell occur via cell cycle arrest and decrease the Bcl-2/Bax ratio to induce apoptosis[J].Chemotherapy,2010,56(5):393-402.
[11] Didonna A,Sussman J,Benetti F,et al.The role of Bax and caspase-3 in doppel-induced apoptosis of cerebellar granule cells[J].Prion,2012,6(3):309-316.
[12] Lee JS,JungW K,Jeong M H,et al.Sanguinarine induces apoptosis of HT-29 human colon cancer cells via the regulation of Bax/Bcl-2 ratio and caspase-9-dependent pathway[J].Int JToxicol,2012,31(1):70-77.
[13] Lei L,Wang J,Zhang Z,et al.Lipopolysaccharide-induced apoptosis in amurine intestinal endocrine cell line bymodulation of Bcl-2,Bax and caspase-3[J].Mol Med Rep,2013,8(6):1649-1654.
[14] Biswas R,Chung PS,Moon JH,et al.Carboplatin synergistically triggers the efficacy of photodynamic therapy via caspase 3-,8-,and 12-dependent pathways in human anaplastic thyroid cancer cells[J].Lasers Med Sci,2013,10:232-234.
[15] Riedl SJ,ShiY.Molecularmechanisms of caspase regulation during apoptosis[J].NatRev Mol Cell Biol,2004,5(11):897-907.
[16] You B R,Park W H.Zebularine inhibits the growth of HeLa cervical cancer cells via cell cycle arrest and caspase-dependent apoptosis[J].Mol Biol Rep,2012,39(10):9723-9731.
[17] Seshadri P,Rajaram A,Rajaram R.Plumbagin and juglone induce caspase-3-dependent apoptosis involving the mitochondria through ROSgeneration in human peripheral blood lymphocytes[J].Free Radic Biol Med,2011,51(11):2090-2107.
[18] Simon D J,Weimer R M,McLaughlin T,et al.A caspase cascade regulating developmental axon degeneration[J].JNeurosci,2012,32(49):17540-17553.
[19] Oskoueian E,Abdullah N,Ahmad S.Phorbolesters from jatropha meal triggered apoptosis,activated PKC-delta,caspase-3 proteins and down-regulated the proto-oncogenes in MCF-7 and HeLa cancer cell lines[J].Molecules,2012,17(9):10816-10830.
[20] Berger A K,Danthi P.Reovirus activates a caspase-independent cell death pathway[J].MBio,2013,4(3):178-213.
Effect of Adenovirus-mediated RGD-ING4 on Transplantation Tumor Induced by Human Nasopharyngeal Carcinoma Cell in Nude Mice
WANG Yi-hong1,LIU Ji-sheng1,SHENGWei-hua2,YANG Ji-cheng2(1 DepartmentofOtolaryngology,the First Hospital Affiliated to Soochow University,Suzhou,Jiangsu 215006,China;2.Departmentof Cytology and Molecular Biology,College of Basic Medicine of Soochow University,Suzhou,Jiangsu 215123,China)
ObjectiveTo study the effect of Ad.RGD-ING4(adenovirus-mediated,Ad.)on transplantation tumor induced by human nasopharyngeal carcinoma cell CNE in nudemice and to investigate its possiblemechanisms.MethodsThe expression of ING4 gene in CNE cells,which were infected by Ad.RGD-ING4 or Ad.RGD-GFP,was detected by RT-PCR and Western blotmethods respectively.The 15models of human nasopharyngeal carcinomawere established with CNE cell strain in nudemice,and were divided into phosphate buffered sodium(PBS)group(n=5),Ad.RGD-GFP group(n=5)and Ad.RGD-ING4 group(n=5).Allmice underwent correspondingmulti-points injection in tumor respectively,the volume of tumor was measured dynamically,and the expressions of Caspase-3 gene in tumor sampleswere detected by immunohistochemistrymethod.ResultsThe ING4 protein was excessively expressed in the CNE cells after 72 h of being transfected by Ad.RGD-ING4.The tumor volume of Ad.RGD-ING4 group was significantly smaller than those of PBSand Ad.RGD-GFP groups(P <0.01),and immunohistochemistry result showed that the expression of Caspase-3 gene was increased significantly in Ad.RGD-ING4 group compared with those in the other two groups(P <0.01).ConclusionAd.RGD-ING4may inhibit the growth of transplantation tumor induced by human nasopharyngeal carcinoma cells in node mice,and up-regulation of Caspase-3 gene expression may accelerate tumor apoptosis.
Ad.RGD-ING4;Nasopharyngeal neoplasm;Gene,neoplasm;Caspase-3;Nudemouse
R739.6;R-332
A
2095-140X(2014)04-0050-05
10.3969/j.issn.2095-140X.2014.04.015
苏州市科技计划项目(SYS201014)
215006江苏苏州,苏州大学附属第一医院耳鼻咽喉科(王奕鸿、刘济生);215006江苏 苏州,苏州大学基础医学院细胞与分子生物学教研室(盛伟华、杨吉成)
刘济生,E-mail:ljswwq@sina.com
book=0,ebook=61
2013-11-18 修回时间:2014-01-18)
·论著·
