胎鼠胰腺干细胞体外对胰岛的保护作用观察
2014-02-22张育森常彩红李富荣鲍世韵
张育森,常彩红,张 悦,李富荣,鲍世韵
(1深圳市人民医院,暨南大学第二临床医学院,广东深圳518020;2海南医学院)
胰岛移植是治疗1型糖尿病(特别是有严重低血糖史和代谢不稳定)患者的有效方法之一。随着埃德蒙顿方案的提出,胰岛移植再次成为关注热点[1~3]。由于胰岛分离技术复杂、分离时间较长,加之移植后短时间内不能建立血供,易在受体内凋亡和死亡;因此,常需2~3个供体分离的胰岛才能使糖尿病患者完全脱离胰岛素治疗。如何对分离损伤的胰岛进行修复和保护、降低胰岛使用量,在胰岛移植临床工作中具有重要意义。2007年7月~2009年6月,我们观察了胎鼠胰腺干细胞体外对胰岛的保护作用及对移植效果的影响,旨在为临床胰岛移植提供新的思路。
1 材料与方法
1.1 材料 ①动物:孕16 d的SD大鼠1只(体质量500 g)、10周龄SD大鼠60只(体质量200~250 g,雌雄不限),均由广东省实验动物中心提供[动物合格证:SCXK(粤)2003-0002)]。②主要试剂:DMEM培养粉(低糖)、胎牛血清均为Gibco公司产品;Hank's液(Hyclone公司产品);胶原酶Ⅴ、吖啶橙(AO)、碘化丙啶(PI)、胶原酶Ⅴ、胰蛋白酶、双硫腙及链脲佐菌素(STZ)均为Sigma公司产品;Ficoll-400(Pharmacia公司);新生牛血清(四季清公司);大鼠胰岛素ELISA试剂盒(Mercodia公司);巢蛋白(Nestin)单克隆抗体、异硫氰酸荧光素(FITC)标记抗小鼠二抗(Chemicon公司);Epics Altra流式细胞仪(Beckman Coulter公司);快速血糖测试仪(强生公司)。
1.2 实验方法
1.2.1 胎鼠胰腺干细胞分离、纯化和培养 将孕16 d大鼠经麻醉后行剖宫产术,取出胎鼠。沿胎鼠腹部正中切开腹壁,暴露白色的胰芽并切取;以眼科剪将胰芽稍加修剪,接种于培养瓶中,加入DMEM培养基(含体积分数为10%的胎牛血清),置37℃、5%CO2的培养箱中培养;细胞传代3次后涂片,流式细胞术测定Nestin阳性细胞数;取第5代胰腺干细胞消化,调整细胞密度为1×105/mL,接种于24孔培养板中,待用。
1.2.2 胰岛的分离与纯化 10周龄大鼠禁食12 h,充分暴露胰腺。取质量浓度1 g/L的胶原酶Ⅴ溶液(Hank's液配制)6 mL经胆总管逆行注入,使胰腺完全膨胀,完整切取胰腺,置同上胶原酶Ⅴ溶液中,37℃水浴中消化9 min;以4℃、10%新生牛血清的Hank's液中止消化;洗涤过滤;采用Ficoll不连续密度梯度离心法进行胰岛纯化。收集质量浓度1.096、1.067 kg/L及1.067、1.034 kg/L的Ficoll界面细胞团,取200μL消化液双硫腙染色计数;洗涤后在显微镜下手挑法选取直径在50μm以上的胰岛。
1.2.3 糖尿病大鼠模型制备 以pH值为4.4的枸橼酸钠缓冲液溶解STZ,取10周龄同批次200~250 g雌性SD大鼠20只,按60 mg/kg腹腔注射STZ;尾静脉末梢采血快速检测血糖,以大鼠出现多饮、多尿,随机血糖>16.7 mmol/L并维持3 d以上作为建模成功标准。
1.2.4 胰岛分组培养及胰岛细胞凋亡率、胰岛活性、胰岛分泌量检测 将上述纯化后的胰岛分为A组和B组,其中A组按每孔20个胰岛(直径>50μm)接种于24孔培养板;B组按上述比例接种于含胎鼠胰腺干细胞的24孔培养板。两组均按照文献[4,5]培养:加入DMEM培养基(含10%胎牛血清),于37℃、5% CO2培养箱中培养14 d。培养过程中观察胰岛形态及生长状况,第3、7天分别以Annexin-V/7-ADD定量分析法检测胰岛细胞凋亡率;第3、7、14天分别以AO-PI双染色法检测胰岛活率(坏死胰岛呈红色,存活胰岛呈绿色),ELISA法检测胰岛分泌量,通过高糖(16.7 mmol/L)刺激试验计算刺激指数(高糖刺激后分泌量与基础分泌量之比)。
1.2.5 胰岛移植术后血糖监测 取两组培养7 d悬浮生长的胰岛各800个移植入糖尿病大鼠左肾包膜下,术后每天尾静脉采血以快速血糖测试仪检测血糖。
1.3 统计学方法 采用SPSS13.0统计软件进行统计学分析。计量资料以±s表示,比较用两样本t检验分析及重复测量设计的方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 胎鼠胰腺干细胞鉴定情况 第3代细胞消化、涂片及免疫组化染色后可见Nestin阳性细胞,流式细胞术测定其含量占74.1%。
2.2 胰岛分离纯化结果 双硫腙染色后胰岛呈猩红色,圆形或椭圆形,大小不等。40只大鼠平均每只胰腺消化后获得(654±41)个胰岛,Ficoll纯化后获得(410 ±32)个胰岛;平均回收率为58.1%,纯度为95%。
2.3 体外培养过程中胰岛形态、生长状况、存活率、细胞凋亡率、胰岛素分泌量及刺激指数 ①形态、生长状况:胰岛悬浮于培养基中,圆形或椭圆形,大小不等,轮廓清晰,立体感强。其中A组培养第3天时胰岛生长状况较好、轮廓清楚,培养第7天时胰岛结构变松散、边界不清,培养>14 d后胰岛结构均已破坏;B组培养第3天时胰岛生长良好、部分与贴壁干细胞松散黏附(振荡后可重新悬浮),培养第14天时仍可见完整胰岛。②存活率:培养第3、7、14天时胰岛存活率A组分别为91%±4%、40%± 6%、6%±4%,B组分别为94%±5%、69%±7%、40%±8%,培养第7、14天时B组胰岛存活率显著高于 A组,P均 <0.01(t值分别为 -7.250、-8.570)。③细胞凋亡率:培养第3、7天时胰岛细胞凋亡率A组分别为11.3%±4.3%、33.5%± 7.9%,B组分别为9.1%±3.5%、23.3%±5.9%,培养第7天时B组胰岛细胞凋亡率显著低于A组,P<0.05(t=-2.316)。④胰岛素分泌量及刺激指数:详见表1。其中A组培养第14天时胰岛素含量低于检出限(标注为-)。
表1 两组胰岛素分泌量与刺激指数比较(±s)

表1 两组胰岛素分泌量与刺激指数比较(±s)
注:与同时间A组比较,*P<0.01(t值高糖刺激后胰岛素分泌量分别为8.479、36.118,刺激指数分别为3.648、12.505)
组别 基础胰岛素分泌量(ng/L)高糖刺激后胰岛素分泌量(ng/L)刺激指数B 组培养3 d 326.3±19.5 640.3±32.4 2.01±0.17培养7 d 293.0±23.9 571.4±42.5* 1.95±0.24*培养14 d 271.1±15.1 410.8±19.7* 1.52±0.21* A组培养3 d 316.6±35.1 611.4±26.4 1.93±0.15培养7 d 260.1±30.1 392.8±20.2 1.51±0.13培养14 d- - -
2.4 胰岛移植后血糖变化 B组胰岛移植后5 d内大鼠血糖降至正常水平并维持约1周,而A组胰岛移植后大鼠血糖未降至正常水平。经重复测量设计的方差分析,两组移植后血糖随时间变化的趋势不同(F=43.03,P<0.01),B组血糖下降幅度更明显(F=413.67,P<0.01)。详见图1。
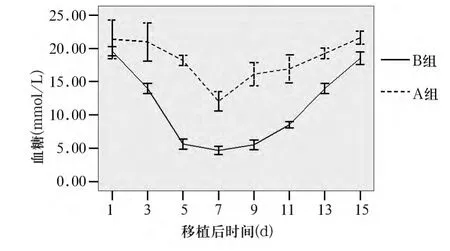
图1 胰岛移植后两组血糖变化
3 讨论
如何保护胰岛功能一直是胰岛移植中一个重要的研究内容。最近很多研究表明,干细胞除了自身具有较强的增殖分化能力之外,还可通过分泌细胞因子或者通过细胞—细胞接触、融合等方式促进损伤组织修复、促进细胞成熟和增殖,进而维持正常组织细胞的功能。比如间充质干细胞可通过转分化提供细胞因子,增强组织内源性前体细胞增殖、细胞融合或者线粒体的转运而起到修复损伤组织的作用[6~12]。Lee等[10]将间充质干细胞注入糖尿病小鼠体内后,发现其可在受损的胰腺富集并促进小鼠胰岛分泌更多的胰岛素。胚胎干细胞可通过分泌胰岛素样生长因子1(IGF-1)和wnt5α信号通路逆转Id敲除小鼠的心肌表型,改善预后(Id敲除小鼠存在先天多发性心脏缺陷,胚胎多于孕13.5 d前流产)[14];胚胎生殖细胞可通过分泌转化生长因子α及脑源性神经营养因子促进受损运动神经元的恢复[15];Llado等[16]发现,将神经祖细胞与临近部位的成熟神经元共培养时,神经祖细胞可通过分泌神经生长因子等促进神经元轴突生长、保护神经元免受外源性毒素的损伤,延长神经元寿命。上述研究为利用干细胞保护成熟组织细胞、促进损伤后组织细胞修复及组织细胞再生等提供了依据。
由于胰岛分离及移植后血供建立困难等常引起胰岛凋亡和死亡,利用干细胞对分离损伤的胰岛进行修复和保护在胰岛移植工作中具有重要意义。通过修复损伤胰岛而保护胰岛的活性、提高胰岛的质量,可能提高胰岛移植的疗效,同时降低胰岛需要量,达到一对一移植治疗糖尿病的目标,从而推动胰岛移植的更广泛开展。利用干细胞分泌的某些细胞因子或通过细胞—细胞接触等作用修复损伤胰岛,保护胰岛的活性,延长胰岛体外存活时间可能是一种很好的方法。本实验显示,将胎鼠胰腺来源的干细胞与胰岛共培养可明显延长胰岛体外存活时间、增加高糖刺激下胰岛素分泌量及刺激指数,且移植入糖尿病大鼠左肾包膜下后可将其血糖降至正常。进一步证明与胎鼠胰腺干细胞共培养可保护胰岛活性。机制可能与胎鼠来源的胰腺干细胞能分泌各种促进损伤修复、营养支持的可溶性因子或细胞—细胞接触作用有关。
[1]Shapiro J,Lakey JR,Ryan EA,et al.Islet transplantantion in seven patients with type 1 diabetesmellitus using a glucocorticoidfree immunosuppressive regimen[J].N Engl JMed,2000,343 (4):230-238.
[2]Shapiro AM,RicordiC,Hering BJ,etal.International trial of the Edmonton protocol for islet transplantation[J].N Engl JMed,2006,355(13):1318-1330.
[3]林国章,谭建明.胰岛移植研究进展[J].山东医药,2008,48 (3):110-111.
[4]Murdoch TB,McGhee-Wilson D,Shapiro AM,et al.Methods of human islet culture for transplantation[J].Cell Transplant,2004,13(6):605-617.
[5]Miki A,Narushima M,Okitsu T,et al.Maintenance ofmouse,rat,and pig pancreatic islet functions by coculture with human islet-derived fibroblasts[J].Cell Transplant,2006,15(4):325-334.
[6]Prockop DJ,Gregory CA,Spees JL.One strategy for cell and gene therapy:harnessing the power of adult stem cells to repair tissues[J].Proc Natl Acad Sci USA,2003,100(Suppl 1):11917-11923.
[7]Munoz JR,Stoutenger BR,Robinson AP,etal.Human stem/progenitor cells from bonemarrow promote neurogenesis of endogenous neural stem cells in the hippocampus ofmice[J].Proc Natl Acad Sci U SA,2005,102(50):18171-18176.
[8]Spees JL,Olson SD,Ylostalo J,etal.Differentiation,cell fusion,and nuclear fusion during ex vivo repair of epithelium by human adult stem cells from bone marrow stroma[J].Proc Natl Acad Sci USA,2003,100(5):2397-2402.
[9]Spees JL,Olson SD,Whitney MJ,et al.Mitochondrial transfer between cells can rescue aerobic respiration[J].Proc Natl Acad Sci USA,2006,103(5):1283-1288.
[10]Lee RH,Seo MJ,Reger RL,et al.Multipotent stromal cells from humanmarrow home to and promote repair of pancreatic islets and renal glomeruli in diabetic NOD/scidmice[J].Proc Natl Acad Sci USA,2006,103(46):17438-17443.
[11]Scuteri A,Cassetti A,Tredici G.Adultmesenchymal stem cells rescue dorsal root ganglia neurons from dying[J].Brain Res,2006,1116(1):75-81.
[12]Baffour R,Pakala R,Hellinga D,et al.Bone marrow-derived stem cell interactions with adult cardiomyocytes and skeletalmyoblasts in vitro[J].Cardiovasc Revasc Med,2006,7(4):222-230.
[13]Chang Liu Z,Chang TM.Coencapsulation of hepatocytes and bone marrow cells:in vitro and in vivo studies[J].Biotechnol Annu Rev,2006,(12):137-151.
[14]Fraidenraich D,Stillwell E,Romero E,et al.Rescue of cardiac defects in id knockout embryosby injection of embryonic stem cells[J].Science,2004,306(5694):247-252.
[15]Kerr DA,Llado J,Shamblott MJ,et al.Human embryonic germ cell derivatives facilitate motor recovery of rats with diffuse motor neuron injury[J].JNeurosci,2003,23(12):5131-5140.
[16]Llado J,HaenggeliC,Maragakis NJ,etal.Neural stem cells protect againstglutamate-induced excitotoxicity and promote survival of injured motor neurons through the secretion of neurotrophic factors[J].Mol Cell Neurosci,2004,27(3):322-331.
