凡纳滨对虾虾头自溶产物中肽组分的分离及其呈味性能初步研究
2014-02-22章超桦吉宏武曹文红朱国萍
伍 彬,章超桦,吉宏武,曹文红,刘 亚,朱国萍
(广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,广东海洋大学食品科技学院,广东湛江524088)
凡纳滨对虾(Penaeus vannamei Boone),又名南美白对虾。原产于美洲太平洋沿岸水域,我国以广东、福建、浙江及海南为其主要产地,壳薄体肥,含肉率高,肉质鲜美,营养丰富。其产品以去头冻虾为主,导致在加工过程中产生占虾体重30%左右的虾头等下脚料,大部分工厂因未加利用而废弃。虾头中含有丰富的蛋白质、不饱和脂肪酸、虾红素等营养物质,同时含有各种氨基酸及人体必需的微量元素等[1-2]。蛋白质在降解过程中除了产生游离氨基酸以外,还会产生不同分子量大小的肽段,短肽常具有不同的味感,包括甜味肽,苦味肽,咸味肽,还有鲜味肽等[3-5]。关于肽分离纯化的方法,一般有盐析法、超滤法[6]、离子交换层析、凝胶过滤层析和反相高效液相色谱等[7]。超滤法很难确定主要的呈味组分,而离子交换,凝胶过滤等其他方法又存在上样量小,流速慢,耗时等问题。大孔吸附树脂是一类不含离子交换基团的高分子吸附剂,具有与活性炭相似的吸附性能,且理化性质稳定,因此被广泛应用于食品领域,如分离制备高F值寡肽、血压肽等[8-10]。本文采用超滤与大孔吸附树脂洗脱相结合的方法,对凡纳滨对虾虾头自溶产物中的短肽进行分离纯化,并结合感官评价,初步确定了自溶产物中短肽的呈味特性。
1 材料与方法
1.1 材料与仪器
凡纳滨对虾虾头 广东湛江国联水产有限公司提供;马尿酰组氨酰亮氨基酸(MW 423U)日本Peptide Institute;标准多肽混合物(含有Triosephosphateisomerase(MW 26625U),Myoglobin(MW 16950U),Aprotinin(MW 6512U),Insulin-B(MW 3496U),Bacitracin(MW 1423U) 美国Biorad公司;AB-8大孔吸附树脂、NKA-Ⅱ大孔吸附树脂 天津兴南允能高分子技术有限公司;XAD-1600、XAD16、MD130、X-5大孔吸附树脂 上海速摩化工原料有限公司;Z型玻璃层析柱(1.6mmx60mm) 上海精科实业有限公司。
UV-2501PC紫外-可见光分光光度计 上海尤尼科仪器厂;Waters 600E高效液相色谱仪 美国waters公司;N-2000液相色谱工作站、QT-智能紫外检测器、TH-1000A梯度混合器、DBS-100-LCD电脑全自动部分收集器 上海琪特分析仪器有限公司;超滤机Millipore公司。
1.2 实验方法
1.2.1 虾头自溶产物的制备 将虾头在高速组织匀浆器中匀浆,匀浆后置于烧杯中,按料液比1∶3加水搅拌混匀,调节pH至7.85,置于50℃水浴锅中保温自溶反应3h,后于100℃水浴灭酶10m in,冷却,5000r/m in离心15min,取上清液,即为样品溶液[11]。
1.2.2 自溶产物的超滤 将自溶产物分别用截留量为8000、5000、1000u超滤膜超滤(Am icon model 8200,M illipore Corporation),分离的条件:压力0.25MPa,温度4℃。
1.2.3 超滤组分肽基态氮含量的测定 分别采用凯氏定氮法[12]和甲醛滴定法[12]测定,肽基态氮含量=总氮量-总氨基态氮量。
1.2.4 超滤组分的感官评价 方法参考文献[13],感官评价小组成员由受过感官培训(经三点检验试验合格者确定为品评员)的5名女生,5名男生组成(年龄在20~30岁之间)。选用谷氨酸钠、蔗糖、食盐、硫酸奎宁和柠檬酸分别作为鲜味、甜味、咸味、苦味和酸味五种风味的标准物质。五种基本呈味标准物质配制成不同的浓度,品尝鉴定。在室温条件进行评定,将样品配成固形物为2%的溶液,取20m L盛放在杯中,评品员依次从低浓度开始品尝标准味感物质后,用小勺将溶液含在口中停留15s(勿咽下)活动口腔,使样品溶液接触整个舌头,仔细辨别味道,然后吐出样液,每次品尝完后用清水漱口,需等待1m in,再品尝。最后品尝样液,然后根据五种标准味感物质给出相应的分数(五分制)。评分标准:5—非常强,4—强,3—标准,2—弱,1—很弱,0—不可鉴别。
1.2.5 超滤组分的HPSEC分析 采用高效体积排阻色谱(HPSEC)法测定超滤组分的分子量分布,流动相为50mmol/L Tris-HCl缓冲液(pH 7.2)。将分子量标准品配制成水溶液,上样10μL至Waters-PROTEINPAK60柱进行高效液相色谱洗脱,流动相流速0.7m L/m in,监测214nm处的吸光值,建立分子量M的对数与洗脱保留时间t之间的回归方程。将自溶产物经过针式过滤头(0.45μm)过滤后在相同的条件下进行高效液相色谱洗脱,利用分子量回归方程考察酶解产物的分子量分布。
1.2.6 超滤组分的大孔吸附树脂的分离纯化
1.2.6.1 大孔吸附树脂型号的选择 大孔吸附树脂的预处理:用95%醇浸泡24h,过滤后用大量蒸馏水洗至澄清、无醇味,然后用2~3倍体积1%盐酸浸泡3~5h,浸泡过程不断搅拌。用蒸馏水充分洗树脂至中性后再用2倍体积1%NaOH浸泡处理,最后用蒸馏水洗至中性并去除悬浮物,备用。
大孔吸附树脂的静态吸附与解吸实验:静态吸附实验:于250m L具塞锥形瓶中加入5.0g处理好的干树脂,用无水乙醇充分溶胀,再用去离子水洗净乙醇,吸干水分。加入50m L经感官实验得出最好的的超滤组分(蛋白浓度为12.86mg/m L),塞好塞子,将该锥形瓶放入25℃水浴恒温振荡器中振荡24h(振荡速度为160r/min),使树脂与料液充分接触;振荡结束后,滤纸过滤,将树脂与溶液分离;测定溶液中的蛋白质含量。按以下公式计算[14]:

其中:解吸液浓度,mg/m L;解吸液体积,m L;吸附液浓度,mg/m L;吸附液体积,m L。
1.2.6.2 大孔吸附树脂对呈味肽的分离 用已选好型号且经预处理好的大孔吸附树脂装填1.6×60cm的层析柱,在室温条件下将经感官评价确定的最优的超滤液上柱,用紫外检测器检测流出液的A220nm,以A220nm=0.05为透过点。用10%、30%、50%、70%和90%乙醇分别洗脱树脂,流速为1.0m L/m in。收集洗脱峰,减压浓缩除去乙醇,再将溶液冷冻干燥用于分析。
1.2.7 氨基酸组成分析 样品经处理后,采用氨基酸自动分析仪测定,参照GB/T14965-1994,将样品液碱解后上氨基酸自动分析仪。测定条件:No.2619离子交换柱(26×150mm),柱温53℃,泵流速0.225m L/m in,泵压8.8MPa,分析时间72m in,进样量50μL。
1.2.8 数据分析 实验数据均实验三次取平均值。
2 结果与分析
2.1 自溶产物的超滤
虾头自溶产物经将截留量为8000、5000、1000u超滤膜超滤,分离出四种超滤组分:8000u以上;8000~5000u;5000~1000u;1000u以下。各个组分中5000~1000u组分肽态氮的含量最高,达12.86mg/m L,其次是1000u组分,为10.01mg/m L,其含量最少的是8000u以上组分。这说明,虾头中的蛋白质在自身酶系的作用下,降解为一系列分子量大小不同的肽段,而且这些肽短的分子量主要集中在5000u以下。
2.2 超滤组分的感官评价
由图1知,分子截留量在5000u以上,以苦味为主,5000u以下,以鲜味和甜味为主。再分析各超滤组分的呈味特点:8000u以上组分,最突出的味感是苦味,其次再是鲜味和甜味;8000~5000u组分,最突出的味感也是苦味,其次再是鲜味和甜味;5000~1000u组分中,最突出的味感是鲜味和甜味,苦味很弱;1000u以下组分,突出的味感是鲜味和甜味,还有是咸味。由2.1可知,5000~1000u组分肽基态氮含量最高,因此5000~1000u组分选取作为进一步分离纯化的目标。
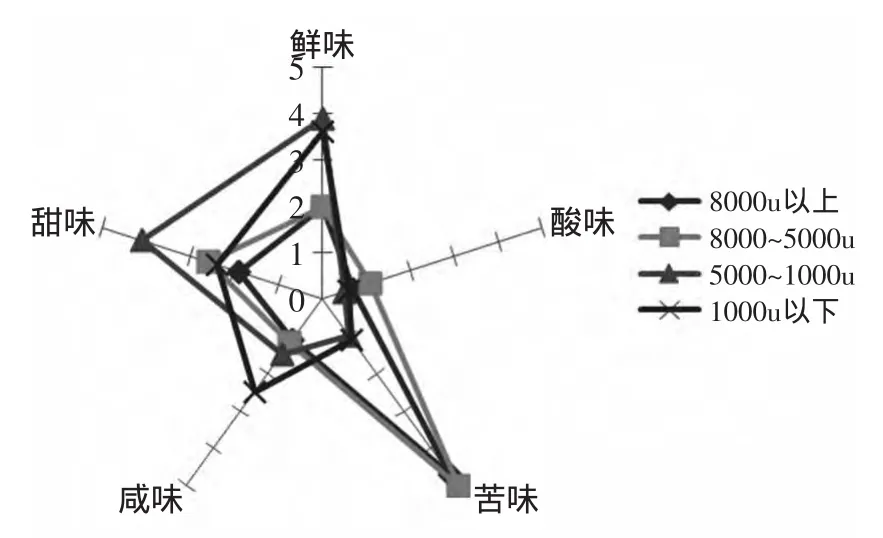
图1 超滤组分的风味轮廓图Fig.1 Flavor outline drawing of ultrafiltration components
2.3 超滤组分的HPSEC分析
图2为6种分子量标准多肽(Triosephosphateisomerase、Myoglobin、Aprotinin、Insulin-B、Bacitracin和HHL)的HPSEC图,将分子量标准物质的保留时间t和分子量的对数LgM在平面坐标系中描点,得到分子量回归方程为LgM=-0.2177t+6.2791,相关系数R= 0.9868,说明两者线性相关性及回归性良好。
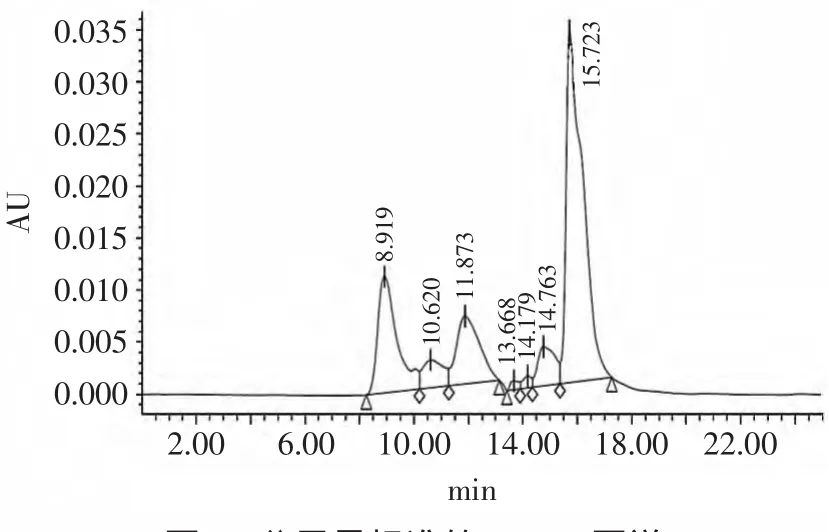
图2 分子量标准的HPSEC图谱Fig.2 HPSECmapping ofmolecular weight standard
采用HPSEC研究了5000~1000u超滤组分的分子量分布情况,结果见图3。计算出5000~1000u超滤组分分子量分布情况(表1)。在5000~1000u超滤组分中,分子量5000u以下的组分比重达到82.07%,而且主要是集中在3000~1000u,占了50.80%;1000u以下达26.23%,跟超滤分离是粗分离有较大关系,小肽有可能通过氢键结合为较大的分子,被截留在了5000~1000u之间。结合2.2感官实验,推断出呈鲜味和甜味的肽分子量主要集中在3000~1000u,与宋美等[15]研究大豆蛋白呈鲜组分所得到的结果类似。
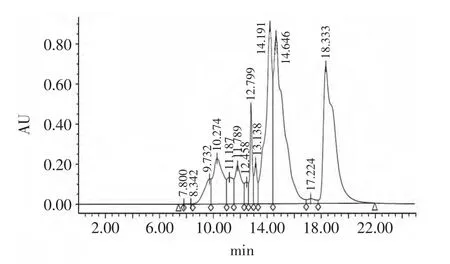
图3 5000~1000u超滤液Fig.3 Ultrafiltrate between 5000~1000u

表1 5000~1000u超滤组分分子量分布(%)Table1 Molecularweight distribution of the 5000~1000u(%)
2.4 超滤组分的大孔吸附树脂分离纯化
2.4.1 大孔吸附树脂型号的选择 六种大孔吸附树脂对5000~1000U组分的吸附量和解吸率见图4,可以得出XAD-16这种型号的大孔吸附树脂效果最好,吸附量84.95mg/g,解吸率为56.99%。
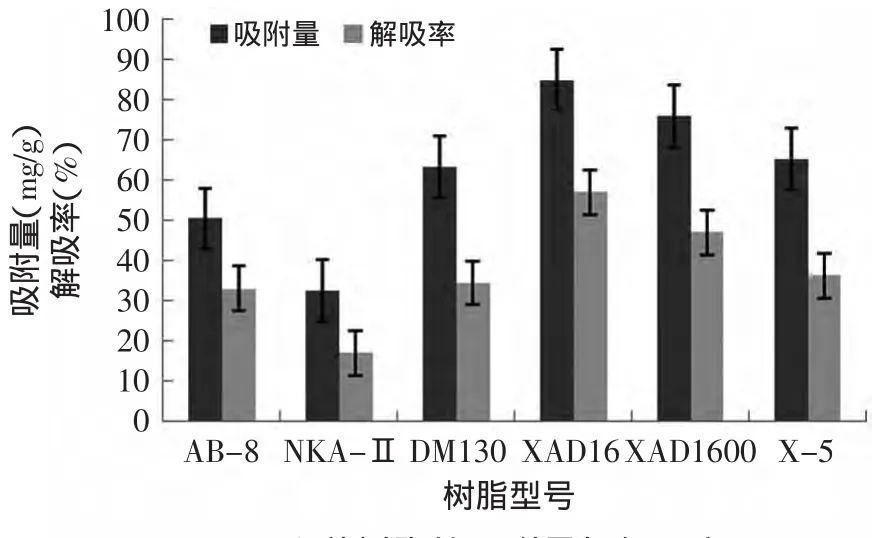
图4 六种树脂的吸附量与解吸率Fig.4 Absorption capacity and desorption rate of 6 resins
另外,大孔吸附树脂是一种表面吸附剂,其吸附力强弱与树脂的比表面积、表面电性及能否与被吸附物质形成氢键和疏水相互作用等有关。通常认为比表面积决定吸附剂的饱和吸附量,而平均孔径和极性决定吸附剂的吸附速率[16]。由图4知,XAD-16树脂的比表面积最大,且在分离生物活性物质时,具有可逆性,解吸率也高,因此,本研究选择该树脂进行吸附动力学实验。
2.4.2 大孔吸附树脂分离条件的确定
2.4.2.1 洗脱剂的选择 一般可以用溶剂的溶解度参数来预测,溶解度参数越小的溶剂解吸效率越高。常见溶剂水、甲醇、乙醇和丙酮的溶解度参数分别为23.2、14.5、12.7和10.0[17]。还考虑到在大孔吸附树脂分离后,还要品评其分离出的组分,因此本实验中采用乙醇-水溶液作为解吸剂。
2.4.2.2 上样浓度的确定 将5000~1000u收集液真空冷冻成干粉,然后取一定的干粉分别配制成0.5、1.0、2.0mg/m L水溶液上样,用乙醇-水作为洗脱液,以确定其最佳上样浓度。从图5可以看出,不同上样浓度,其泄漏体积是不一样的,当样品浓度为0.5mg/m L时,肽的泄漏体积为50m L,而且收集的洗脱液中肽含量也是最高的。这是因为浓度低时,样品能够和树脂充分接触,在疏水相互作用下,充分吸附到树脂上,从而和高浓度条件下相比,损失率较低,结果确定以0.5mg/m L为最佳样品浓度。
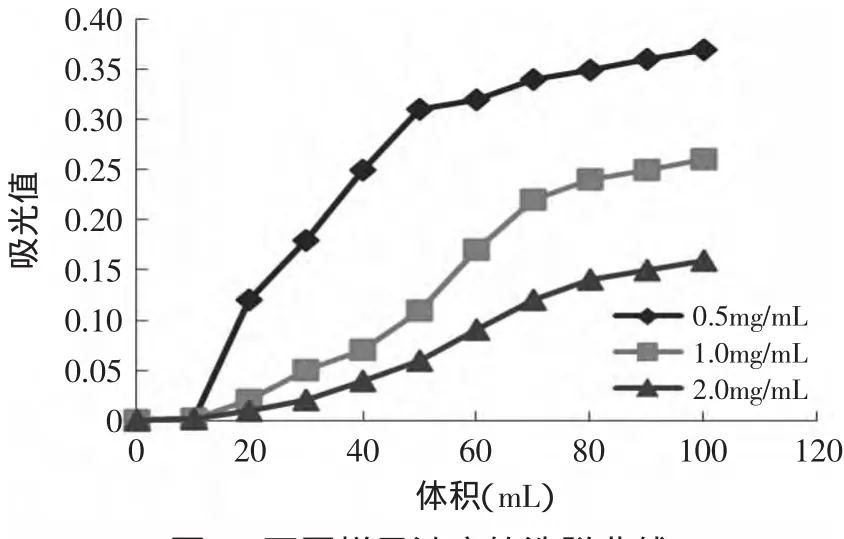
图5 不同样品浓度的洗脱曲线Fig.5 Eluting curve of difference sample concentration
2.4.2.3 流速的确定 根据2.4.2.2确定的上样浓度上样,然后分别将恒流泵的流速设定为0.5、1.0、2.0mg/min、以确定最佳流速。由图6可知,随着流速的增加,小肽回收率降低。这是因为流速增加,减少了洗脱剂与树脂接触的时间,疏水性肽不能被完全置换下来。但是0.5mg/m in和1.0mg/m in相比,小肽回收率相差不大,但进一步提高流速到达2.0mg/m in,小肽回收率下降比较显著。考虑到生产中希望尽量缩短周期并保证较高回收率,选择1.0mg/m in为最佳流速。
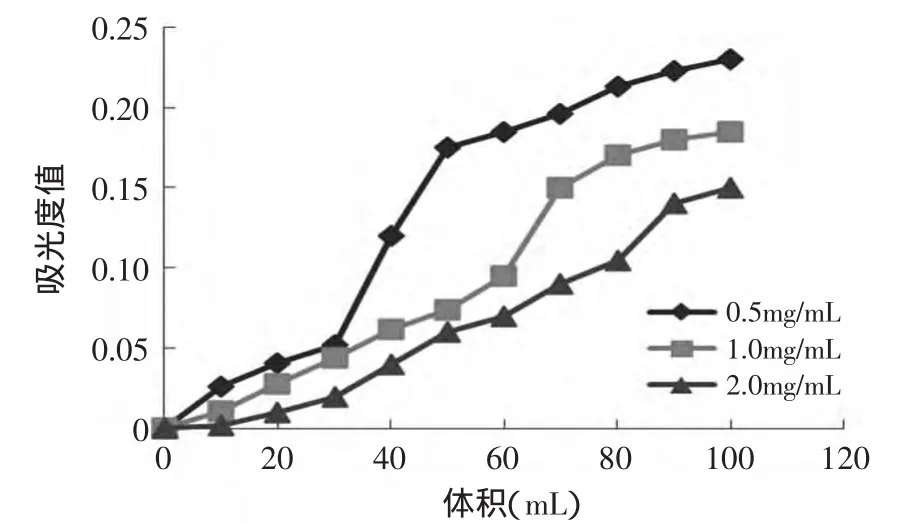
图6 不同上样流速的洗脱曲线Fig.6 Eluting curve of difference sample speeds
2.4.2.4 分级洗脱 装好层析柱,将5000~1000u组分,按前两节所确定的上样浓度(0.5mg/m L),和流速(1.0mg/m in)上样。为了分离出呈味的组分,本实验采用改变洗脱液的极性,来达到分离的目的,因此,依次采用10%、30%、50%、70%和90%的乙醇作为洗脱剂,对呈味肽进行分级洗脱。分别收集各个组分,并测其肽态氮含量(见图7)。从图7还可以看出,大部分小肽在乙醇浓度10%和30%下被洗脱,而且随着乙醇浓度增大,被洗脱出来的组分的肽态氮含量逐步下降。洗脱后,收集到五种洗脱组分,分别是X 10%(表示用10%乙醇洗脱出来的组分,下同)、X30%、X50%、X70%和X90%,再通过减压蒸馏除去各个组分中的乙醇,冷冻干燥,进行感官品评,并对其感官评分最好的分析其结构氨基酸。
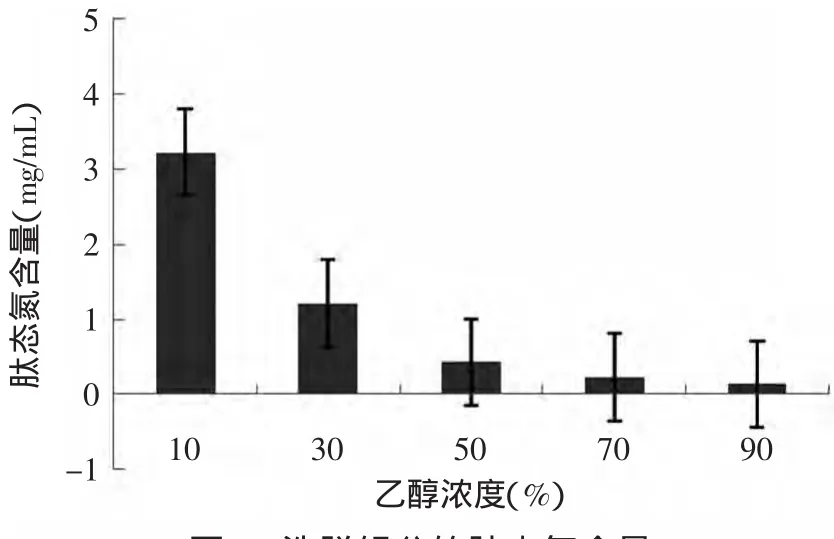
图7 洗脱组分的肽态氮含量Fig.7 Contentof peptide nitrogen in elution fractions
2.4.2.5 各洗脱组分的感官评价 经感官品价,各洗脱组分的呈味特点的结果如图8所示,五种洗脱组分主要的呈味特点都是鲜味和甜味突出,其中味道最佳的是X30%洗脱组分,其次是X90%组分。进一步分析X30%洗脱组分中的结构氨基酸。
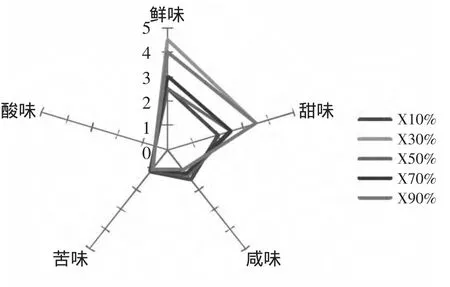
图8 各洗脱组分的感官评价Fig.8 Sensory evaluation of elution fractions
2.4.2.6 X30%洗脱组分的氨基酸构成 凡纳滨对虾虾头酶解液中的氨基酸组成如表2所示,洗脱组分中Asp、Glu、Gly、Ala、Pro等呈鲜味和呈甘味的氨基酸总含量达35.71g/100g,占总游离氨基酸的36.11%,尤其是谷氨酸、脯氨酸含量较高,分别达15.29、11.89g/100g,这也正好印证了2.4.2.5中30%乙醇洗脱组分的感官得分最高。
3 结论
虾头自溶产物经三种超滤膜超滤,发现5000~1000u组分肽态氮的含量最高,达12.86mg/m L。且该组分味道最为鲜美,且经HPSEC分析,发现其分子量主要分布3000~1000u之间。选取XAD-16大孔吸附树脂作为分离用树脂,确定了最佳的分离条件为:洗脱液,乙醇-水混合溶液;最佳上样浓度:0.5mg/m L;最佳上样流速:1.0mg/min。采用大孔吸附树脂在最优条件下分离呈味肽,用30%乙醇洗脱出来的组分感官评价最好,其呈鲜味和呈甘味的氨基酸总含量达35.71g/100g,占氨基酸总量的36.11%。
[1]张祥刚,周爱梅,林晓霞,等.凡钠滨对虾虾头、虾壳化学成分的对比研究[J].现代食品科技,2009,25(3):224-227.
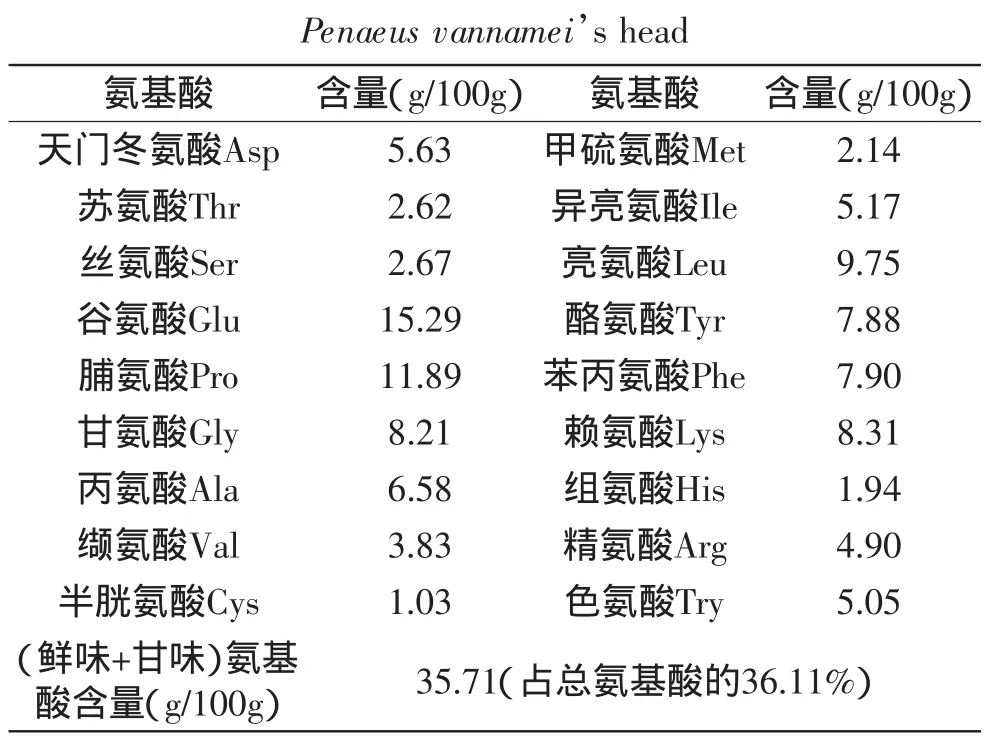
表2 X30%洗脱组分中结构氨基酸含量Table2 Contents of amino acids in autolysates of
[2]彭燕,曾霞.凡钠滨对虾虾头的营养成分分析及评价[J].茂名学院学报,2002,17(1):25-27.
[3]张梅秀,王锡昌,刘源.食品中的呈味肽及其呈味机理研究进展[J].食品科学,2012,33(7):320-326.
[4]李莹,黄开红,周剑忠,等.水产蛋白酶解制备鲜味肽[J].食品科学,2012,33(13):248-253.
[5]乔路,佟伟刚,周大勇,等.酶法制备鲍鱼脏器呈味肽及呈味氨基酸[J].大连工业大学学报,2011,30(3):168-174.
[6]赵谋明,肖如武,崔春,等.超滤对马氏珍珠贝肉蛋白酶解液特性的影响[J].华南理工大学学报,2009,37(10):124-129.
[7]赵锐,顾谦群,管华诗.多肽物质分离与分析方法研究进展[J].中国海洋药物,2000(3):8-53.
[8]林流丹,欧仕益,吴建中,等.采用大孔树脂从罗非鱼酶解物中分离低聚肽的研究[J].食品科技,2008(8):168-172.
[9]黄艳春.酶解淡水鱼蛋白制取血管紧张素转化酶抑制肽的研究[D].武汉:华中农业大学,2004.
[10]林莉.玉米蛋白酶解制备高F值低聚肽及应用研究[D].哈尔滨:东北农业大学,2003.
[11]CaoW H,Zhang C H,Hong P Z,et al.Response surface methodology for autolysis parameters optimization of shrimp head and amino acids released during autolysis[J].Food Chemistry,2008,109(1):176-183.
[12]张水华.食品分析[M].北京:中国轻工业出版社出版,2007:240-244.
[13]张水华.食品感官分析与实验[M].北京:化学工业出版社,2006:86-90.
[14]程云辉,王璋,许时婴.大孔吸附树脂对麦胚肽的吸附特性研究[J].食品与机械,2005,21(6):7-12.
[15]宋美,郭顺堂.大豆蛋白呈鲜组分的制备及其性质研究[J].大豆科学,2006,25(4):349-354.
[16]邓劲光,胡熙恩,朱永.大孔吸附树脂对氢化可的松的吸附与洗脱性能研究[J].离子交换与吸附,2000,16(2):134-139.
[17]焦连庆,魏俊杰,徐景达.红参须根中多肽成分的分离与鉴定[J].中草药,1996,27(2):70-72.
