催化荧光法测定蔬菜中痕量亚硝酸根的研究
2014-02-20刘永涛云霞那广水
刘永涛,云霞,那广水*
(1.大连工业大学生物工程学院,辽宁大连116034;2.国家海洋环境监测中心,辽宁大连116023)
催化荧光法测定蔬菜中痕量亚硝酸根的研究
刘永涛1,2,云霞1,那广水2*
(1.大连工业大学生物工程学院,辽宁大连116034;2.国家海洋环境监测中心,辽宁大连116023)
该研究建立了催化荧光分析法测定蔬菜中痕量NO2-的方法。NO2-可以催化中性红的荧光褪色反应,且其含量与褪色反应速率成正比。通过单因素试验以及均匀试验优化了实验条件,确定了最佳的试剂因素组合。实验结果表明:在激发波长λex=537 nm和发射波长λem=595 nm,试剂因素组合中性红900 μL,溴酸钾1 850 μL,硫酸1 050 μL时,方法NO2-测定的工作曲线为y=1.58x+0.46,相关系数r=0.999 5,线性范围为0.02~0.11 mmol/L,检出限0.001 2 mmol/L,变异系数为6.5%,平均回收率为100.2%,此法适合于根茎类蔬菜中微量NO2-含量的测定。
催化荧光法;亚硝酸根;均匀试验
亚硝酸盐作为食品添加剂是允许使用的,常作为发色剂,具有一定的抗菌防腐作用。但是人体过量摄入亚硝酸盐后,可将低铁血红蛋白氧化成为高铁血红蛋白,使之失去输送氧的能力,且亚硝酸根(NO2-)易与仲胺类化合物反应生成强致癌性物质亚硝胺,会对人体产生较强的毒性,并有可能引发致癌、致畸等后果,因而测定亚硝酸盐是环境、食品分析中的重要指标[1-2]。目前国内外测定亚硝酸盐的标准方法仍为重氮耦合比色法,此法显色反应稳定性较差,所需试剂本身也都是毒性很大的致癌物质,同时样品中的铜、铁、硫、碘等离子都会对测定有干扰作用[3-5]。鲍所言等[6]选用的荧光催化剂为高毒且具有致癌性的吖啶橙,通过对其改进,本实验将荧光剂选择为安全无毒的中性红,以提高实验的安全性。本研究根据NO2-可以催化中性红氧化使其褪色的反应,建立了测定NO2-的新体系。NO2-本身不发荧光,但它可以催化中性红和溴酸钾的荧光发生褪色反应,反应速率与NO2-的含量呈正比[7-8]。该方法可用于测定河水、地下水和根茎类农作物中痕量NO2-的含量。从而建立了生物或食品类样品中痕量亚硝酸盐的荧光检测方法。
1 材料与方法
1.1 材料与试剂
圆葱、马铃薯:市售;硫酸、亚硝酸钠(分析纯)、中性红(指示剂):天津科密欧化学试剂开发中心;溴酸钾(分析纯):国药集团化学试剂有限公司;三氯甲烷(分析纯):天津市大茂化学试剂厂。
1.2 仪器与设备
FR-540荧光光度计:日本岛津公司;HH-S超级恒温水浴锅:巩义市英峪予华仪器厂;感量0.000 1 g电子天平:梅特勒-托利多仪器上海有限公司;101-2电热鼓风干燥箱:天津实验仪器厂;单道可调移液枪:大龙兴创实验仪器有限公司。
1.3 试验方法
1.3.1 试剂的配制
1 mg/mL NO2-标准储备液:精密称取1 g于硅胶干燥器中干燥24 h的亚硝酸钠,加去离子水溶解移入1 000 mL容量瓶中,加2 mL氯仿作保护剂,以抑制细菌生长并防止HNO3释出,然后用去离子水稀释至刻度。
10 μg/mL NO2-标准使用液:临用前,吸取NO2-标准储备液1 mL,置于100 mL容量瓶中,加去离子水稀释至刻度。
1.0 mmol/L中性红溶液:称取约29 mg中性红,用去离子水溶解后,定容至100 mL。
0.2 mol/L溴酸钾溶液:称取3.34 g溴酸钾,用去离子水溶解后,定容至100 mL。
0.18 mol/L硫酸溶液:量取约4.9 mL 98%硫酸,倒入100 mL去离子水的烧杯,然后加水至500 mL。
1.3.2 荧光强度测定方法
在10 mL具塞比色管中依次加入1.0 mmol/L中性红溶液1 000 μL,0.2 mol/L溴酸钾溶液1 800 μL,0.18 mol/L硫酸1 000 μL,10 μg/mL NO2-标准溶液3 000 μL或待测溶液适量,用去离子水定容至10 mL,同时做试剂空白实验。将配制好的溶液摇匀后,置于55℃水浴中反应10 min,然后转入20℃水浴10 min。在最佳激发波长和发射波长处,分别测定空白体系和催化体系溶液的荧光强度F0和F,并计算△F=(F0-F)的值。
1.3.3 均匀试验方案设计
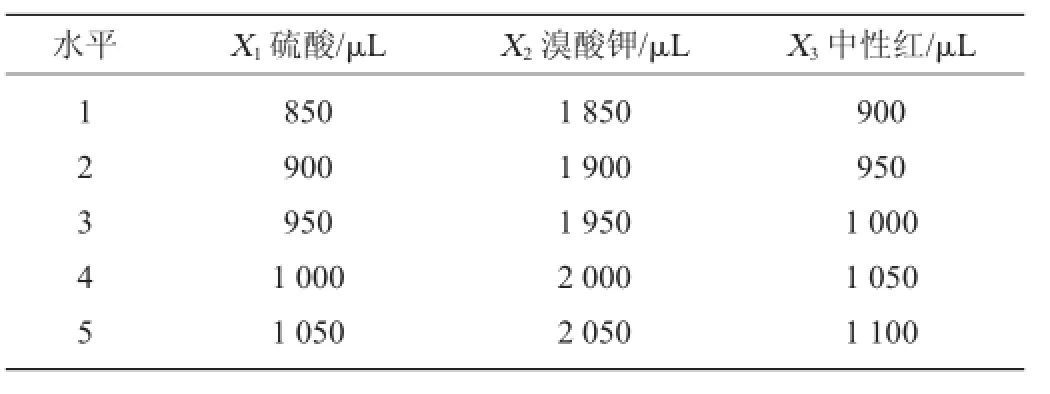
表1 荧光强度优化均匀试验因素与水平Table 1 Factors and levels of uniform experiment for fluorescence intensity optimization
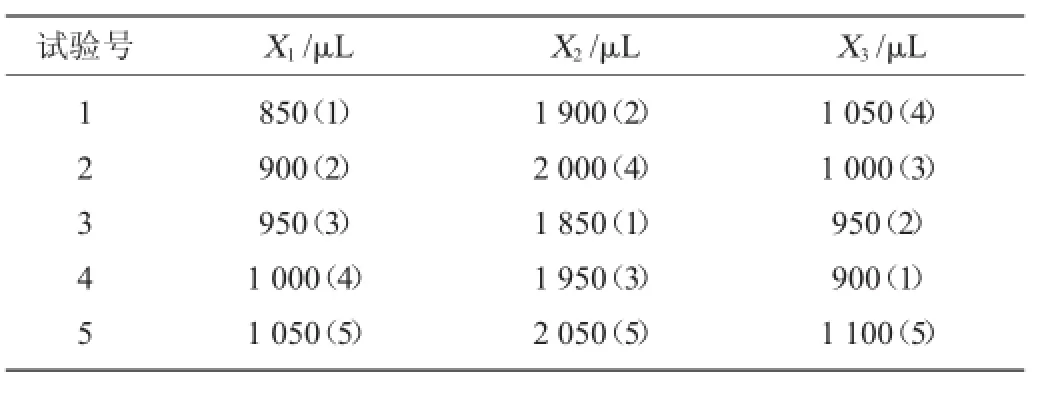
表2 荧光强度优化均匀试验设计方案Table 2 Design program of uniform experiment for fluorescence intensity optimization
以硫酸用量X1、溴酸钾用量X2和中性红用量X33个因素,采用5水平作均匀试验设计,其因素与水平列于表1中。其中每个因素的水平范围选择以单因素试验中所得的最佳试验条件为依据。根据因素数和因素的水平数,选择U5(54)均匀试验设计表与使用表进行表头设计和试验方案设计。表头设计选择均匀试验设计表的1、2、4列安排X1、X2和X33个因素,得到均匀试验设计方案表2。
2 结果与分析
2.1 测定波长的选择
在10 mL具塞比色管中加入1.0 mmol/L的中性红溶液1 000 μL,用去离子水定容至10 mL,扫描其激发波长与发射波长。激发光在450~570 nm内的最佳值为λex=537 nm,发射光在530~640 nm内的最佳值为λem=595 nm,扫描结果见图1。
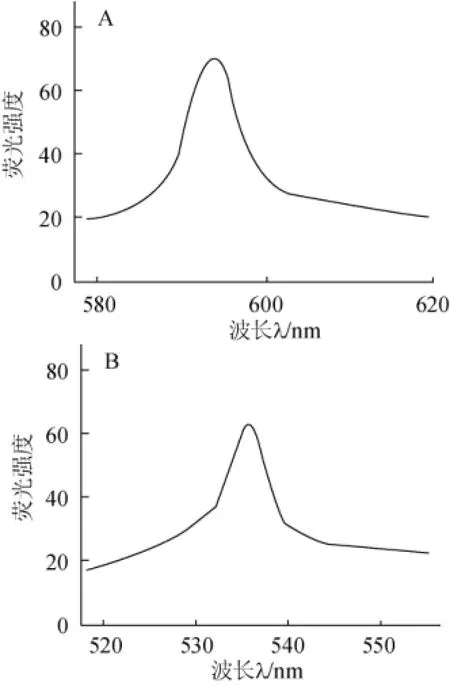
图1 中性红激发光谱(A)与发射光谱(B)Fig.1 Excitation spectra(A)and emission spectrum(B)of neutral red
2.2 单因素试验
2.2.1 中性红用量的选择

图2 中性红用量对荧光强度的影响Fig.2 Effect of neutral red addition on fluorescence intensity
分别吸取1.0 mmol/L中性红溶液700 μL、800 μL、900 μL、1 000 μL、1 100 μL,按照1.3.1试验方法配制溶液并测定荧光强度,结果如图2所示。
随着中性红用量的增加,△F值也逐渐增大,在中性红用量为800~1 000 μL时,△F值达到最大,并基本保持平稳。继续增加中性红用量,△F值反而逐渐下降。实际测量的中性红用量宜选择催化强度最大且变化较平稳的范围,也即选择900 μL作为中性红的最佳用量。
2.2.2 溴酸钾用量的选择
首先在各比色管中加入900μL中性红溶液(1.0mmol/L),然后分别加入1500μL、1600μL、1700μL、1800μL、1900 μL溴酸钾溶液(0.2 mol/L),再依照1.3.1试验方法配制溶液并测定荧光强度,结果图3所示。
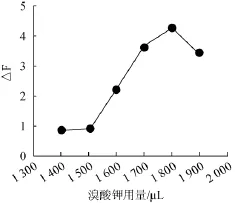
图3 溴酸钾用量对荧光强度的影响Fig.3 Effect of potassium borate addition on fluorescence intensity
由图3可以看出,溴酸钾用量的增加会使△F值也增大,当溴酸钾用量在1 700~1 900 μL之间时△F值变化缓慢并较稳定,溴酸钾用量为1 800 μL时△F值达到最大,继续增大溴酸钾用量,△F值反而会减小。所以溴酸钾用量为1 800 μL时,亚硝酸根的催化强度可达到最大,此为最佳的溴酸钾用量。
2.2.3 硫酸用量的选择
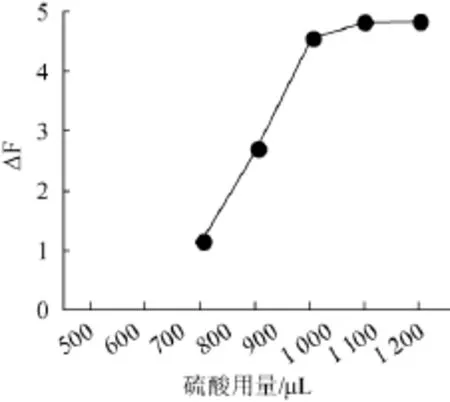
图4 硫酸用量对荧光强度的影响Fig.4 Effect of sulfuric acid addition on fluorescence intensity
在各比色管中取900 μL中性红溶液(1.0 mmol/L)和1 800 μL溴酸钾溶液(0.2 mol/L),再依次加入700 μL、800 μL、900 μL、1 000 μL、1 100 μL不同量的硫酸溶液(0.18 mol/L),再按照1.3.1试验方法配制溶液并测定△F值。
从图4可以看出,在硫酸用量为1000~1050μL时,△F值变化缓慢并达到最大值,在硫酸用量为1 050~1 100 μL时,△F值又开始减小。故硫酸用量为1 050 μL时,亚硝酸根的荧光催化程度达到最大,此即为硫酸的最佳加入量。
2.2.4 水浴时间对反应体系的影响
反应时间是影响△F值的一个关键因素,试验考察了55℃水浴中,不同反应时间5 min、6 min、7 min、8 min、9min、10 min、11 min被测体系的△F值的变化情况。图5的结果表明,在5~10 min之间,随反应时间的增加,体系的反应速率也增大,在水浴10 min时反应体系达到最大,当反应时间超过10 min,△F值开始减小,故水浴10 min为最佳的水浴时间。
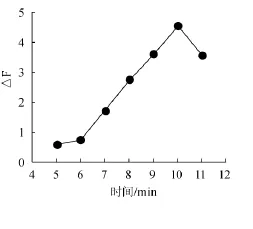
图5 水浴时间对反应体系的影响Fig.5 Effect of bath time on fluorescence intensity
2.2.5 水浴温度对反应体系的影响
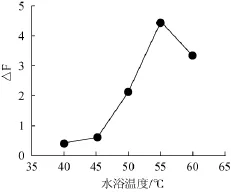
图6 水浴温度对反应体系的影响Fig.6 Effect of bath temperature on the reaction system
试验考察了反应温度40℃、45℃、50℃、55℃、60℃时体系△F值的化情况,发现温度对反应体系△F测定的结果影响很大,结果见图6。由图6可知,当反应温度<45℃时,催化作用不明显。但随着温度的升高,催化反应速度逐渐加快,△F值也逐渐增大,至55℃时,催化效果最为明显。继续升高温度,反应的速率反而降低。故水浴55℃
是亚硝酸根催化强度达到最大时的温度。
2.3 通过均匀试验确定最佳反应条件
完全从所选试验点的均匀性出发,即从全面试验点中挑选出部分具有代表性的试验点,来反映体系的主要特征。此设计方法最大的特点是使试验工作量更少。本研究仅选5个有代表性的试验点,设计方案见表2所示。
2.3.1 均匀试验直观分析结果
根据均匀试验设计方案表2,得到试验结果见表3。从表3结果可以看出,5个试验中4号试验△F值最强。所以直观分析结果认为较佳的试验方案为:中性红(1.0 mmol/L)用量900 μL、溴酸钾(0.2 mol/L)用量1 950 μL、硫酸(0.18 mol/L)用量1 000 μL。
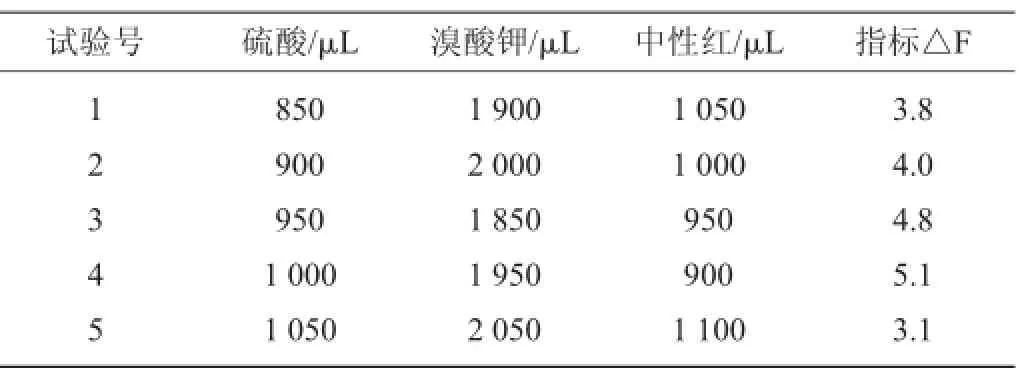
表3 均匀试验结果Table 3 Results of uniform test
2.3.2 均匀试验多元回归分析结果
利用SPSS软件对试验结果进行多元回归分析用求条件极值的强约束化法对回归方程进行优化,用Matlab编程,最小二乘法寻优。按照表2的试验方案来填写软件的运行参数。即考察指标数为1,试验因素数为3,运行次数为5,因素X1硫酸的上下限为850~1 050,因素X2溴酸钾的上下限为1850~2050,因素X3中性红的上下限为900~1100,置信水平选择95%。得回归方程Y=17+0.42X1-2.2X2-9.0X3。
回归方程的变量分析见表4。样本容量N=5,显著性水平α=0.05,检验值Ft=342.6,临界值Fα(3,1)=215.7,由于Ft>Fα(3,1),所以回归方程显著。经优化处理,当中性红取900 μL,溴酸钾取1 850 μL,硫酸取1 050 μL时,指标荧光强度△F值最大,即中性红被氧化的最彻底,此为更好的反应条件,不在表2的5个试验方案当中,因此需要验正试验。
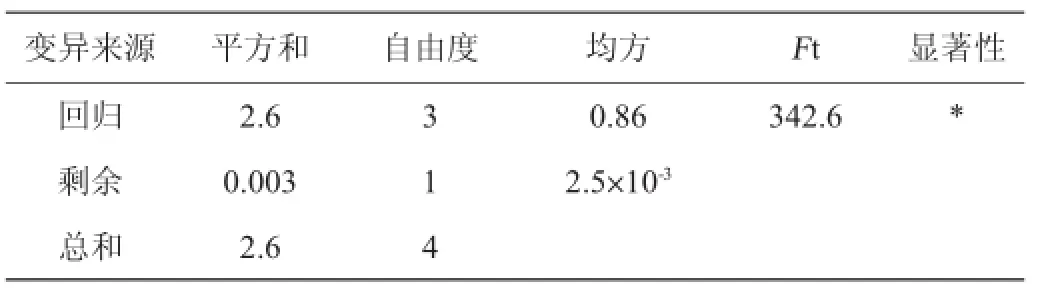
表4 回归方程变量分析Table 4 Variable analysis of regression equation
经过以上回归分析,确定了3种试剂的加入量,并重新选取新的试验参数进行了两次试验,试验数据如下:△F1=5.31,△F2=5.28,平均△F=5.30,在所有试验数据中为最高值,验证了在该条件下,中性红被氧化的最彻底。
2.3.3 标准曲线的绘制及检出限
在5支比色管中依次加入900μL中性红溶液(1.0 mmol/L),1 850 μL溴酸钾溶液(0.2 mol/L),1 050 μL硫酸溶液(0.18 mol/L),再分别加入1 000 μL、2 000 μL、3 000 μL、4000μL、5000μLNO2-标准使用液(10 μg/mL),以去离子水定容至10 mL。55℃下水浴10 min,然后转入20℃水浴保持10 min后,同时做试剂空白试验,测其荧光强度△F值。以NO2-用量为横坐标,△F值为纵坐标,得标准曲线见图7。按5次空白实试验标准偏差(σ)的3倍除以工作曲线的斜率得到此种方法的检出限0.001 2 mmol/L。5次空白试验测得值的相对标准偏差2.7%。
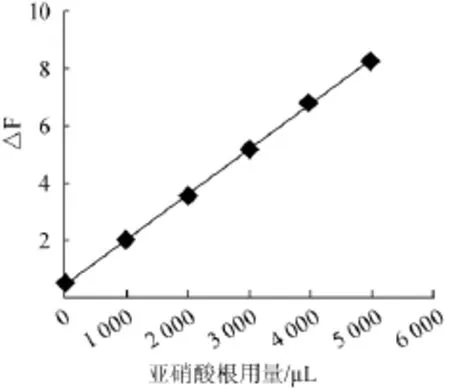
图7 NO2-标准曲线Fig.7 Standard curve of NO2-
标准曲线的回归方程y=1.58x+0.46的相关系数r=0.999 5,表明当NO2-浓度为0.02~0.11 mmol/L时,体系的荧光强度△F与NO2-浓度呈现良好的线性关系。可进一步进行样品的测定。
2.3.4 样品的预处理及测定
取新鲜马铃薯与圆葱洗净、晾干。分别准确称取带皮与无皮马铃薯2.0g放入研钵中,加入80mL蒸馏水捣碎匀浆,过滤,滤液于100 mL容量瓶中定容。另分别准确称取带皮与无皮圆葱5.0 g,放入研钵中,加入80 mL蒸馏水捣碎匀浆,过滤,滤液于100 mL容量瓶中定容。配制成的四种溶液按中性红取900 μL,溴酸钾取1 850 μL,硫酸取1 050 μL进行样品测定,平行做2组试验,测得的结果如表5所示。将平均△F值代入回归方程中,可计算出两种蔬菜NO2-的含量。
由表5可知,带皮蔬菜中的NO2-含量比不带皮的蔬菜中NO2-含量高,说明蔬菜中的表皮中也含有NO2-,所以根茎类蔬菜在食用时最好去皮食用。根据蔬菜中亚硝酸盐的含量标准,本试验中样品的NO2-含量低于国家标准,由此可得本试验中样品的亚硝酸盐含量没有超标。
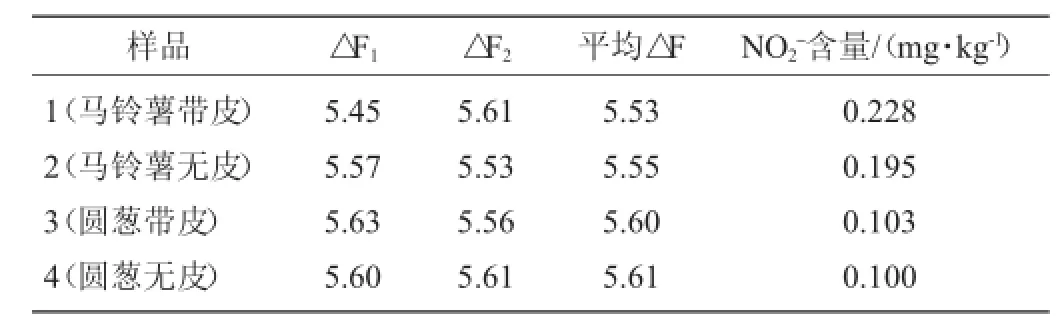
表5 样品NO2-含量试验结果Table 5 NO2-content results of samples
2.3.5 精密度试验与加标回收率试验
取5只10 mL具塞比色管,向其中依次加入中性红900 μL,溴酸钾1 850 μL,硫酸1 050 μL和待测液1 000 μL,在55℃水浴中加热10 min,转入20℃水浴10 min后,做精密度试验,结果见表6所示。回收率加标试验结果见表7所示。

表6 NO2-含量精密度试验结果Table 6 Precision experiment results of NO2-content
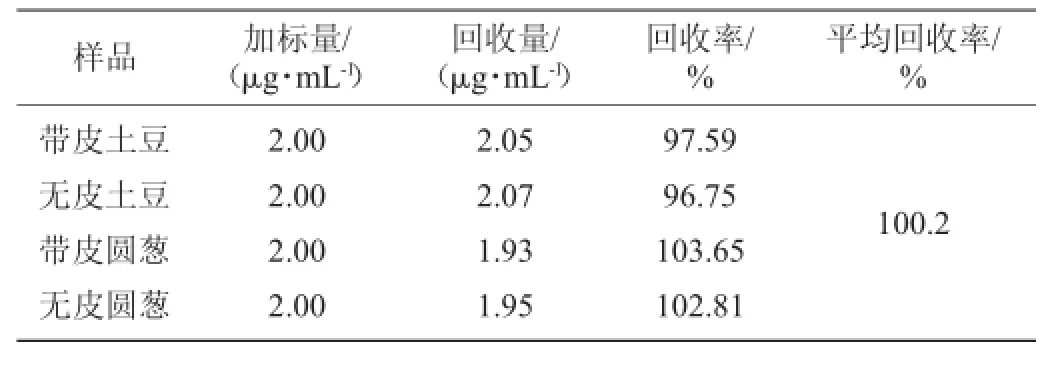
表7 NO2-含量回收率试验结果Table 7 Recovery experiment results of NO2-content
由表6和表7可见,用催化荧光法测定NO2-偏差小,变异系数(coefficient of variation,CV)低,回收率接近100%,适合根茎类植物中所含的微量NO2-浓度的测定。
3 结论
利用中性红氧化反应体系中的NO2-可以起到催化作用的原理,根据中性红荧光强度的变化与NO2-含量成正比的关系来测定NO2-的含量。通过单因素试验和均匀试验证明中性红溶液(1.0 mmol/L)加量900 μL,溴酸钾溶液(0.2 mol/L)加量1 850 μL,硫酸(0.18 mol/L)加量1 050 μL时,催化程度最明显。
在微量NO2-的荧光分析中建立了最佳分析条件:激发波长λex=537.0 nm,发射波长λem=595.0 nm,最佳测定工作曲线为y=1.58x+0.46,相关系数r=0.999 5。亚硝酸盐的线性范围为0.02~0.11 mmol/L,检出限为0.001 2 mmol/L,相比吖啶橙法(0.000 3 mmol/L)略高。
通过对马铃薯和圆葱两种蔬菜样品的分析测定,所得数据的标准偏差为0.029,变异系数为6.5%,此方法测定蔬菜中亚硝酸根含量的平均回收率为100.2%。并通过研究证实蔬菜的表皮中也含有一部分亚硝酸盐。在通常情况下,由于根茎类蔬菜中的亚硝酸盐主要来自于所吸收的水分,所以其含量较低,对人体无害。本法也适用于其他蔬菜中亚硝酸盐农药残留的检测,还为无荧光物质的荧光检测奠定了基础,开阔了荧光分析方法的应用途径。
[1]吴小春,吴友谊.环境水样及食品中亚硝酸根的分析进展[J].分析测试技术与仪器,2003,9(4):227-233.
[2]MOORCROFT M J,DAVIS J,COMPTON R G.Detection and determination of nitrate and nitrite:a review[J].Talanta,2001,54(5):785-803.
[3]齐小玲,富新权,谢君创.催化光度法测定水中微量亚硝酸根[J].湖北化工,2001,3(1):45-46.
[4]MINAKATA K,OKMAOTO N,NOZAWA H,et al.Determination of nitrite in bio1ogical fluids by use of electron spin resonance[J].Anal Biochem,2004,325(1):168-170.
[5]ZUO Y G,WANG C G,VAN T.Simultaneous determination of nitrite and nitrate in dew,rain,snow and lake water samples by ion-pair highperformance liquid chromatography[J].Talanta,2006,70(2):281-285.
[6]鲍所言,刘卫洁,胡汉芳.催化荧光法测定痕量亚硝酸根[J].光谱学与光谱分分析,2004,24(3):342-344.
[7]刘常增.锌试剂-NO2-/KBrO3催化体系测定痕量亚硝酸根[J].光谱学与光谱分析,2003,23(3):348-350.
[8]徐远金,李海云,姚志雄,等.水中亚硝酸根的表面活性剂增敏催化动力学流动注射荧光法测定[J].分析测试学报,2003,22(4):32-34.
[9]韩志辉,吕昌银.吖啶红荧光碎灭法测定痕量亚硝酸根[J].中国卫生检验杂志,2004,14(3):287-288.
[10]李书华,蒲彪,陈封政.VC和发酵温度对泡仔姜中亚硝酸盐的影响[J].中国酿造,2006,25(2):34-36.
[11]ZHANG M,YUAN D X,HUANG Y M.Sequential injection spectrophotometric determination of nanomolar nitrite in seawater by on-line preconcentration with HLB cartridge[J].Acta Oceanologica Sinica,2010,29(1):100-107.
[12]张莹,孙君社,张京声,等.溶氧对巨大芽孢杆菌发酵亚硝酸还原酶的影响[J].中国酿造,2011,30(6):43-47.
[13]WEI C.Analysis of the influence of free ammonia on the accumulation ofnitriteinthe nitrite nitrification system[J].Chinese J Geochem,2009, 28:440-444.
[14]范亚娜,盖轲.几种腌制蔬菜中亚硝酸盐含量的测定[J].宝鸡文理学院学报:自然科学版,2008(1):41-43
[15]YU D B,YONG D M,DONG S J.Toxicity detection of sodium nitrite, borax and aluminum potassium sulfate using electrochemical method [J].J Environ Sci,2013,25(4):785-790.
[16]韩彬,曹磊,郑立,等.夹管电磁阀定量-流动注射分析系统测定海水中亚硝酸盐和硝酸盐氮[J].分析化学,2010,38(12):1832-1837.
Determination of trace nitrite in vegetables by catalytic fluorescence method
LIU Yongtao1,2,YUN Xia1,NA Guangshui2*
(1.College of Biological Engineering,Dalian Polytechnic University,Dalian 116034,China; 2.National Marine Environmental Monitoring Center,Dalian 116023,China)
A method for trace nitrite determination in vegetables by catalytic fluorimetry was established.The neutral red fluorescence bleaching reaction could be catalyzed by nitrite,and the reaction rate was in direct proportion to nitrite content.The optimal reaction conditions and reagent combinations were determined by single factor and uniform experiment.Result showed that under the condition of excitation wavelengthλex=537 nm,emission wavelengthλem=595 nm,combination of reagent factors were neutral red 900 μl,potassium bromate 1 850 μl and sulfuric acid 1 050 μl.The standard curve for nitrite determination of the present method wasy=1.58x+0.46,(r=0.999 5).The linear range was 0.02~0.11 mmol/L,detection limit was 0.001 2 mmol/L,variation coefficient was 6.5%and average recovery rate achieved 100.2%.The method is suitable for micro nitrite content determination in root vegetables.
fluorescence analysis method;nitrite;uniform test
O657.3
A
0254-5071(2014)07-0113-05
10.11882/j.issn.0254-5071.2014.07.026
2014-05-04
国家海洋局青年海洋科学基金(20090507)
刘永涛(1990-),男,硕士研究生,研究方向为生物催化与生物分析。
*通讯作者:那广水(1977-),男,副研究员,博士,研究方向为检测技术研究与应用。
