FeMnMg氧化物Fenton催化降解有机废水
2014-02-19贾若琨
贾若琨,李 佳
(东北电力大学化学工程学院,吉林吉林132012)
20世纪80年代以后高级氧化技术(AOPs)引起了科研工作者的重视,Fenton法作为废水处理技术已被广泛的研究和使用[1]。亚铁离子在酸性条件下催化过氧化氢产生氧化能力更强的中间体羟基自由基,可以氧化难降解有机物[2]。Fenton法具有操作简单,费用低,不需要复杂设备,对环境友好等优势[3]。
过氧化氢和亚铁盐的混合物称为Fenton试剂,其发生的反应称为Fenton反应[4]。Fenton试剂是由H2O2和Fe2+混合得到的一种强氧化剂[5],它通过催化分解H2O2产生的OH·进攻有机物分子夺取氢,将大分子有机物降解为小分子有机物或矿化为CO2和H2O等无机物,化学反应方程式如下[6,7]:
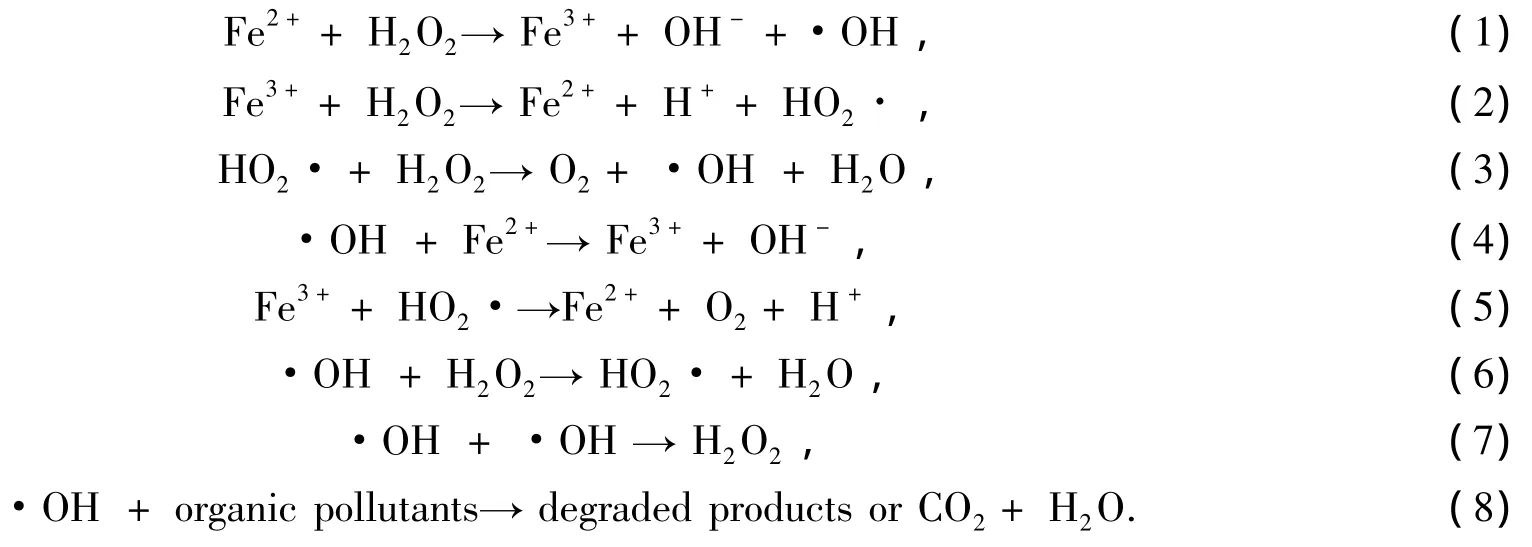
传统Fenton试剂法是一种单独采用Fe2+/H2O2体系氧化的方法,多用于有机物含量较低的废水处理和高浓度有机废水的预处理工艺中[8]。
Fenton试剂的研究受到人们的广泛关注。相对于其他的水处理方法,Fenton氧化法能够在反应过程中生成大量的非常活泼的羟基自由基[9],·OH能够没有选择性地直接与染料废水中的有机物发生氧化反应,并将废水中的有机物直接Fenton氧化降解为二氧化碳、水和无污染物[10],羟基自由基Fenton降解有机物的过程是一种物理-化学处理过程,反应过程可以加以控制,反应的速度很快,能在很短时间内达到处理的要求[11]。从国内外的研究可以看出,非均相Fenton试剂的研究被广为关注,各种非均相Fenton试剂被用于降解偶氮染料、2,6-二甲基苯胺、多氯酚类、苯酚、罗丹明B等有机物[12,13]。非均相Fenton体系适应的pH值范围通常为3-5,为了扩大其应用领域,人们不断的进行扩大适用pH值范围的研究[14]。龙等[15]成功地合成了非均相Fenton试剂Fe3O4/CeO2复合物,在pH值为4-5时能够有效地降解4-氯酚。Sun等研究了BiFeO3磁性纳米颗粒降解罗丹明B,实验表明BiFeO3磁性纳米颗粒对罗丹明B的总有机碳降解率可以达到85%以上,反应的pH值可升高到5.0[16,17]。丁巍等研究了硫改性铁酸锌的光芬顿降解效果,实验结果表明在pH=6.0时,铁酸锌对活性KN-GR的总有机碳的去除率可达90%,而色度的去除率可以达到100%[18,19]。
1 实验材料与方法
1.1 FeMnMg氧化物的制备
用硝酸铁、硝酸锰和硝酸镁制备FeMnMg氧化物纳米催化剂,在固定Fe、Mn、Mg三种元素中两种元素的摩尔比为1∶1不变的情况下,改变另一种元素的摩尔比从0.5-3(每隔一组增加0.5),将制备好的FeMnMg试样保存于离心管中备用。计算出Fe(NO3)3·9H2O(M=404.00),Mn(NO3)2(M=178.95),Mg(NO3)2·6H2O(M=256.41)不同摩尔比所用的质量记录于下表(表1),然后按照表1中数据用电子天平称量各药品的质量置于坩埚中,再用少量去离子水将称量后的药品在坩埚中用玻璃棒搅拌均匀溶解。将坩埚置于电炉上蒸干水分,利用玻璃棒搅拌溶解后将坩埚置于电炉上加热浓缩烘干成粉末状,然后将制成的粉末用研钵研磨细致后置于瓷舟中900℃下烧制2 h。
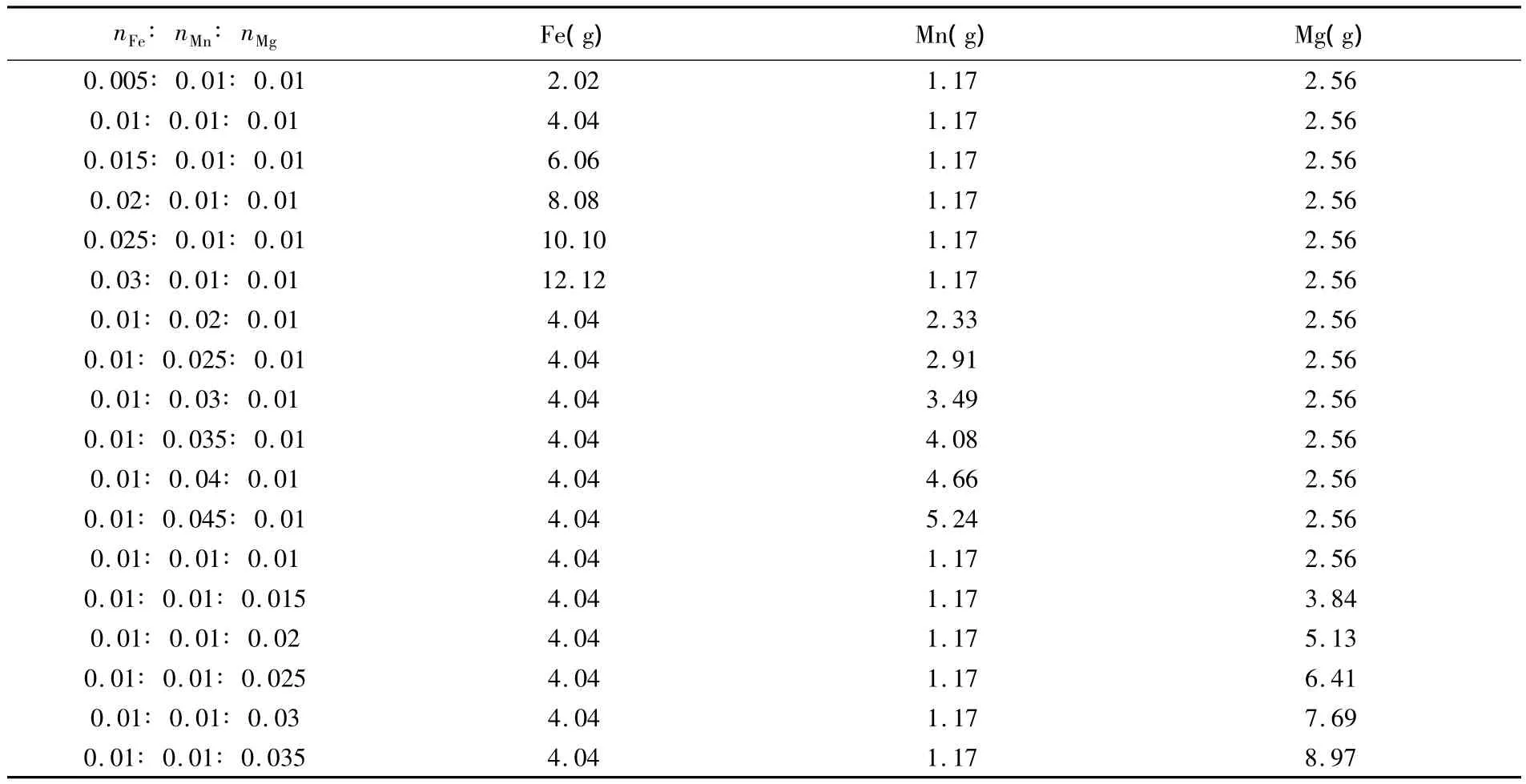
表1 同元素配比催化剂的所用药品质量
1.2 FeMnMg氧化物的表征
将制备好的FeMnMg氧化物颗粒经过超声分散处理后利用扫描电镜观察FeMnMg颗粒表面,图1为Fe组分含量较高的试样,图2为Mn组分含量较高的试样,图3为Mg组分含量较高的试样。
从SEM图中可以看出,FeMnMg氧化物颗粒是由直径都是在纳米级别的,其尺寸较为均一。图中有的颗粒絮聚成团并且边缘有些模糊,这是由于单个粒子中存在的Fe具有磁性,使催化剂的颗粒在磁吸引的作用下团聚在了一起,也因为其有磁性,而影响SEM成像的清晰度。

图1 FeMnMg氧化物颗粒的SEM图像(Fe含量高)

图2 FeMnMg氧化物颗粒的SEM图像(Mn含量高)

图3 FeMnMg氧化物颗粒的SEM图像(Mg含量高)
1.3 FeMnMg氧化物降解亚甲基蓝模拟有机废水
首先配置1 mg/L的亚甲基蓝溶液:称取约0.05 g亚甲基蓝粉末置于250 mL容量瓶中,用去离子水定容并溶解均匀,再用移液管移取5mL亚甲基蓝溶液至100 mL的容量瓶中同样定容并摇匀,即得到1 mg/L的亚甲基蓝溶液。然后用紫外可见分光光度计测定1 mg/L亚甲基蓝溶液的初始吸光度值。
之后利用FeMnMg氧化物催化剂催化降解配置好浓度的亚甲基蓝:依次称取0.012 g不同组分的FeMnMg氧化物置于试管中,再用移液管移取10 mL的1 mg/L的亚甲基蓝溶液到试管中,静止10-20 min左右,然后将试管放入小烧杯中在水浴锅中25℃加热20 min后再用移液管移取0.5 mL 30%的H2O2,继续在水浴锅中静止1 h左右后开始在664 nm波长下(亚甲基蓝在664 nm处有最大吸光度)测量降解后的亚甲基蓝的吸光度,每隔0.5 h测量一次,根据实际情况测量到4 h左右。同时进行一组空白实验,用移液管移取10 mL 1 mg/L的亚甲基蓝溶液于试管中,同样静止10-20 min左右,然后将试管放入小烧杯中在水浴锅中25℃加热20 min后再用移液管移取0.5 mL30%的H2O2,继续在水浴锅中静止1 h左右后开始测量亚甲基蓝的吸光度,每隔0.5 h测量一次,由0.5 h测到4 h。
利用所测得的吸光度值计算亚甲基蓝的降解率:
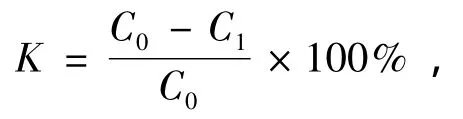
式中:K为亚甲基蓝的去除率;C0为处理前水样的初始浓度;C1为处理后水样的浓度。
首先控制催化剂中Mn和Mg的摩尔比为1∶1,依次递增Fe的含量从摩尔比0.5∶1∶1至3∶1∶1,按照上述方法用不同配比的FeMnMg氧化物催化剂降解亚甲基蓝模拟的有机废水,然后计算出的降解率如图4。
可以看出,FeMnMg氧化物催化剂对亚甲基蓝的催化降解效果随Fe的含量增加先增加后降低,铁的含量小时亚甲基蓝的降解率小,由于此时反应体系中产生的·OH相对较少,使FeMnMg氧化物催化剂对亚甲基蓝的降解率降低,然而,当催化剂中铁含量相对增加很多时,过多的Fe组分使得催化剂的组成不稳定,而使得催化剂对亚甲基蓝的催化降解率降低。
之后控制催化剂中Fe和Mg的摩尔比为1∶1,依次递增Mn的含量从摩尔比0.5∶1∶1至3∶1∶1,按照上述方法用不同配比的FeMnMg氧化物催化剂降解亚甲基蓝模拟的有机废水,然后计算出的降解率,如图5所示。
FeMnMg催化剂在与亚甲基蓝、H2O2反应4h后,降解率并不相同,其随Mn的含量增加先增加后降低,这是由于氧化物催化剂中的Mn会促进Fe的反应,使其催化速率加快,从而在降解亚甲基蓝时降解效果好,然而Mn含量过多时催化剂的组分不稳定,从而使催化剂对亚甲基蓝的降解效果下降。
同样再控制催化剂中Fe和Mn的摩尔比为1∶1,依次递增Mg的含量从摩尔比0.5∶1∶1至3∶1∶1,利用不同配比的FeMnMg氧化物催化剂降解亚甲基蓝模拟的有机废水,然后计算出不同Mg配比的FeMnMg氧化物对Fenton模拟的有机废水降解率,如图6所示。
Mg含量增加会使催化剂降解率降低,是由于在反应过程中催化剂中Mg组分起到固定Fe和Mn两种成分的作用,而过多的Mg反而会影响催化剂的组成及稳定性,反而会降低催化剂对亚甲基蓝的Fenton降解率。
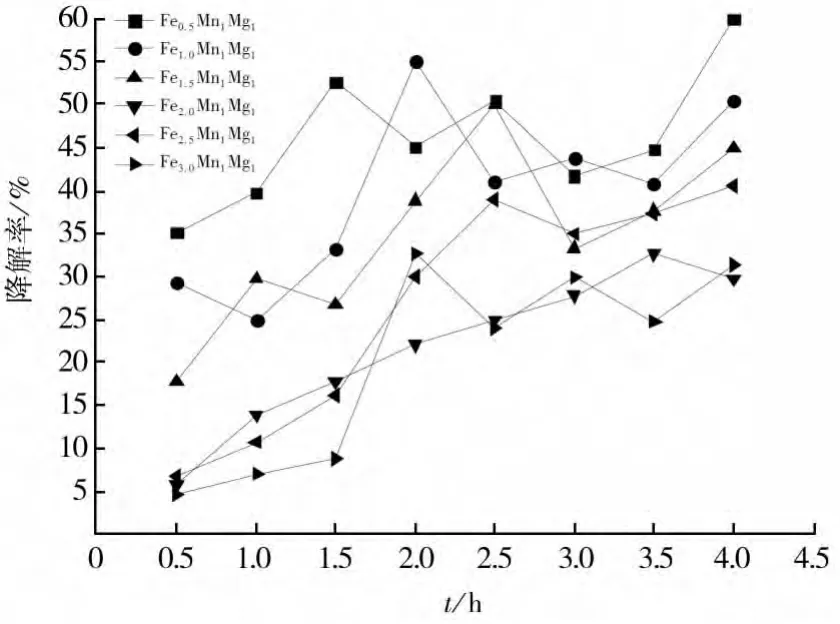
图4 Fe含量对降解率的影响
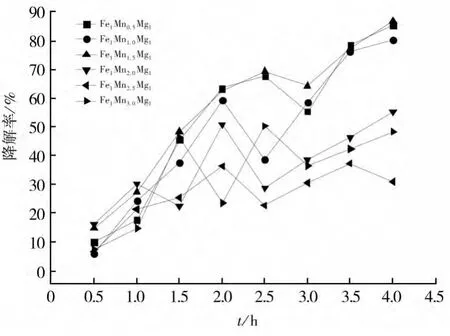
图5 Mn含量对降解率的影响
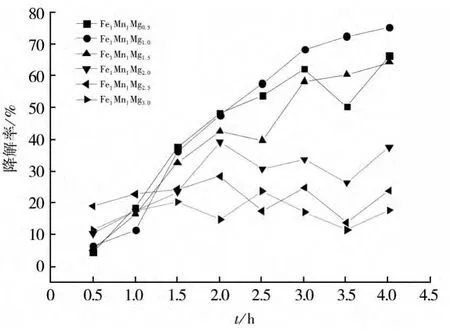
图6 Mg含量对降解率的影响
1.4 降解条件的探究
1.4.1 催化剂的投加量对降解率的影响
在控制反应体系温度及pH恒定的条件下,用移液管移1mg/L的亚甲基蓝溶液(10 mL)于试管中,称取Fe2Mn3Mg1(Fe∶Mn∶Mg=2∶3∶1)催化剂0.008-0.016 g依次加入试管中,静置20 min后再在水浴锅中25℃静止20 min,完成吸附过程。然后用移液管移取各0.5 mL 30%的H2O2依次加入到试管进行降解过程。每隔30 min用可见-紫外分光光度计测一次溶液的吸光度值,计算亚甲基蓝降解率,绘制成曲线,如图7所示。
根据降解率结果绘制的曲线可以看出,不同的催化剂投加量对亚甲基蓝模拟的有机废水的降解率影响略有差异,这主要是因为各个反应体系中的H2O2的量相同,催化分解产生的·OH的量同样相同。随着催化剂投加量由0.008 g递增至0.012 g,亚甲基蓝的降解率先增加后减少,但变化浮动并不大。体系中的Fe2+能加快催化分解H2O2产生·OH,在FeMnMg氧化物催化剂中Fe2+较多时能促进反应速率的加快,但是由于各反应体系中H2O2的量相同,即当反应进行足够长的时间后,投加较少FeMnMg催化剂反应体系中的亚甲基蓝也能被基本降解。因而根据图7降解率的曲线,选取FeMnMg氧化物催化剂的投加量为0.012 g,保证了亚甲基蓝的降解率。
1.4.2 H2O2的投加量对降解率的影响
在控制反应体系温度及pH恒定的条件下,利用移液管移取1 mg/L的亚甲基蓝溶液(10 mL)于试管中,称取Fe2Mn3Mg1(Fe∶Mn∶Mg=2∶3∶1)催化剂0.012 g依次加入试管中,静置20 min后再在水浴锅中25℃静止20 min,完成吸附过程。然后用移液管依次移取各0.1 mL至0.6 mL的30%H2O2加入到试管进行降解过程。然后每隔30 min用分光光度计测量溶液的吸光度值,计算亚甲基蓝降解率,绘制曲线,如图8所示。
根据亚甲基蓝降解率曲线可以看出降解率随着双氧水投加量地增加先增加后降低,当双氧水的投加量达0.5 mL后,双氧水投加量增大,降解率也基本不变。当H2O2的投加量较低时,Fe2+与H2O2反应产生的·OH的量较小,从而降低了亚甲基蓝的降解率。然而,当H2O2的用量过高时,过量的H2O2与·OH反应产生HO2,其氧化能力比·OH弱。因此,在反应体系中采用选取30%H2O20.5 mL(即2 mmol/L),能达到较好的氧化降解效果。
2.4.3 反应温度对亚甲基蓝降解率的影响
在控制反应体系pH恒定的条件下,利用移液管移取10 mL 1 mg/L的亚甲基蓝溶液(10mL)于试管中,称取Fe2Mn3Mg1(Fe∶Mn∶Mg=2∶3∶1)催化剂0.012g依次加入试管中,静置20 min后再在水浴锅中分别在1 0℃、15℃、20℃、25℃下静止20 min,完成吸附过程。然后用移液管移取各0.5 mL 30%的H2O2依次加入到试管静止1 h左右进行降解过程。然后每隔半小时用分光光度计测量溶液的吸光度值,绘制成曲线,如图9所示。
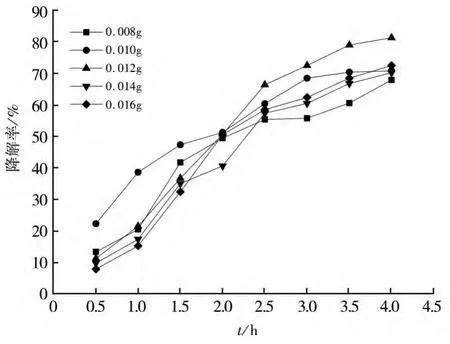
图7 催化剂投加量对降解率的影响
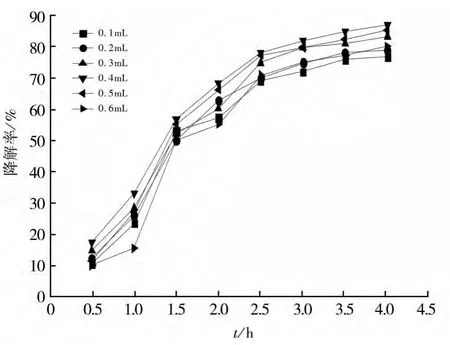
图8 H2O2投加量对降解率的影响
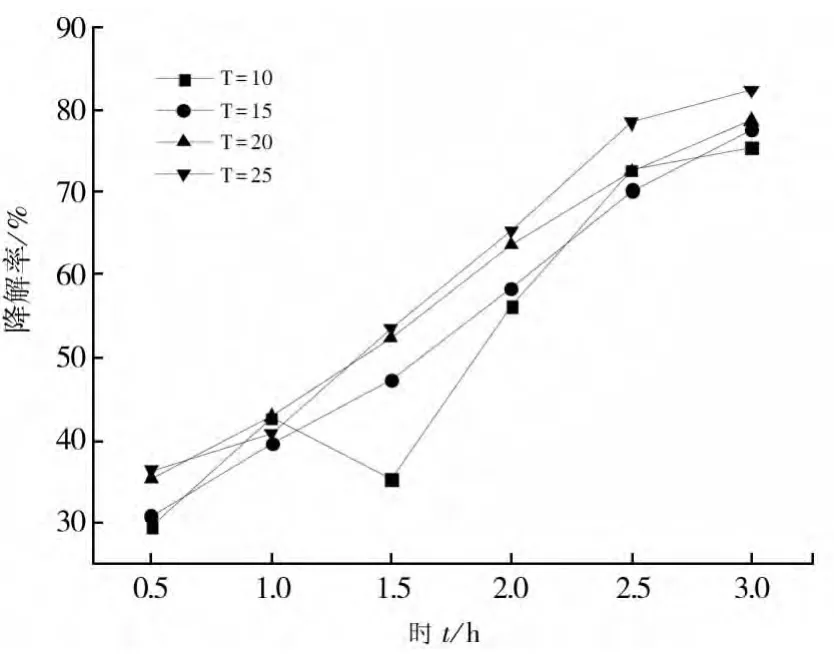
图9 温度对降解率的影响
由图9可以看出,反应温度较高反应体系中亚甲基蓝的降解速率较快,降解效果较高。这是因为在温度升高的反应体系中分子的运动加剧,增加了催化剂与亚甲基蓝分子的碰撞反应,从而提高了反应速率。
2.4.4 反应体系pH对亚甲基蓝降解率的影响
在保证反应体系温度恒定的条件下,用移液管移取10 mL 1 mg/L的亚甲基蓝溶液于试管中,称取Fe2Mn3Mg1(Fe∶Mn∶Mg=2∶3∶1)催化剂0.012 g依次加入试管中,调节五组反应体系的pH依次为3、4、5、6、7后,静置20 min后再在水浴锅中在25℃下静止20 min,完成吸附过程。然后用移液管移取各0.5mL 30%的H2O2依次加入到试管静止1 h左右进行降解过程。然后每隔0.5 h用分光光度计测量一次溶液的吸光度值,并计算亚甲基蓝降解率绘制成图10的曲线。
根据图中降解率的变化曲线可以看到,甲基蓝的降解率随pH值的升高而增大,而且当pH值为7左右时,降解速率最快。这是由于当pH值较低时,H+浓度过高,会使得·OH形成的速率减慢,·OH浓度减少,从而导致亚甲基蓝的降解率降低。
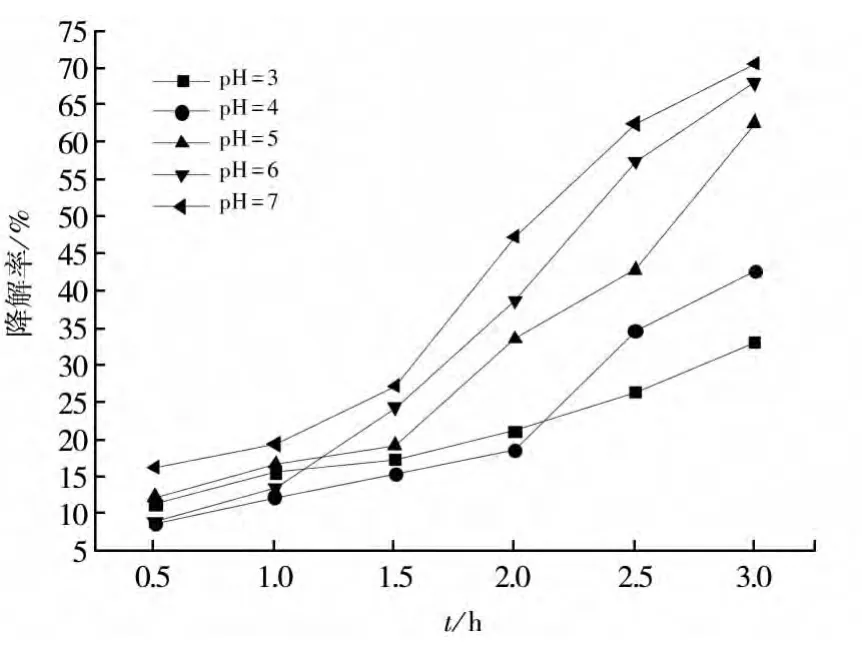
图10 pH对降解率的影响
2 结果与讨论
通过对不同Fe、Mn、Mg配比的氧化物对亚甲基蓝模拟的有机废水降解效果的实验研究,根据上述内容可以看出FeMnMg的摩尔比为2∶3∶1的氧化物对亚甲基蓝的降解效果最好。这是由于铁的含量小时亚甲基蓝的降解率小,此时反应体系中产生的·OH相对较少,使FeMnMg氧化物催化剂对亚甲基蓝的降解率降低,然而,当催化剂中铁含量相对增加很多时,过多的Fe组分使得催化剂的组成不稳定,而使得催化剂对亚甲基蓝的催化降解率降低。氧化物催化剂中的Mn会促进Fe的反应,使其催化速率加快,从而在降解亚甲基蓝时降解效果好,然而Mn含量过多时催化剂的组分不稳定,从而使催化剂对亚甲基蓝的降解效果下降。Mg含量增加会使催化剂降解率降低,是由于在反应过程中催化剂中Mg组分起到固定Fe和Mn两种成分的作用,而过多的Mg反而会影响催化剂的组成及稳定性,反而会降低催化剂对亚甲基蓝的Fenton降解率。
当pH值为7左右时,反应温度为25℃时,降解速率最快。FeMnMg氧化物催化剂的投加量为0.0 12 g,保证了亚甲基蓝较好的降解率。在反应体系中采用选取30%H2O20.5 mL(即2 mmol/L),能达到较好的氧化降解效果。
[1]张良林,徐晓军,郭建民,等.均相Fenton氧化一混凝法强化处理印染废水[J].化工环保,2006,26(1):38-40.
[2]傅亮,陈泽军.Fenton法及其在废水处理中的应用研究[J].环境污染与防治,2004,26(l):28-30.
[3]刘千钧,袁斌,伍红.Fenton法深度处理制浆造纸综合废水实验研究[J].造纸科学与技术,2009,25(4):57-59.
[4]武智,石晶晶,陈旭东.Fenton试剂氧化法在工业废水处理中的研究及应用进展[J].河北化工,2009,32(l):61-63.
[5]卢义程,赵建夫,李天琪.高浓度乳化废水芬顿氧化试验研究[J].工业用水与废水,2009,30:20-22.
[6]班福忱,刘炯天,程琳,等.电-Fenton法在水处理中的研究现状及发展趋势[J].工业水处理,2009,29(10):1-5.
[7]暴雅娴,华兆哲,李秀芬.Fenton氧化处理甲基橙染料模拟废水的动力学研究[J].水资源保护,2007,23(2):84-87.
[8]陈楠,陈永利,刘新亮,等.Fenton法深度处理制浆中段废水的工程应用[J].废水处理,2009,28:59-62.
[9]孟庆尧,邓德,刘美艳.Fenton氧化处理含酚类废水研究[J].环境污染与防,2009,26(3):34-36.
[10]张艮林,徐晓军,郭建民,等.均相Fenton氧化一混凝法强化处理印染废水[J].化工环保,2006,26(1):38-40.
[11]吴辉,陈娟,李成芳.Fenton试剂氧化降解亚甲基蓝的动力学研究[J].湖北大学学报:自然科学版,2009,31(2):59-63.
[12]H.Zhang,D.B.Zhang,J.Y.Zhou.Removal of COD from landfill leachate by Fenton method[J].Journal of Hazardous Materials[B],2005,135:106-111.
[13]龙明策,林金清,许庆清.非均相Fenton反应技术研究进展[J].环境污染治理技术,2005,6(7):15-18.
[14]赵永红,姜科.Fenton试剂去除选矿废水中黄药试验研究[J].江西理工大学学报,2009,30(5):33-36.
[15]龙明策,林金清,许庆清.非均相Fenton反应技术研究进展.环境污染治理技术与设备[J].2005,6(7):15-18.
[16]Jian-Hui Sun,Sheng-Peng Sun,Mao-Hong Fan,Hui-Qin Guo,Li-Ping Qiao,Rui-Xia Sun[J].Journal of Hazardous Materials,148(2007)172.
[17]武智,石晶晶,陈旭东.Fenton试剂氧化法在工业废水处理中的研究及应用进展[J].河北化工,2009,32(1):61-63.
[18]丁巍,尚艳.光助Fenton氧化法降解水中的活性艳蓝KN-R[J].化工环保,2009,29(3):212-215.
[19]雷乐成,汪大翠.水处理高级氧化技术[M].北京,化学工业出版社,2001.
