正交设计优化尼美舒利NLC处方组成与制备工艺
2014-02-05杜广盛李德馨魏振平
杜广盛,李德馨,魏振平
(1.天津大学化工学院,天津300072;2.天津天士力集团化学药物研究所,天津300410)
纳米结构脂质载体(nanostructured lipid nanoparticles,NLC)是在固体脂质纳米粒 (solid lipid nanoparticles,SLN)基础上逐渐发展起来的第二代脂质纳米粒给药系统,它是以一定比例的液态油或混合脂质代替SLN中的固体脂质而制备出的新型固体脂质纳米粒[1-3]。
液态油脂能够明显的提高难溶药物在脂质中的溶解度,因此NLC可以有效的克服SLN中存在的固体脂质材料结晶度高、载药量低、贮存期间药物容易泄漏、水分散体系含水量过大等缺点[4]。NLC制备方法主要包括高压均质法、溶剂扩散法和微乳法等,其中高压均质法可以有效的避免使用有机溶剂,可处理脂质浓度较高,并且易于扩大生产规模[5]。
尼美舒利作为传统的消炎镇痛药,亲脂性强,适合作为制备脂质纳米粒的模型药物。本研究采用高压均质法,以粒径和包封率为指标,采用单因素设计考察了处方组成和工艺条件对纳米粒质量的影响。以包封率为指标,采用L9(34)正交设计表优化处方组成与制备工艺,确定了最适宜制备方案,并对所制备尼美舒利NLC制剂学性质进行了考察。
1 实验部分
1.1 实验仪器与材料
AB204-N万分之一电子天平(瑞士梅特勒-托利多集团);XW-80A微型旋涡混合仪(上海沪西分析仪器厂);EMS-30超级恒温水浴搅拌器(天津市欧诺仪器仪表有限公司);D-3L高压均质机(美国PhD科技有限公司);Anke TGL-20B离心机(上海安亭科学仪器厂);KQ3200B超声波清洗器(昆山市超声仪器有限公司);Agilent 1260液相色谱仪(安捷伦科技有限公司);S-4800 SEM扫描电镜(日本日立公司)。
尼美舒利(天津药物研究院);单硬脂酸甘油酯(glycerin monostearate,GMS,天津市光复精细化工研究所);油酸(湖南尔康制药有限公司);TPGS(陕西瑞源制药有限公司);透析袋(截留相对分子质量12 000~16 000,天津市联星生物技术有限公司);甲醇(分析纯,利安隆博华天津医药化学有限公司);乙腈(色谱纯,德国默克公司);磷酸(分析纯,天津市化学试剂三厂);氨水(分析纯,天津市化学试剂三厂)。
1.2 NLC制备
称量处方量 TPGS,置于锥形瓶中,加蒸馏水40 m L搅拌使其完全溶解,置于75℃恒温水浴磁力搅拌器中。在300 r/m in下磁力搅拌得到水相。
称取处方量尼美舒利、油酸和单硬脂酸甘油酯(GMS)置于锥形瓶中,置于75℃恒温水浴磁力搅拌器中,300 r/m in磁力搅拌得到油相。
在恒温水浴75℃,300 r/m in磁力搅拌下,将水相缓慢滴加到油相中。待水相完全加入后,保持恒温恒速搅拌15 min,得初乳。
将所得初乳在80 MPa压力下,通过高压均质机循环4次,得到纳米液。冷至室温,即得尼美舒利NLC水分散液。
1.3 单因素考察
1.3.1 油酸与GM S投料比的考察
固定脂质质量分数3%(辅料与水的质量比,下同),TPGS 1.2 g,药脂比1∶40,水40 m L。 按照1.2项下制备工艺,分别考察油酸与 GMS投料比为1∶10、2∶10、3∶10、4∶10 时 NLC的粒径和包封率。
1.3.2 脂质用量的考察
将油酸与 GMS投料比定为3∶10,其它处方条件同1.3.1项下。分别考察脂质用量为1%、2%、3%、6%、8%和10%时NLC的粒径及包封率。
1.3.3 乳化剂用量的考察
固定脂质用量为3%,其它条件同1.3.2项下,分别考察 TPGS用量为 0.4、0.8、1.2和 1.6 g时NLC粒径及药物包封率。
1.3.4 药脂比的考察
固定TPGS用量为1.2 g,其它处方与工艺条件同 1.3.3 项下,分别考察药脂比为 1∶120、1∶80、1∶40和1∶30时NLC粒径和包封率。
1.3.5 高压均质压力的选择
固定脂质用量3%,油酸与 GMS投料比为3∶10,药脂比为 1∶40,TPGS 用量为 1.2 g,高压均质机循环4次,分别考察均质压力为 40、60、80、100 MPa时NLC的粒径和包封率。
1.3.6 循环次数的考察
循环次数的考察:均质压力设为80 MPa,其它处方与工艺条件同1.3.5项下,分别考察循环次数为1、2、4和6时NLC的粒径和包封率。
1.4 正交设计优化处方与制备工艺
在单因素考察基础上,选择油酸与GMS投料比(A)、药脂比(B)、乳化剂用量(C)、高压均质压力(D)4个因素,每个因素选择3水平,按L9(34)正交试验设计表设计9组实验,以包封率为评价指标,筛选最适宜处方组成和制备工艺。
1.5 NLC理化性质考察
1.5.1 粒径与Zeta电位测定
采用马尔文纳米粒度仪测定纳米粒粒径与Zeta电位,测定温度设为25℃,检测角度设为90°。样品测前用蒸馏水适当稀释避免黏结,放入样品池中检测。每个样品测定3次取平均值。
1.5.2 NLC形态观察
采用扫描电镜观察尼美舒利NLC形态。测定前,用pH值为7.0 PBS适当稀释后放在铜片上自然晾干,对样品进行1 m in喷金处理,用扫描电镜进行观察。
1.5.3 包封率测定
采用离心法测定药物包封率。将制得的新鲜NLC在7 000 r/m in下离心15 m in后从上清液精密移取1 m L至10 m L容量瓶中,甲醇定容后超声10 min破乳。所得乳液在3 000 r/min下离心10 min。取上清液过滤后进样HPLC测定尼美舒利浓度。包封率(EE)计算公式为:
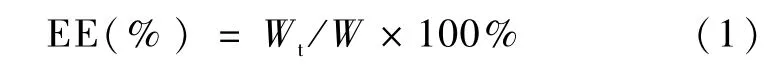
其中,Wt为上清液中药物量,W为药物投入量。
1.5.4 尼美舒利NLC体外释放
按照1.4项下确定的最适宜方案制备尼美舒利NLC,采用动态膜透析法测定 NLC的体外释放特性。精密移取1 m L尼美舒利NLC混悬液,置于透析袋中,将透析袋置于50 m L释放介质中(10%乙醇的pH 7.4 PBS)中。温度为37℃,转速为200 r/min,分别于 1、2、4、6、8、10、12、24、36、48 和 72 h 取出2 m L透析介质,用0.45μm微孔滤膜过滤后进液相检测浓度。同时补加同等体积的同温释放介质。另精密称取18.5 mg尼美舒利原料药,置于25 m L容量瓶中,用甲醇定容。采用同等方法测定体外释放情况作为对照。第n个点的累积释放率为:
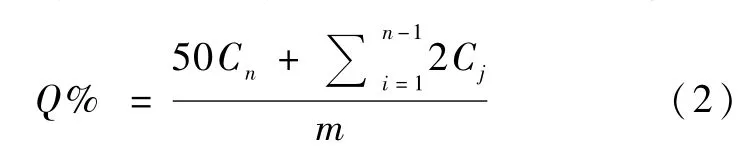
其中m为所加样品中药物质量,Cn为第n个点的药物浓度。
1.6 HPLC检测尼美舒利含量
尼美舒利含量采用反相液相色谱法进行测定。采用的色谱柱为Capcell PAK C18柱(250 mm×4.6 mm,5μm),柱温设为25℃;进样量为 20μL;流动相为0.1%H3PO4(氨水调节pH值为7.0)∶乙腈=60∶40,流速为 1.0 m L/min,检测波长设为230 nm。
2 结果与讨论
2.1 单因素考察
2.1.1 油酸与GM S投料比的选择
固液态脂质投料比对纳米粒质量的影响见表1。
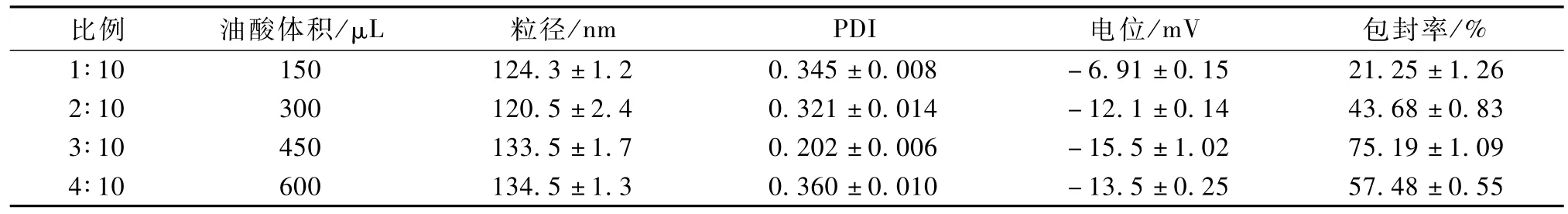
表1 油酸与GM S投料比的考察(n=3)Table 1 Study of feed ratio of oleic acid to GM S(n=3)
随着油酸用量的增加,尼美舒利NLC粒径没有明显的变化。这是因为在处方确定的情况下,NLC的粒径主要受熔融脂质的黏度影响。而油酸用量的变化对熔融脂质黏度影响不大,因此粒径变化较小[6]。
包封率随着油酸用量增大先升高后降低。这是因为油酸用量增大时提高了药物在混合脂质中的溶解度,使包封率提高。当油酸用量过大时,可能导致油酸较多的分散在纳米粒表层,使药物分散到水相的速度加快,导致包封率降低[7]。
2.1.2 脂质用量的考察
脂质用量对纳米粒质量的影响见表2。

表2 脂质用量的考察(n=3)Table 2 Study of am ount of lipid(n=3)
随着脂质用量的增加,粒径有增加的趋势,这与文献报道一致[8]。随着脂质用量增加,脂质对药物的溶解能力增强,使包封率升高。当脂质用量过大时,样品黏度增大,高压均质机处理效果下降。从而使得药物无法充分包裹进入脂质中,使包封率降低。
2.1.3 乳化剂用量的考察
TPGS用量对NLC粒径和包封率的影响见表3。
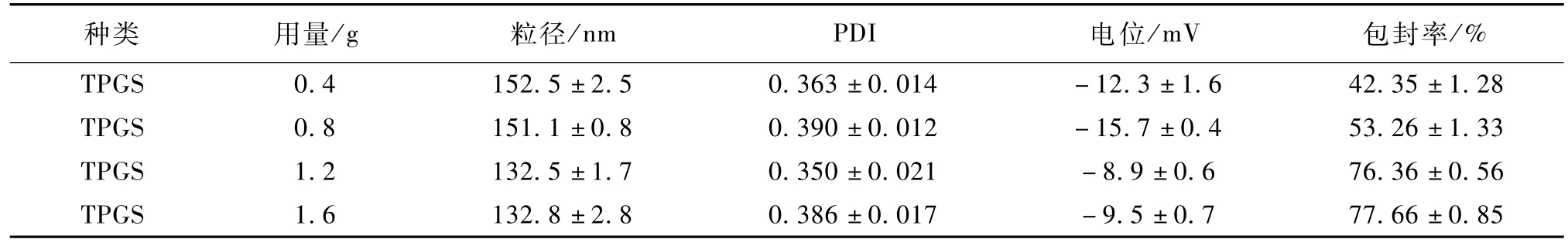
表3 TPGS用量对纳米粒粒径和包封率的影响(n=3)Table 3 In fluence of am ount of TPGS on par ticle size and entrapm en t efficiency of nanoparticles(n=3)
随着TPGS用量的增加,尼美舒利NLC粒径由152.5±2.5 nm降到 132.5±1.7 nm,包封率由42.35±1.28%升高到77.66±0.85%。TPGS覆盖到新产生的纳米粒子表面,可以降低表面张力,利于粒子的分离。因此TPGS用量增大时可以降低纳米粒粒径。但是用量过大时可能会在水相中形成胶束,增加尼美舒利的溶解度,导致包封率降低[9]。
2.1.4 药脂比的考察
药脂比对NLC粒径和包封率的影响见表4。
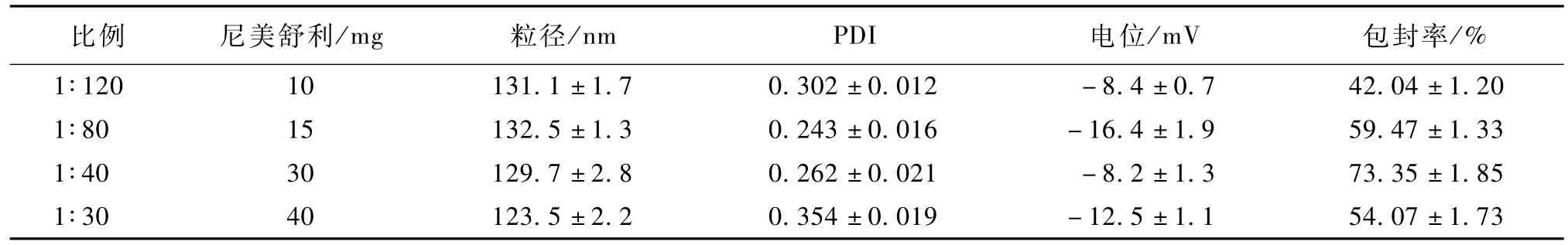
表4 药脂比考察(n=3)Table 4 Study of ratio of drug to lip id(n=3)
由表4可知,药物用量变化并没有对NLC粒径造成明显的影响。包封率随着药物用量的增加先升高后降低。这是因为药物用量较低时,溶解在水相中的药物所占比例较大,导致药物包封率较低。而当药物用量较高时,药物量超过了混合脂质的容纳能力,导致包封率较低。
载药量是评价一种剂型的重要指标。传统SLN受限于药物在固态脂质的溶解度较低而导致载药量较低。本研究中制备的新型NLC由于油酸对药物溶解度较高,能比较好的改善纳米粒的载药量。
2.1.5 高压均质压力的考察
均质压力对NLC粒径及包封率的影响见表5。
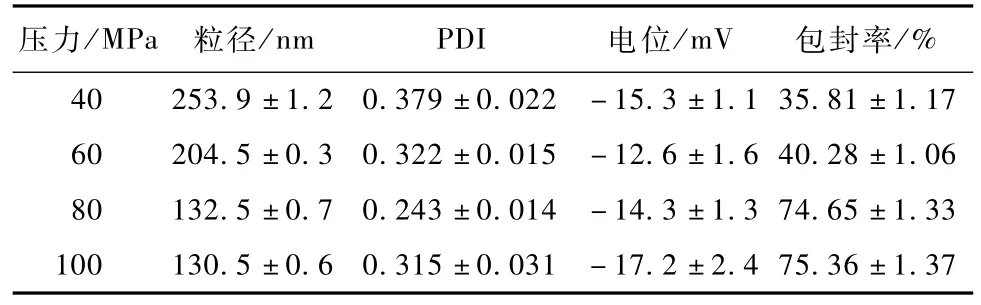
表5 均质压力对NLC粒径及包封率的影响(n=3)Table 5 In fluence of hom ogenization p ressure on particle size and en trapm ent efficiency of NLC(n=3)
随着压力的增大,粒径显著的降低,而包封率显著的升高。但是过高的均质压力并不能继续改善粒径与包封率。这可能是因为压力过高时,粒子动能过大,容易发生聚集而使粒径增大包封率降低[10]。另外,在实验中发现,均质压力超过 120 MPa时,会超出高压均质机的安全工作范围,产生漏液。因此,高压均质机的压力选择是综合考虑制备效果、安全性和经济性的综合结果。
2.1.6 循环次数的考察
均质循环次数对纳米粒粒径和包封率的影响见表6。
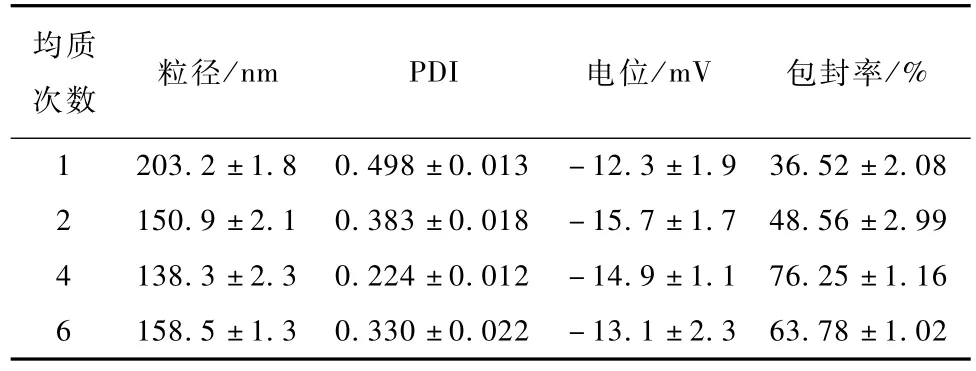
表6 高压均质次数对NLC粒径以及包封率的影响(n=3)Table 6 In fluence of cycle tim es on par ticle size and entrapm ent efficiency of NLC(n=3)
过高或过低的均质次数都会增加NLC的粒径或者降低包封率。这是因为均质次数过少时,样品没有得到充分的处理,并且包含微米级颗粒,导致粒径与包封率结果较差,粒径分布较宽。当增加均质次数时,样品被充分处理,粒径分布较窄。这与以前的文献报道相一致[11]。但是当均质次数过多时,与压力过高类似会导致纳米粒子动能较高,发生聚集,从而使粒径增大且包封率降低。
2.2 正交设计考察结果
2.2.1 因素水平的确定
在以上单因素考察的基础上,选定油酸和GSM投料比(A)、药脂比(B)、TPGS用量(C)和均质压力(D)为正交设计考察的因素。因素水平表见表7。
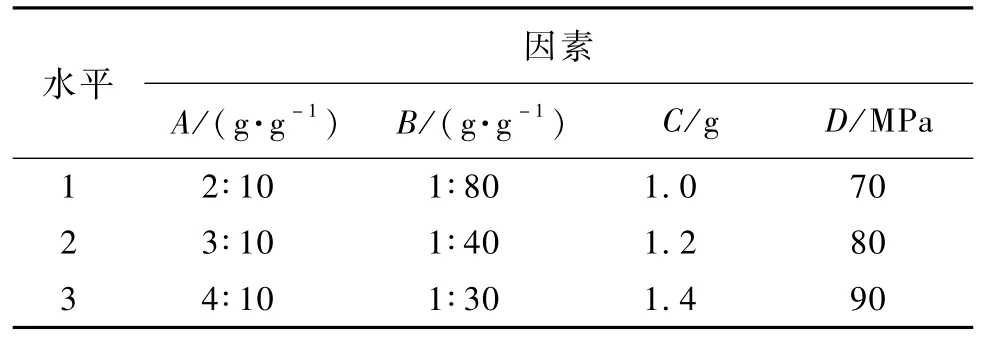
表7 因素水平表Table 7 Factors and levels
2.2.2 正交试验设计结果
采用L9(34)正交设计表安排9组实验,以包封率为评价指标,考察各因素对指标的影响,确定最优处方。其它处方与工艺条件为脂质用量为3%,水用量为40 mL,制备初乳温度为75℃,均质次数为4。实验结果见表8。
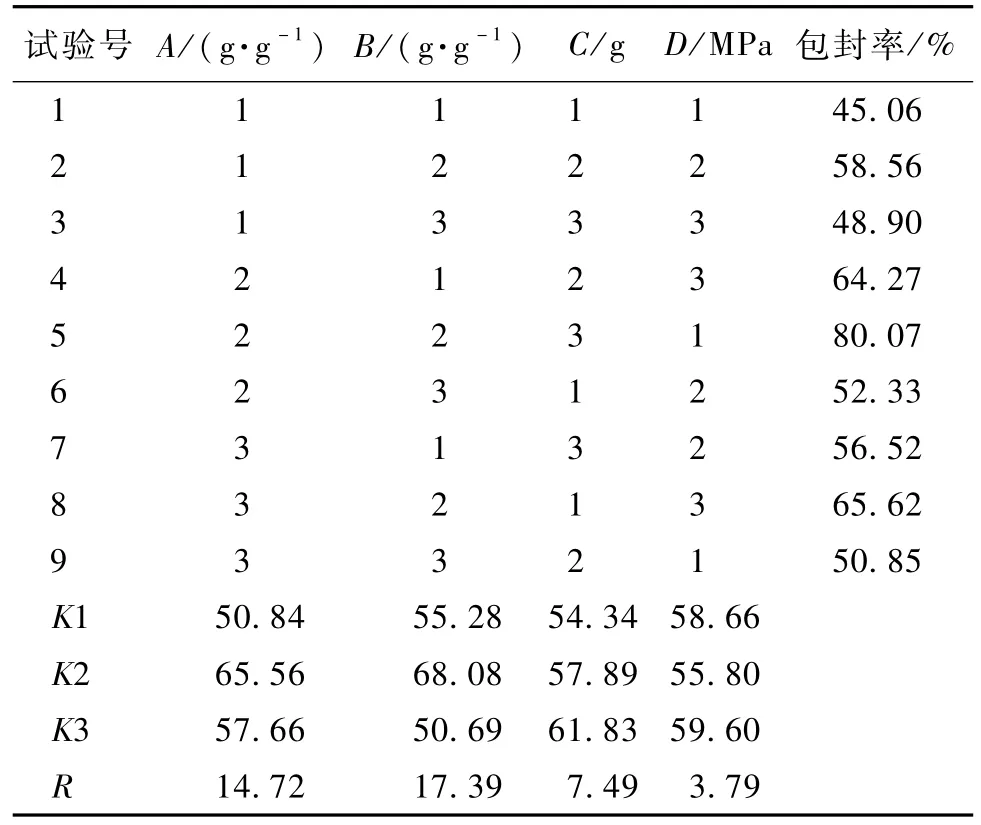
表8 正交设计实验结果Table 8 Resu lts of or thogonal design
在表8中,R表示极差,R越大表明各因素的影响越大。由R的结果可知各因素对纳米粒包封率的影响程度相对大小为B>A>C>D。另外,最优的因素水平组合为A2-B2-C3-D3,即油酸和 GSM投料比为 3∶10,药脂比为 1∶40,TPGS 用量为 1.4 g,均质压力为90 MPa。
2.2.3 实验验证
因为最适宜组合不在正交设计里的9组实验中,故需要做实验予以验证。即以A2-B2-C3-D3处方条件安排实验,测定NLC粒径和包封率。所得结果为粒径132.6±1.4 nm,包封率为82.35±1.23%。
2.3 Zeta电位测定
Zeta电位与纳米粒体系的稳定性密切相关。Zeta电位绝对值越大,表明体系稳定性越好。按照最适宜制备方案制备3批尼美舒利NLC,测得Zeta电位为-14.5±1.2 mV,表明所制备粒子表面荷负电,体系比较稳定。
2.4 形态学观察
按照最适宜处方制备尼美舒利NLC,用扫描电镜观察纳米粒形态,结果见图1。所制备纳米粒类球形,粒径比较均匀。
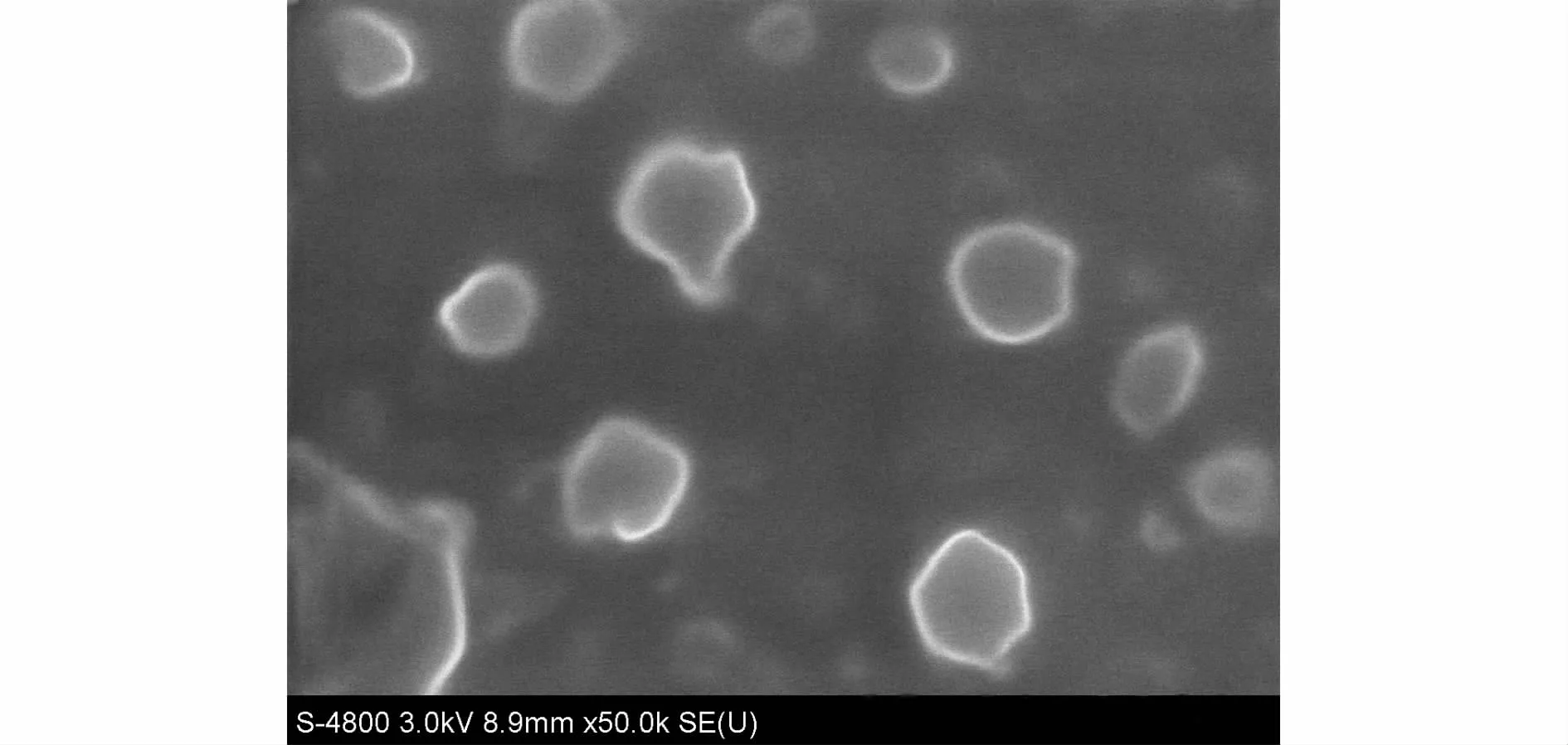
图1 扫描电镜结果Fig.1 Result of SEM
2.5 体外释放情况
释放试验所得结果见图2。
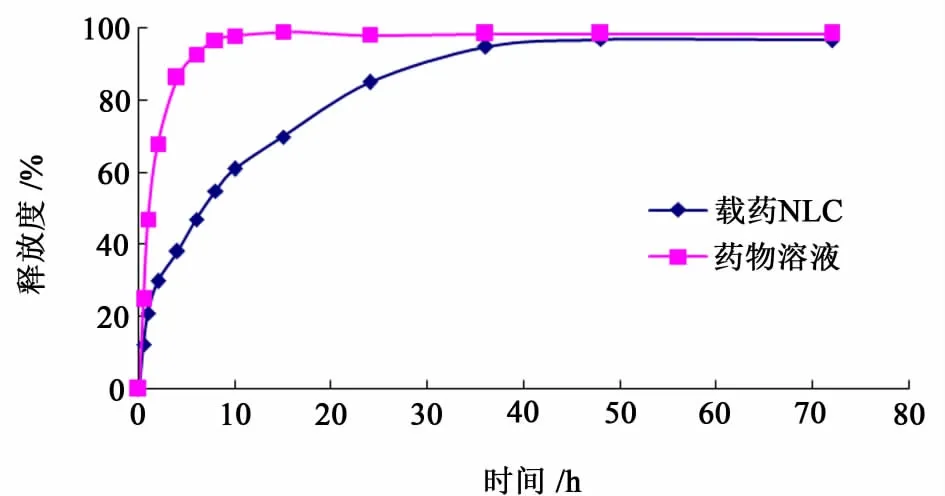
图2 体外释放实验Fig.2 Results of in vitro release
药物溶液在8 h内即已接近完全释放,而载药NLC在前10 h累积释放率为63.58%,随后缓慢释放,最终在72 h时释放达93.14%。由此推测,有部分药物分布在纳米球的表面,很快释放出来。而位于纳米球骨架内部的药物则通过扩散释放或者随着纳米球骨架溶蚀释放的方式缓慢的释放出来。
采用Higuchi模型拟合前24 h体外释放曲线,得拟合曲线Q=0.162 t1/2+0.049,r=0.991。表明体外释放行为较符合Higuchi模型,这与有关文献的报道较为一致[8]。
3 结论
本研究采用高压均质法制备了加载尼美舒利的纳米结构脂质载体,采用单因素和正交设计考察处方与工艺因素对纳米粒质量的影响。结果表明对包封率影响程度的相对大小为:药脂比>油酸与GMS投料比>TPGS用量>均质压力。确定的最适宜处方为油酸与 GMS投料比为3∶10,药脂比为1∶40,TPGS用量为 1.4 g,均质压力为90 MPa。 依据最适宜处方制备的纳米粒粒径为132.6±1.4 nm,包封率为82.35±1.23%。
所制备NLC呈类球形,粒径较为均匀。体外释放实验显示其具有先快速后缓慢释放的释药特性,体外释放曲线符合Higuchi模型。
[1]Müller R H,Shegokar R,Keck C M.20 years of lipid nanoparticles(SLN&NLC):Present state of development&industrial applications[J].Current Drug Discovery Technologies,2011,8:207-227
[2]Teeranachaideekul V,Muller R H,Junyaprasert V B.Encapsulation of ascorbyl palmitate in nanostructured lipid carriers(NLC):Effects of formulation parameters on physicochemical stability[J].International Journal of Pharmaceutics,2007,340:198-206
[3]Han F,Yin R,Che X,et al.Nanostructured lipid carriers(NLC)based topical gel of flurbiprofen:Design,characterization and in vivo evaluation[J].International Journal of Pharmaceutics,2012,439(1/2):349-357
[4]韩飞,刘洪卓,李三鸣.固体脂质纳米粒和纳米结构脂质载体在经皮给药系统中的研究进展[J].沈阳药科大学学报,2008,25(10):839-844 Han Fei,Liu Hongzhuo,Li Sanming.Recent advances of solid lipid nanoparticles and nano-structured lipid nanoparticles in transdermal drug delivery system[J].Journal of Shenyang Pharmaceutical University,2008,25(10):839-844(in Chinese)
[5]李智.超声法制备紫杉醇固体脂质纳米粒的研究[D].辽宁:沈阳药科大学,2008 Li Zhi.Study of paclitaxel-loaded solid lipid nanoparticles by ultrasonic method[D].Liaoning:Shenyang Pharmaceutical University,2008(in Chinese)
[6]Jores K,MehnertW,Drechsler M,et al.Investigations on the structure of solid lipid nanoparticles(SLN)and oil-loaded solid lipid nanoparticles by photo correlation spectroscopy,field-flow fractionation and transmission electron microscopy[J].Journal of Controlled Release,2004,95:217-227
[7]Hu F,Jiang S,Du Y,et al.Preparation and characterization of stearic acid nanostructured lipid carriers by solvent diffusion method in an aqueous system[J].Colloids and Surfaces B:Biointerfaces,2005,45:167-173
[8]Teeranachaideekul V,Souto E B,Junyaprasert V B,et al.Cetyl palmitate-based NLC for topical delivery of Coenzyme Q10-development,physicochem ical characterization and in vitro release studies[J].European Journal of Pharmaceutics and Biopharmaceutics,2007,67(1):141-148
[9]Mehnert W,Mader K.Solid lipid nanoparticles:Production,characterization and applications[J].Advanced Drug Delivery Reviews,2012,64:83-101
[10]Siekmann B,Westesen K.Melt-Homogenized solid lipid nanoparticles stabilized by the nonionic surfactant tyloxapol.I.Preparation and particle size determination[J].Pharmaceutical and Pharmacological Letters,1994,3:194-197
[11]Mei Z,Chen H,Weng T,et al.Solid lipid nanoparticles and microemulsion for topical delivery of triptolide[J].Eurupean Journal of Pharmaceutics and Biopharmaceutics,2003,56:189-196
[12]Teeranachaideekul V,Souto E B,Junyaprasert V B,et al.Cetyl palmitate-based NLC for topical delivery of Coenzyme Q10-Development,physicochemical characterization and in vitro release studies[J].European Journal of Pharmaceutics and Biopharmaceutics,2007,67(1):141-148
