microRNA-21调控TGF-β通路促进增生性瘢痕形成的机制研究
2014-02-05张奇王琛
张 奇 王 琛
microRNA-21调控TGF-β通路促进增生性瘢痕形成的机制研究
张 奇 王 琛
目的探讨microRNA-21在增生性瘢痕(Hypertrophic scars,HS)形成中的作用及机制,为生物学防治提供新靶点。方法收集临床患者正常皮肤及HS标本,组织学检测、组织胶原定量检测;免疫组化、Real-time PCR检测正常细胞外基质Col 1 A1、Col 3 A1、Fibronectin(FN)及α-SMA的表达;Real-time PCR检测microRNA-21 mRNA表达水平;培养HS成纤维细胞,构建microRNA-21反义表达载体,并加入TGF-β诱导,Real-time PCR检测Col 1 A1、Col 3 A1及microRNA-21的表达。结果HS中胶原的含量及细胞外基质表达明显高于正常皮肤;HS组织中microRNA-21表达高于正常皮肤组织;TGF-β可增强HS成纤维细胞中microRNA-21的表达,而瘢痕成纤维细胞转染microRNA-21反义表达载体后可明显降低瘢痕相关基因的表达。结论皮肤创伤愈合后局部microRNA-21表达升高,促进了细胞外基质的合成,而TGF-β进一步加强了microRNA-21对瘢痕形成的促进作用,可能是导致HS形成的重要原因。
增生性瘢痕细胞外基质转化生长因子小分子核糖核酸
增生性瘢痕(Hypertrophic scar,HS)是一种皮肤纤维增生性疾病,通常由热损伤或外伤伤及皮肤深层引起,主要病理特征是微血管的过度增生及胶原蛋白和其他细胞外基质的过度积聚和紊乱排列,一般经历增生期、稳定期、消退期三个阶段[1-3]。但具体发病机制目前仍不清楚,使增生性瘢痕的预防和治疗仍面临着诸多困难。目前虽有许多治疗方法,如压力治疗、注射类固醇激素、皮肤移植和手术切除等[4],但仍未对增生性瘢痕的治疗模式达成普遍共识[5]。
microRNA是一种长约19~22 nt的非编码RNA,属于短ncRNA家族[6],它结合到靶基因的3′非翻译区,从而抑制靶基因的翻译和/或诱导靶基因的mRNA降解[7]。microRNAs在许多重要的生物过程中发挥着重要作用,如细胞生长、增殖、分化,凋亡等[8-9]。最近,一些microRNAs被报道参与纤维化过程中的ECM代谢。在心衰、间质纤维化和心肌肥厚的成纤维细胞中,microRNA-21的表达选择性地增加[10],而microRNA-21的表达量失调可能与肺纤维化病变中的多个关键信号事件有关[7]。
作为纤维化疾病的一种新的治疗方法,基因干扰治疗已开始尝试应用,特别是反义链拮抗内源性高表达microRNA的使用[11]。研究证明,抑制microRNA-21的表达能够降低博莱霉素诱导的小鼠肺部间质纤维化的病变程度[7]。因此,microRNA在纤维化疾病中具有重要的作用,作为基因治疗的新靶点越来越多地引起了人们的注意。然而,在增生性瘢痕组织中,microRNA的调控机制和功能仍不太清楚。另外,TGF-β已被证实在胶原蛋白的生成和沉积中有着重要作用[12]。因此,明确在纤维化疾病的发病过程中特定的microRNA的作用(特别是TGF-β信号通路中),将有助于更清楚地了解增生性瘢痕的发病机制。本实验选择HS形成3~9个月为研究时段,从microRNA水平探索增生性瘢痕的基因治疗新方法。
1 材料与方法
1.1 标本的获取
实验标本均取自于2013年6月至2014年2月间,上海交通大学医学院附属第九人民医院整复外科病房手术的患者,共9例。年龄3~9岁,男女不限,均为胸腹部或四肢烫伤/烧伤后的增生性瘢痕,面积62.5~210.2 cm2,病程3~9个月,术前均未接受任何治疗。瘢痕符合POSAS的评估分类标准[13-14],并进一步确认为增生期瘢痕,POSAS评分42~52。
1.2 主要实验试剂
HG-DMEM、LG-DMEM(Gibco公司,美国);FBS(HyClone公司,美国);Ⅳ型胶原酶(Washington Biochemical公司,美国);TGF-β1(Sigma公司,美国);鼠抗兔Ⅱ型胶原单克隆抗体(Calbiochem公司,德国);TRIZOL液(Invitrogen公司,美国);TaKaRa RNA PCR Kit(Biotech公司,美国);羊抗兔二抗(武汉博士德生物工程有限公司);单克隆兔抗人α-SM-actin、单克隆兔抗人Fn、单克隆兔抗人COL 1 A1、单克隆兔抗人COL 3 A1(Abcam公司,美国)。
TE300型倒置相差显微镜、Y-FL型荧光显微镜(Nikon公司,日本)。
1.3 实验方法
1.3.1 组织胶原含量的测定
精确称取瘢痕组织湿重30~100 mg放入试管中,加入水解液约1 mL,混匀。放试管中加盖后95℃或者沸水浴中水解20 min;调节pH值至6.0~6.8左右;再加水至5 mL,最后取1 mL测定羟脯氨酸(Hyp)含量,按下式计算Hyp百分含量,再按Grant的方法计算胶原百分含量[15]。

1.3.2 HE染色
切片经梯度二甲苯溶液脱蜡,梯度乙醇溶液脱水;蒸馏水冲洗30 min;苏木精染色2 min;1%盐酸乙醇3~5 sec;水洗10~30 sec;0.5%伊红染色3~5 min;梯度乙醇脱水,二甲苯透明;中性树胶封固。
1.3.3 Masson染色
石蜡切片脱蜡至水,流水冲洗;苏木精染核2 min;盐酸乙醇分化,流水冲洗;丽春红酸性复红液染色5~10 min;2%冰醋酸溶液浸洗片刻;1%磷钼酸溶液分化3 min;直接用苯胺蓝或亮绿溶液染色5 min;0.2%冰醋酸浸洗片刻;梯度乙醇脱水、二甲苯透明,中性树胶封片。
1.3.4 免疫组化
石蜡切片放置在60℃恒温箱中烘烤120 min;脱蜡和水化:二甲苯20 min→二甲苯20 min→无水乙醇5 min×2次→95%乙醇5 min×2次→90%乙醇5 min→80%乙醇5 min;PBS洗2次,各5 min,蒸馏水冲洗1次5 min;加3%H2O2溶液孵育10 min(室温),PBS洗5 min;抗原修复:胰蛋白酶或胃蛋白酶溶液浸洗30 min(37℃);PBS洗3次,每次5 min;山羊血清封闭,室温孵育30 min,倾去,勿洗;滴加一抗,37℃孵育2~3 h,或4℃过夜;PBS冲洗3次,各5 min;加二抗,37℃孵育30 min;PBS洗3次,各5 min;DAB显色5~20 min,充分冲洗;苏木素复染2~3 min,充分水洗;盐酸乙醇分化2 sec,充分水洗;脱水、透明:80%乙醇(5 min)→95%乙醇(5 min)→95%乙醇(5 min)→100%乙醇(5 min)→100%乙醇(5 min)→二甲苯(10 min)→二甲苯(10 min);封片:中性树脂,加盖玻片(组织部位切勿残留小气泡),自然晾干。
1.3.5 皮肤和瘢痕成纤维细胞的分离、培养
切取的瘢痕及临近正常皮肤组织,于1 h内在超净工作台内进行细胞原代培养,以4×104cells/cm2的密度接种于直径100 mm的培养皿中,高糖培养液(GM:LG-DMEM,10%FBS,100 mg/mL链霉素,100 U/mL青霉素)、37℃、5%CO2、100%湿度条件下常规培养,24 h后第1次换夜,以后隔日换液1次,待细胞长成单层后消化传代。
1.3.6 Real-time PCR
从HS组织中提取RNA,并培养成纤维细胞,取体外培养的第1代成纤维细胞,提取RNA,进一步逆转录合成cDNA,用于定量PCR实验。正常皮肤组织及其成纤维细胞为对照组作相同处理,行各项纤维化指标及microRNA-21的验证。
1.3.7 转染实验
转染前1 d,接种适当数量的细胞至6孔培养板中,每孔加入2 mL含胎牛血清、不含抗生素的低糖DMEM培养液,使转染时的细胞密度能够达到30%~50%。继续培养箱中培养24 h。
每个样品按以下步骤准备mimic-lip2000混合液。①稀释microRNA mimic:用50 μL不含抗生素和胎牛血清的Opti-MEM,稀释1.25 μL(20 μmol)的microRNA mimic储存液,并轻轻混匀,室温孵育5 min;②稀释脂质体lip2000:用50 μL不含抗生素和胎牛血清的Opti-MEM稀释1 μL lip2000,轻轻混匀,室温孵育5 min;③将稀释microRNA mimic与稀释脂质体lip2000轻轻混匀,室温孵育20 min。
将microRNA mimic-lip2000混合液加入含有细胞的400 μL培养基中,轻轻摇晃混匀。4~6 h后,将孔中含microRNA mimic-lip2000混合液的培养液弃去,更换2 mL新鲜培养液。将培养板继续放入37℃、5%CO2培养箱中培养36 h后取样。
1.3.8 TGF-β诱导实验
选取适当数量的第1代成纤维细胞接种于六孔板中,24 h后换TGF-β诱导液(低糖无血清生长培养液,10 ng/mL TGF-β)进行培养,中间不换液。诱导48 h后,倾去培养液,以PBS清洗2遍,细胞取样,备用PCR实验。未诱导组作为阴性对照。
1.3.9 Real-time PCR
对于以上不同培养条件下培养的细胞进行定量PCR检测,观测纤维化相关蛋白Col 1 A1、Col 3 A1及microRNA-21的表达。
1.4 统计学分析
所有结果均采用x±s表示,采用SPSS 11.0统计软件(Student's t检验)进行统计学分析,当P<0.05时,认为差异具有统计学意义。
2 结果
2.1 组织胶原定量检测
在9对正常皮肤和瘢痕组织样本中,每对样品各选择4个独立的点进行检测,以排除样品自身变异性,最后取4个点的平均值绘图。结果显示,皮肤胶原蛋白的浓度范围为15.7~25.6 μg/mg(干重),增生性瘢痕胶原蛋白的浓度范围为48.9~78.5 μg/mg(干重)。增生性瘢痕组织中的胶原蛋白含量高于正常皮肤(图1)。
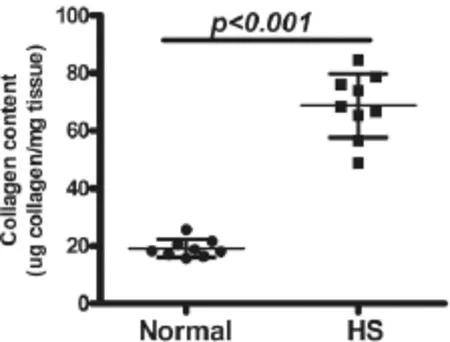
图1 各样品组织中的胶原蛋白含量检测Fig.1 Collagen content in each group(dry weight)
2.2 组织学观察和细胞外基质免疫组化检测
与正常皮肤组织相比,增生期瘢痕真皮层明显增厚,真皮乳头层、网状层界限不清,胶原纤维致密,胶原束排列紊乱,浅层则呈结节或漩涡状分布,其间细胞成分及微血管增多,细胞核分裂相多见。正常皮肤组可见大量的毛囊等皮肤附件,真皮乳头层和网状层界限较明显,胶原纤维排列疏松,细胞成分及血管数目相对较少(图2)。免疫组织化学染色显示,细胞外基质在增生性瘢痕中的表达明显高于正常皮肤(图3)。
2.3 细胞外基质及microRNA-21的Real-time PCR检测
Real-time PCR结果显示,在增生性瘢痕组织及其成纤维细胞中,Col 1 A1、Col 3 A1、Fn和α-SMA的表达量明显高于对照组,在增生性瘢痕组织及其成纤维细胞中microRNA-21的表达同样明显上调。重复实验三次结果均有意义(图4、5)。
2.4 TGF-β诱导及microRNA-21反义表达载体转染
第1代HS成纤维细胞表现为相对均一的成纤维样,呈梭形;当成纤维细胞在TGF-β诱导液中培养48 h后,细胞质颜色加深,逐渐聚集成团。定量PCR结果显示,第1代成纤维细胞经TGF-β诱导后,细胞表达microRNA-21的量明显增加(图6)。此外,瘢痕组织成纤维细胞经TGF-β诱导48 h后,再行microRNA-21反义表达载体转染7 h,然后换普通培养液继续培养36 h,取样,定量PCR检测,发现Col 1 A1和Col 3 A1的表达降低(图7)。以上结果表明,细胞增殖加快,合成、分泌细胞外基质能力增强。

图2 正常皮肤及增生性瘢痕的组织学观察Fig.2 Histological observation in each group by HE staining and Masson's trichrome staining

图3 免疫组化染色检测Col 1 A1、Col 3 A1、Fn和α-SMA在正常皮肤和增生性瘢痕组织中的表达Fig.3 The expression of Col1A1,Col3A1,Fn and α-SMA in each group by immunohistochemistry

图4 Col 1 A1、Col 3 A1、Fn及α-SMA mRNA在增生性瘢痕和正常皮肤组织(A-D)和细胞(E-H)中的表达(***:P<0.001;**:P<0.01)Fig.4 The expression of Col1A1,Col3A1,Fn and α-SMA mRNA in tissue(A-D)and fibroblasts(E-H)of each group(***:P<0.001;**:P<0.01)
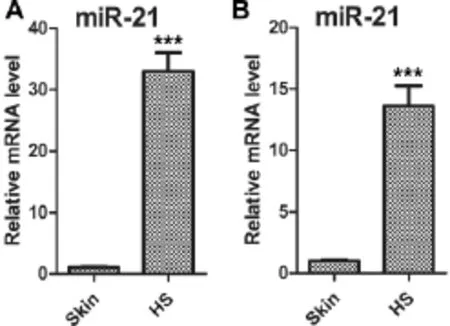
图5 microRNA-21 mRNA在增生性瘢痕和正常皮肤组织(A)和细胞(B)中的表达(***:P<0.001)Fig.5 The expression of microRNA-21 mRNA in tissue(A)and fibroblasts(B)of each group(***:P<0.001)

图6 TGF-β诱导后microRNA-21的表达(***:P<0.001)Fig.6 The expression of microRNA-21 after TGF-β induction(***:P<0.001)

图7 TGF-β诱导后microRNA-21反义表达载体转染,成纤维细胞中Col 1 A1(左)、Col 3 A1(右)的表达(**:P<0.01)Fig.7 The expression of Col 1 A1(L)and Col 3 A1 (R)after inhibitor-microRNA-21 transfection and TGF-β induction(**:P<0.01)
3 讨论
组织内胶原合成与降解的正常稳态被打乱,导致以胶原蛋白为主的细胞外基质过度合成并沉积,从而形成增生性瘢痕。本研究中我们发现,增生性瘢痕组织中的细胞外基质如Col 1 A1、Col 3 A1、Fn和α-SMA的表达水平明显高于正常皮肤,符合以前的研究结果[16-17]。
microRNA被证明在不同的生理和病理过程中发挥着功能性作用,包括细胞内的信号转导通路和器官的形态发生[18]。不同的microRNA的表达失调往往会造成不同的疾病。在这些变化的microRNA中,有许多microRNA被预测作为众多基因的抑制剂参与自身免疫、血管硬化等疾病的过程中,只有很少一部分被证明参与了肝脏纤维化的疾病过程中[19-21]。最近一些报道显示,microRNA参与纤维化疾病细胞外基质的代谢过程,并且microRNA的失调在瘢痕疙瘩的形成和发展中有着重要的作用[22]。在博莱霉素诱导的肺纤维化中,一些microRNA的表达有显著改变,以microRNA-21的增高表达最为明显。在我们的实验研究中也证实了增生性瘢痕组织中microRNA-21的表达量高于正常皮肤组织,这可能与肌成纤维细胞在增生性瘢痕中促进microRNA-21的表达,而microRNA-21也促进成纤维细胞的聚集有关[23]。
TGF-β是一种重要的细胞因子,调节细胞不同的生理过程,如细胞增殖、分化、凋亡、黏附、迁移。为了保持细胞或/或器官内稳态平衡,TGF-β信号通路在不同水平有着精确的调控作用。TGF-β信号通路功能障碍或失调,与很多疾病相关,如纤维化疾病、炎性疾病和肿瘤的发生等[24]。异常的microRNA表达与很多病理生理过程的发生和发展密切相关,一些microRNA参与许多器官的纤维化过程,包括心脏、肾脏、肝脏和肺等[25]。因此,明确特定的microRNA在纤维化疾病发病机制中的作用(特别是在TGF-β信号通路中),有助于更清楚理解HS的发病机制,从中探索一些诊断、治疗和预防HS的新方法。我们进一步用TGF-β诱导成纤维细胞,导致microRNA-21表达显著增加,成纤维细胞合成并分泌Col 1 A1、Col 3 A1的水平在TGF-β诱导后也显著增加。
虽然我们的研究结果表明microRNA-21在调控增生性瘢痕纤维化过程中发挥了重要作用,但是尚不明确microRNA水平和靶蛋白mRNA表达之间直接的一对一调节关系。为了进一步确认microRNA的功能改变是否对靶基因mRNA的表达水平有直接调节作用,在成纤维细胞中进行microRNA-21的沉默表达实验是有必要的。
[1]Zhu Z,Ding J,Shankowsky HA,et al.The molecular mechanism of hypertrophic scar[J].J Cell Commun Signal,2013,7(4):239-252.
[2]苏永涛.增生性瘢痕胶原含量与微血管构筑的相关性[J].中国临床康复,2002,6(22):28-32.
[3]Niessen FB,Spauwen PH,Schalkwijk J,et al.On the nature of hypertrophic scars and keloids:a review[J].Plast Reconstr Surg, 1999,104(5):1435-1458.
[4]Ray S,Ju X,Sun H,et al.The IL-6 trans-signaling-STAT3 pathway mediates ECM and cellular proliferation in fibroblasts from hypertrophic scar[J].J Invest Dermatol,2013,133(5):1212-1220.
[5]Wu JG,Ma L,Zhang SY,et al.Essential oil from rhizomes of Ligusticum chuanxiong induces apoptosis in hypertrophic scar fibroblasts[J].Pharm Biol,2011,49(1):86-93.
[6]Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[7]Liu G,Friggeri A,Yang Y,et al.microRNA-21 mediates fibrogenic activation of pulmonary fibroblasts and lung fibrosis[J].J Exp Med,2010,207(8):1589-1597.
[8]Esquela-Kerscher A,Slack FJ.Oncomirs-microRNAs with a role in cancer[J].Nat Rev Cancer,2006,6(4):259-269.
[9]Lu M,Zhang Q,Deng M,et al.An analysis of human microRNA and disease associations[J].PLoS One,2008,3(10):e3420.
[10]Thum T,Gross C,Fiedler J,et al.MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts[J].Nature,2008,456(7224):980-984.
[11]Brown BD,Naldini L.Exploiting and antagonizing microRNA regulation for therapeutic and experimental applications[J].Nat Rev Genet,2009,10(8):578-585.
[12]Zheng Z,Lee KS,Zhang X,et al.Fibromodulin-deficiency alters temporospatial expression patterns of transforming growth factorbeta ligands and receptors during adult mouse skin wound healing [J].PLoS One,2014,9(6):e90817.
[13]Hoogewerf CJ,van Baar ME,Middelkoop E,et al.Patient reported facial scar assessment:directions for the professional[J].Burns, 2014,40(2):347-353.
[14]van de Kar AL,Corion LU,Smeulders MJ,et al.Reliable and feasible evaluation of linear scars by the Patient and Observer Scar Assessment Scale[J].Plast Reconstr Surg,2005,116(2):514-522.
[15]Grant RA.Estimation of hydroxyproline by the autoanalyser[J].J Clin Pathol,1964,17:685-686.
[16]Wick G,Grundtman C,Mayerl C,et al.The immunology of fibrosis [J].Annu Rev Immunol,2013,31:107-135.
[17]Yang DY,Li SR,Wu JL,et al.Establishment of a hypertrophic scar model by transplanting full-thickness human skin grafts onto the backs of nude mice[J].Plast Reconstr Surg,2007,119(1):104-109.
[18]Stefani G,Slack FJ.Small non-coding RNAs in animal development [J].Nat Rev Mol Cell Biol,2008,9(3):219-230.
[19]Lodish HF,Zhou B,Liu G,et al.Micromanagement of the immune system by microRNAs[J].Nat Rev Immunol,2008,8(2):120-130.
[20]Baltimore D,Boldin MP,O'Connell RM,et al.MicroRNAs:new regulators of immune cell development and function[J].Nat Immunol,2008,9(8):839-845.
[21]Vavuranakis M,Kariori M,Vrachatis D,et al.MicroRNAs in aortic disease[J].Curr Top Med Chem,2013,13(13):1559-1572.
[22]Chau BN,Brenner DA.What goes up must come down:the emerging role of microRNA in fibrosis[J].Hepatology,2011,53(1): 4-6.
[23]Davis BN,Hilyard AC,Lagna G,et al.SMAD proteins control DROSHA-mediated microRNA maturation[J].Nature,2008,454 (7200):56-61.
[24]Yan X,Liu Z,Chen Y.Regulation of TGF-beta signaling by Smad7[J].Acta Biochim Biophys Sin(Shanghai),2009,41(4):263-272.
[25]Bushati N,Cohen SM.microRNA functions[J].Annu Rev Cell Dev Biol,2007,23:175-205.
Effect and Mechanism of TGF-β Mediated Signal Pathway Modulated by microRNA-21 in Hypertrophic Scars
ZHANG Qi1,WANG Chen2.
1 Department of Orthopaedics,People's Hospital of Dancheng County,Zhoukou 477150,China; 2 Department of Plastic and Reconstructive Surgery,Shanghai 9th People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:Chen Wang(E-mail:wangchen2369@163.com).
ObjectiveTo evaluate the effect and mechanism of microRNA-21 in hypertrophic scars(HS)formation and to provide novel target in biological control of HS.MethodsNormal skin tissue and HS tissue were harvested.Collagen quantitative detection and histological observation were carried out.The expression of collagen 1A1(Col1A1),collagen 3A1 (Col3A1),Fibronectin(FN)and α-SMA were detected by quantitative real-time PCR.The expression of microRNA-21 mRNA in normal skin tissue and HS tissue were also detected.Cells isolated from normal skin tissues and HS tissues were cultured,the microRNA-21 antisense RNA interference vector were constructed,while TGF-β was added at the same time. Furthermore,the effects of inhibitor-microRNA-21 and TGF-β on the biological characteristics of fibroblasts were observed. ResultsThe content of collagen in hypertrophic scar was higher than that in normal skin.The expression of extracellular matrix such as Col1A1,Col3A1,FN and α-SMA in scar tissue were significantly increased.The expression of microRNA-21 in HS tissue was higher than in normal tissue.TGF-β enhanced the expression of microRNA-21 in fibroblasts of HS tissues, while the inhibition of microRNA-21 decreased the expression of those scar-related genes.ConclusionThe skin after wound healing could increase the expression of microRNA-21 which promotes the synthesis of extracellular matrix,and TGF-β may further strengthen the role of microRNA-21 in the formation of HS.
Hypertrophic scar;Extracellular matrix;Transforming growth factor-β(TGF-β);microRNA
R619+.6
A
1673-0364(2014)06-0318-06
2014年8月30日;
2014年10月19日)
10.3969/j.issn.1673-0364.2014.06.005
国家自然科学基金(81201204);上海高校选拔培养优秀青年教师科研专项基金(ZZjdyx12100)。
477150河南省周口市郸城县人民医院骨科(张奇);200011上海市上海交通大学医学院附属第九人民医院整复外科(王琛)。
王琛(E-mail:wangchen2369@163.com)。
