应激剂量糖皮质激素对脑损伤致颅内出血患者的治疗作用
2014-01-19陈小枫叶纪录戴佳文朱志云濮雪华缪小莉
陈小枫 叶纪录 戴佳文 朱志云 濮雪华 缪小莉


DOI:10.3760/cma.j.issn.1671-0282.2014.12.005
基金项目:江苏省泰州市社会发展项目(TS201236)
作者单位:225300江苏省泰州,南通大学医学院附属泰州市人民医院重症医学科(陈小枫、叶纪录、朱志云、濮雪华、缪小莉) ,急诊科(戴佳文)
通信作者:戴佳文,Email:daijiawenyisheng@163.com
目前脑损伤致颅内出血约占住院患者的13%,但病死率却高达58%<sup>[1]</sup>。近年来随着对颅脑损伤发病机制的深入研究,细胞因子在颅脑损伤中的作用日益成为目前的研究热点。炎性细胞因子在脑外伤出血后明显升高,并于48~72 h达高峰<sup>[2-4]</sup>,参与脑组织的继发性损害,介导局部炎症反应,加重局部损害,并参与全身炎性反应综合征,是导致病情加重预后不良的一类损害性因子<sup>[5-8]</sup>。目前发现炎性细胞因子白细胞介素-1β(IL-1β),肿瘤坏死因子(TNF-α)在颅脑损伤颅内出血的炎性反应中起核心作用,进一步决定病情的严重程度<sup>[9-10]</sup>。然而,超大剂量激素对颅内出血患者的治疗并没有取得预期的效果,甚至导致病死率增加,主要原因是感染和消化道出血等<sup>[11-12]</sup>。本研究中使用应激剂量糖皮质激素治疗颅内出血患者,观察治疗效果及并发症发生情况。
1资料与方法
1.1一般资料
泰州市人民医院2011年2月至2013年2月脑损伤致颅内出血患者159例,其中男113例,女46例,入选标准:(1)年龄16~76岁;(2)伤后6 h内入院,GCS≤12分;(3)CT头颅平扫确诊为脑挫裂伤、蛛网膜下腔出血、脑内血肿和/或硬膜下血肿患者。单纯硬膜外血肿患者除外。(4)伤前重要脏器无明显器质性病变;(5)存活时间≥10 d;排除标准:(1)未按疗程完成治疗者;(2)患者家属中途放弃者;(3)其他部位存在严重创伤者;(4)既往有HIV感染及免疫抑制(因为器官移植或系统性疾病)的患者,既往有糖尿病,泌尿系感染,免疫系统病史。采用随机数字表分组,随机(随机数字法)分为糖皮质激素组(n=81)和对照组(n=78)。研究方案经医院伦理委员会批准,所有患者均签署知情同意书。
1.2治疗方法
对照组是常规治疗组,应激剂量糖皮质激素组在常规治疗基础上入院时即加用氢化可的松琥珀酸钠(通用名:注射用氢化可的松琥珀酸钠,50 mg/支,天津市生物化学制药有限公司)每次3 mg/kg,静脉滴注,每日两次,共使用3 d。两组患者常规使用制酸药物(入院前3 d)、预防感染、营养脑神经治疗,其余治疗均按照重型颅脑损伤诊治指南推荐意见给予治疗<sup>[13]</sup>。
1.3检测指标
分别于入院时及入院第4天检测患者TNF-α、IL-1β、C反应蛋白(CRP)、补体C3、补体C4,统计糖代谢紊乱、各种感染、应激性溃疡出血等并发症的发生情况,以及机械通气时间、住ICU天数、住院病死率。采用双抗体夹心ELISA法检测TNF-α、IL-1β。采用Olympus AU2700型全自动生化仪行免疫比浊法测定患者血清补体C3、C4含量,试剂为上海科华生物工程股份有限公司生产。
1.4统计学方法
数值以均数±标准差(x±s)表示,计量资料采用两独立样本的t检验, 计数资料采用χ2 检验,使用SPSS 19.0进行统计分析。以P<0.05为差异具有统计学意义。
2结果
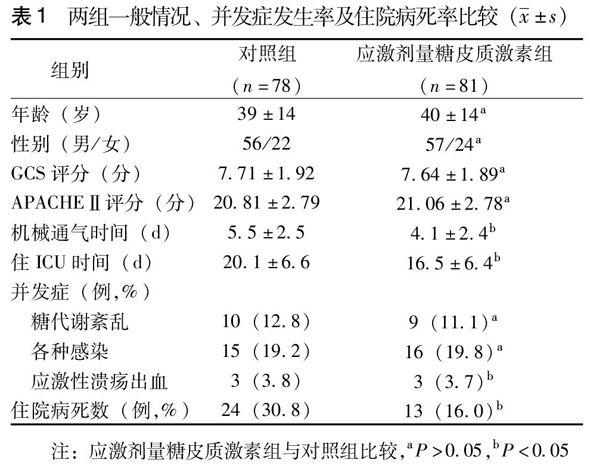
两组患者的年龄、性别、入院时GCS评分、APACHEⅡ评分上具有可比性(P>0.05)。与对照组比较,应激剂量糖皮质激素组糖代谢紊乱(为使血糖低于10.0 mmol/L,任何一个24 h内需胰岛素干预次数大于2次),各种感染、应激性溃疡出血等并发症发生率差异无统计学意义(P>0.05);与对照组比较,应激剂量糖皮质激素组机械通气时间、住ICU天数、住院病死率偏低,差异具有统计学意义(P<0.05),见表1。
与对照组比较,应激剂量糖皮质激素组GCS3-5分患者病死率下降,差异无统计学意义 (P>0.05);与对照组比较,应激剂量糖皮质激素组GCS6~12分患者病死率明显下降,差异具有统计学意义(P<0.01),见表2。
与对照组比较,入院时两组患者TNF-α、IL-1β、CRP、补体C3、补体C4差异无统计学意义(P>0.05);与对照组比较,第4天时应激剂量糖皮质激素组TNF-α、IL-1β、CRP、补体C3、补体C4明显下降,差异具有统计学意义(P<0.01),见表3。
3讨论
颅内出血患者病死率及致残率很高,随着对颅脑损伤发病机制的深入研究,炎症反应及细胞因子在颅脑损伤中的作用日益成为目前的研究热点<sup>[14-15]</sup>。糖皮质激素可稳定血-脑脊液屏障、改善局部脑组织微循环、稳定溶酶体膜、抑制内源性神经内啡肽的释放、减缓炎症反应等<sup>[16-21]</sup>。但存在糖代谢紊乱、各种感染、应激性溃疡出血等副作用,尤以使用大剂量糖皮质激素明显<sup>[11]</sup>。本研究中使用应激剂量激素来治疗脑损伤致颅内出血患者,观察治疗效果及并发症发生情况。
大剂量甲基强的松龙治疗10 008急性颅脑创伤患者多中心临床试验<sup>[11]</sup>,病死率达到了21.1%,感染、出血并发症增加,激素甲基强的松龙使用剂量达到了48 h内21.2 g;而本研究中应激剂量糖皮质激素组氢化可的松琥珀酸钠用量为72 h内18 mg/kg,按照激素的等效比例甲基强的松龙/氢化可的松为1∶5,假定体质量65 kg,则本研究中使用氢化可的松琥珀酸钠剂量为1170 mg,仅相当于甲基强的松龙0.234 g,明显偏低。本研究发现与对照组比较,应激剂量糖皮质激素组糖代谢紊乱,各种感染和应激性溃疡出血等激素使用相关并发症发生率差异无统计学意义(P>0.05),可能与本实验中糖皮质激素使用剂量较小有关,这与Roquilly等<sup>[21]</sup>研究基本一致。与对照组比较,应激剂量糖皮质激素组机械通气时间、住ICU天数、住院病死率偏低,差异具有统计学意义(P<0.05),以GCS6~12分患者住院病死率下降明显(P<0.01),而GCS3~5分患者住院病死率稍偏低,但差异无统计学意义(P>0.05),可能与病例数较少及该部分患者本身预后都较差等有关;与对照组比较,应激剂量糖皮质激素组第4天时TNF-α、IL-1β、CRP、补体C3、补体C4均明显下降,差异有统计学意义(P<0.01),提示糖皮质激素可能通过影响细胞因子,来保护脑细胞,进一步影响预后。考虑这与下列机制有关:①炎性细胞因子白细胞介素-1β(IL-1β),肿瘤坏死因子(TNF-α)在颅脑损伤颅内出血的炎性反应中起核心作用,进一步决定病情的严重程度<sup>[9-10]</sup>。②脑卒中患者血清中的补体和患者病情及预后都具有密切关系<sup>[22-23]</sup>,补体抑制剂能明显改善神经功能<sup>[24-25]</sup>。③颅脑损伤后CRP升高的幅度和持续时间可敏感地反映颅脑损伤的严重程度<sup>[26]</sup>。④部分脑损伤患者存在肾上腺皮质功能不全<sup>[27]</sup>,糖皮质激素的使用正好在急性期起了替代作用。
参考文献
[1]Jonathan W, Graham M. Management of severe head injury[J]. Cont Neur,1996, 18(17):1-5.
[2]Xue M, Del Bigio MR. Intracortical hemorrhage injury in rats : relationship between blood fractions and brain cell death[J].Stroke, 2000,31(7):1721-1727.
[3]Xue M, Del Bigio MR. Intracerebral injection of autologous whole blood in rats: time course of inflammation and cell death[J].Neurosci Lett, 2000, 283(3):230-232.
[4]郭富强,李晓佳,陈隆益,等. 脑出血患者血肿周围组织炎性反应与细胞凋亡的相关性研究[J]. 中国危重病急救医学,2006, 18(5):290-293.
[5]Holmin S, Mathiesen T. Intracerebral administration of interleukin-1 beta and induction of inflammation, apoptosis, and vasogenic edema[J]. Neurosurg,2000,92(1):108-120.
[6]Dietrich WD, Chatzipanteli K, Vitarbo E, et al. The role of inflammatory processes in the pathophysiology and treatment of brain and spinal cord trauma[J]. Acta Neurochir Suppl,2004,89(1):69-74.
[7]邱炳辉,方陆雄,漆松涛,等.急性颅脑损伤并全身炎症反应综合征的预后分析[J].中华急诊医学杂志,2007,16(2): 147-150.
[8]濮雪华,吴兵兵,朱志云,等.重型颅脑损伤高迁移率蛋白B1的临床意义[J].中华急诊医学杂志,2013,22(12):1342-1345.
[9]Blais V, Rivest S. Effects of TNF-alpha and IFN-gamma on nitric oxide-induced neurotoxicity in the mouse brain[J]. J Immunol, 2004 ,172(11):7043-7052.
[10]Stoll G, Jander S, Schroeter M. Inflammation and glial responses in ischemic brain lesions[J]. Prog Neurobiol,1998,56(2):149-171.
[11]Roberts I, Yates D, Sandercock P, et al.Effect of intravenous corticosteroids on death within 14 days in 10 008 adults with clinically significant head injury (MRC CRASH trial): randomised placebo-controlled trial[J]. Lancet,2004,364(9442):1321-1328.
[12]江基堯.客观分析颅脑创伤患者国际多中心循证医学研究结论[J]. 中华创伤杂志,2009, 25(8): 673-674.
[13]Brain Trauma Foundation; American Association of Neurological Surgeons; Congress of Neurological Surgeons. Guidelines for the management of severe traumatic brain injury[J]. J Neurotrauma, 2007,24 Suppl 1:S1-106.
[14]Menon DK. Cerebral protection in severe brain injury:physiological determinants of outcome and their optimisation[J]. Br Med Bull,1999,55(1):226-258.
[15]Morganti-Kossmann MC, Rancan M, Stahel PF, et al. Inflammatory response in acute traumatic brain injury: a double-edged sword[J]. Curr Opin Crit Care,2002,8(2):101-105.
[16]Webster JI, Tonelli L, Sternberg EM. Neuroendocrine regulation of immunity[J]. Annu Rev Immunol, 2002, 20(2):125-163.
[17]Keh D, Boehnke T, Weber-Cartens S, et al. Immunologic and hemodynamic effects of “low-dose” hydrocortisone in septic shock: a double-blind, randomized, placebo-controlled, crossover study[J]. Am J Respir Crit Care Med,2003,167(4):512-520.
[18]KaufmannI L, Briegel J, Schliephake F, et al. Stress doses of hydrocortisone in septic shock: beneficial effects on opsonization-dependent neutrophil functions[J]. Intensive Care Med,2008,34(2):344-349.
[19]Rhen T, Cidlowski JA. Antiinfl ammatory action of glucocorticoids-new mechanisms for old drugs[J]. N Engl J Med,2005, 353(16):1711-1723.
[20]Confalonieri M, Urbino R, Potena A, et al. Hydrocortisone infusion for severe community-acquired pneumonia: a preliminary randomized study[J]. Am J Respir Crit Care Med,2005, 171(3):242-248.
[21]Roquilly A, Mahe PJ, Seguin P,et al. Hydrocortisone therapy for patients with multiple trauma: the randomized controlled HYPOLYTE study[J]. JAMA,2011,305(12):1201-1209.
[22]Atkinson C, Zhu H, Qiao F, et al. Complement-dependent P-selectin expression and injury following ischemic stroke[J]. J Immunol, 2006,177(10):7266-7274.
[23]Ten VS, Sosunov SA, Mazer SP, et al. C1q-deficiency is neuroprotective against hypoxic-ischemic brain injury in neonatal mice[J]. Stroke,2005,36(10):2244-2250.
[24]Leinhase I, Schmidt OI, Thurman JM,et al. Pharmacological complement inhibition at the C3 convertase level promotes neuronal survival, neuroprotective intracerebral gene expression, and neurological outcome after traumatic brain injury[J]. Exp Neurol,2006,199(2):454-464.
[25]Leinhase I, Rozanski M, Harhausen D,et al. Inhibition of the alternative complement activation pathway in traumatic brain injury by a monoclonal anti-factor B antibody: a randomized placebo-controlled study in mice[J]. Neuroinflammation,2007,4(1):13.
[26]Kalabalikis P, Papazoglou K, Gouriotis D, et al. Correlation between serum IL-6 and CRP levels and severity of head injury in children[J]. Intensive Care Med,1999,25(3):288-292.
[27]施小燕,李珉. 再談颅脑创伤与肾上腺皮质功能[J].中华急诊医学杂志,2013,22(12):1317-1320.
(收稿日期:2014-07-14)
(本文编辑:何小军)
p1319-1321
