叔戊基蒽醌法双氧水生产过程中部分降解产物的合成
2014-01-14李美美赵温涛
李美美,齐 欣,赵温涛
(天津大学理学院,天津300072)
常见双氧水的生产方法有电解法、蒽醌法、氧阴极还原法、氢氧直接合成法、异丙醇法和甲基苄基醇(MBA)氧化法等[1-4]。其中蒽醌法因能耗低、成本低、适合工业化生产等优点而被广泛采用[5]。蒽醌法生产双氧水常用的催化剂是烷基蒽醌,我国使用最多的是2-乙基蒽醌[6]。由于2-叔戊基蒽醌在生产双氧水的工作液中溶解度较大、催化效能高,以其作为催化剂代替2-乙基蒽醌可以明显提高双氧水的收率,因此,越来越引起研究者的关注。随着双氧水产量的逐年提高,2-叔戊基蒽醌的需求量也显著增加[7]。
蒽醌作为工作液生成双氧水经历3个过程:氢化、自氧化和萃取[8-10]。在循环生产过程中,蒽醌和四氢蒽醌被氢化或氧化产生的不能生成双氧水的物质,称为无效蒽醌或降解产物。2-叔戊基蒽醌工作液降解产物主要以氢化降解产物为主,氧化降解产物主要是环氧化合物[11-12]。2-叔戊基蒽醌工作液主要的降解过程如图1所示。
由图1可知,2-叔戊基蒽醌(AAQ,3a)芳环的氢化主要是指蒽氢醌(AAQH2)或四氢蒽氢醌(H4AAQH2)的氢化,虽然深度氢化产物H6AAQH2、H8AAQH2等经氧化也能生成H2O2,但其反应速度非常缓慢,一般被视为降解产物。悬浮反应器中以Pd/SiO2为催化剂,当催化剂量较高时,2-叔戊基蒽醌会发生羰基键的氢解。其降解产物主要有2-叔戊基-9-蒽酮(5b)、2-叔戊基-10-蒽酮、2-叔戊基蒽(5a)。当工作液中四氢蒽氢醌的含量较高时[13-15],蒽醌氧化产物主要是2-叔戊基四氢蒽醌环氧化物(6a)。

图1 2-叔戊基蒽醌工作液主要的降解过程Fig.1 Major degradation process in 2-tert-amyl anthraquinone working fluid
降解产物的生成不仅消耗了价格昂贵的2-叔戊基蒽醌,而且降低了生产能力,增加了生产成本,因此,双氧水生产过程中对降解产物的检测尤为重要,标准样品为这一过程提供了依据。为此,作者合成了叔戊基蒽醌法生产双氧水工作液的主要氢化降解产物2-叔戊基蒽(5a)、2-叔戊基-9-蒽酮(5b)及氧化降解产物2-叔戊基四氢蒽醌环氧化物(6a)。
1 实验
1.1 试剂与仪器
苯、苯酐、无水三氯化铝、发烟硫酸,均为分析纯;叔戊基氯[16],自制。
薄层层析硅胶板,烟台江友硅胶开发有限公司;EYELA N-1100型旋转蒸发仪、PSL-1810型低温磁力搅拌水槽,上海爱朗仪器有限公司;TRACEDSQ型循环水式多用真空泵,郑州长城科工贸有限公司;X-6型显微熔点测定仪,北京泰克仪器有限公司;Avater 370型傅立叶变换红外光谱仪,美国Nicolet公司;Bruker Avance 600MHz型核磁共振波谱仪;Bruker 456-GC型气相色谱仪,毛细管柱(60m×0.32mm,0.25μm),分流比70∶1,柱前压82.7kPa,进样器温度300℃,检测器温度300℃,载气为高纯氮气。
1.2 方法
1.2.1 叔戊基苯(1a)的合成[17]

向装有冷凝管、恒压滴液漏斗、机械搅拌及尾气吸收装置的2L三口烧瓶中搅拌下加入苯(10mol,780.00g)和无水三氯化铝(0.075mol,10.00g),滴加叔戊基氯(2.5mol,266.25g),控制反应温度15℃,2.5h滴加完毕,15℃保温30min。反应完毕,将反应液倒入含有冰的盐酸中,搅拌,分液,水洗,碱洗,水洗,无水MgSO4干燥,常压蒸馏至无馏分蒸出为止,再减压蒸馏,收集(60~65)℃/1kPa馏分,得到318.20g无色液体化合物1a,收率86.0%。
1.2.2 2-(4-戊基苯甲酰)苯甲酸(2a)的合成[18]

向装有温度计、干燥管、恒压滴液漏斗和尾气吸收装置的100mL三口烧瓶中搅拌下加入苯酐(0.01 mol,1.48g)、无水三氯化铝(0.025mol,3.30g)和氯苯(10mL),水浴加热,40℃时将化合物1a(0.01 mol,1.48g)、三乙胺(0.0017mol,0.17g)及氯苯(20 mL)由滴液漏斗逐滴滴入反应瓶,约2h滴完,40℃反应1h后将反应液倒入35mL 10%(质量分数)的H2SO4溶液中搅拌,分出有机层,水蒸气蒸馏除去氯苯,抽滤,用10%(质量分数)的碳酸钠溶液溶解固体,滴加稀盐酸酸化。析出固体,抽滤,水洗,干燥,得到淡黄色固体,重结晶得到2.51g白色固体化合物2a,收率84.9%,熔点107.6~110.5℃。
1.2.3 2-叔戊基蒽醌(3a)的合成

向装有分水器、冷凝管、恒压滴液漏斗和温度计的三口烧瓶中加入20%(质量分数)的发烟硫酸(27.024 mmol,3.08g),通过恒压滴液漏斗将含化合物2a(3.378mmol,1.00g)的二氯甲烷溶液(10mL)缓慢滴入烧瓶中,搅拌下维持温度15℃,约2h滴加完毕。然后将反应混合物加热到40℃左右,蒸出二氯甲烷,再将反应混合物加热到85℃,反应3.5h,冷却至室温,最后将反应物缓慢倒入冷水中,抽滤得到固体,碱洗,抽滤,用水洗涤滤饼至滤液呈无色,干燥得黄色固体,重结晶后得到0.81g化合物3a,收率88.2%,熔点62.5~63.7℃。
1.2.4 2-叔戊基四氢蒽醌(4a)的合成[19]
将化合物3a(7.2mmol,2.00g)溶于13mL二甲苯和6.5mL纯度为99.5%的乙醇混合液中,加入1.50g雷尼镍催化剂,装好高压釜后,通入氢气,使氢气压力维持在0.3MPa,控制反应温度65℃,反应40h。室温下通入氧气,反应2h,水洗,弃去含有双氧水的水相,有机相干燥,脱溶,得1.86g黄色固体化合物4a,收率91.8%,熔点121.2~122.8℃。

1.2.5 2-叔戊基蒽(5a)和2-叔戊基-9-蒽酮(5b)的合成[20]

向装有搅拌装置和温度计的250mL三口瓶中加入化合物3a(20mmol,5.56g)和冰乙酸(42.8mL,749mmol),加热至沸腾。将锡粉(34mmol,4.00g)和盐酸(68mmol,14.3mL)平均分成12份,每隔10 min加1份,约在2h内加完,继续回流1.5h。反应结束后,过滤,往滤液中加水,振荡,静置一段时间,乙酸乙酯萃取,无水硫酸镁干燥,脱溶,硅胶柱提纯,得到0.76g化合物5a,收率16.4%,熔点116.2~117.8℃;同时得3.38g化合物5b,收率65.8%,熔点120.8~122.4℃。
1.2.6 2-叔戊基四氢蒽醌环氧化物(6a)的合成[21]

将化合物4a(2mmol,0.56g)溶于乙醇(24mL)中,在45~50℃下,滴加30%的双氧水(0.23g)和质量分数为30%的氢氧化钠溶液(2mL),TLC跟踪,反应结束后,旋干乙醇,乙酸乙酯萃取,无水MgSO4干燥,脱溶,得0.57g淡黄色固体化合物6a,收率95.0%,熔点71.4~72.5℃。
2 结果与讨论
2.1 2-叔戊基蒽醌(3a)的合成工艺改进
在文献基础上,对叔戊基苯(1a)、2-(4-戊基苯甲酰)苯甲酸(2a)和2-叔戊基蒽醌(3a)的合成工艺进行了改进。
表1为反应温度对化合物1a和化合物1b质量分数的影响。
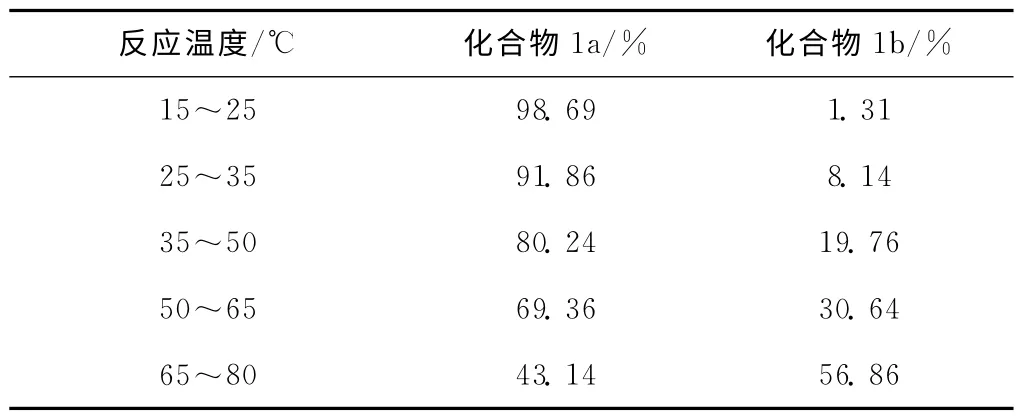
表1 反应温度对化合物1a和化合物1b质量分数的影响Tab.1 The effect of reaction temperature on the mass fraction of compound 1a,1b
由表1可知:当反应在室温进行时,叔戊基苯(1a)的质量分数达到98.69%;随着反应温度的升高,叔戊基异构成仲戊基(1b)的比例逐渐增大,在回流条件下,叔戊基苯质量分数下降到43.14%;当反应温度低于15℃时,反应速率减慢。因此,在以苯和叔戊基氯为原料、AlCl3作催化剂合成叔戊基苯时,选择适宜的反应温度为15℃。
苯酐和叔戊基苯(1a)在无水AlCl3催化下合成2-(4-戊基苯甲酰)苯甲酸(2a),反应过程中产生的HCl会引起苯环上的叔戊基异构化为仲戊基(2b)。在合成双氧水过程中,2-仲戊基蒽醌(3b)比2-叔戊基蒽醌(3a)的催化活性低。为尽量减少这种异构化的产生,可以采用三乙胺作敷酸剂与反应中产生的HCl作用生成盐;也可以向反应体系中通入N2,排出体系中产生的HCl,提高产物的选择性,但同时也会带走部分反应物,使收率降低。
在关环反应合成2-叔戊基蒽醌(3a)的过程中,选用低沸点的二氯甲烷溶解化合物2a,增加了苯甲酸与发烟硫酸的接触面积,使反应更充分,提高了收率,而且有利于产物的分离和提纯。
气相色谱结果表明,所得叔戊基苯(1a)的质量分数为98.69%;2-叔戊基蒽醌的质量分数为95.1%,重结晶后达到98.7%,满足进一步实验的要求。
2.2 盐酸与锡粉的加料方式对化合物5a和5b收率的影响
一般来说,盐酸与金属锡反应越剧烈,还原效果就越差。这主要是因为质子形成氢气逃逸造成的。只有当盐酸与金属锡反应比较缓慢时,质子才会转移到2-叔戊基蒽醌(3a)分子上发生反应。
盐酸与锡粉的加料方式对化合物5a和5b收率的影响见表2。

表2 盐酸与锡粉的加料方式对化合物5a和5b收率的影响Tab.2 Effects of adding method of HCl and Sn on yield of compound 5a,5b
由表2可知,以2-叔戊基蒽醌(20mmol,5.56g)和冰乙酸(42.8mL,749mmol)为基准,一次性加入盐酸和锡粉的量不同时,对化合物5a和5b收率的影响较大。当68mmol盐酸与34mmol锡粉一次性加入反应体系时,化合物5a的收率达到82.3%;当物料总加量不变,随着分批加入的次数增加,化合物5a的收率逐渐降低,化合物5b的收率逐渐升高。这可能与反应机理有关:1个电子从金属锡表面转移到2-叔戊基蒽醌分子上,使2-叔戊基蒽醌形成负离子自由基,与较强的供质子基团相遇即可取得质子,成为自由基,自由基再从锡的表面取得1个电子形成负离子,再从供质子剂中取得质子而完成还原反应。因此,盐酸和锡粉分批加入,对还原反应有利。综合考虑,确定适宜的加料方式为:将盐酸(68mmol,14.3mL)和锡粉(34 mmol,4.00g)平均分成12份,每隔10min加1份(即nHCl∶nSn=5.6mmol∶2.8mmol)。
实验发现,若一次性加入锡粉,分批加入盐酸,溶液颜色为黑色,反应液中含有大量未反应的的原料和锡粉,2-叔戊基-9-蒽酮(5b)的收率很低。这可能是因为:一方面在回流条件下,氯化氢挥发,使盐酸的浓度降低;另一方面反应剧烈导致质子未能参与反应,导致氢气逃逸。
2.3 2-叔戊基四氢蒽醌环氧化物(6a)的合成工艺改进
据报道,2-叔戊基四氢蒽醌(4a)在金属催化剂(Al、Ca、Mn、Re、W、Mo)的作用下,常温即可迅速合成2-叔戊基四氢蒽醌环氧化物(6a),但是该方法对环境污染较严重。本实验以双氧水为氧化剂,在碱性条件、45~50℃、nNaOH∶nH2O2=1∶1时迅速反应,得到化合物6a,原料转化率高,后处理操作简单,对环境无污染。但当双氧水过量时,副产物比例升高。
2.4 标准品的出峰时间
气相色谱条件:柱温为程序升温,初始温度为110℃,保持2min;以3.0℃·min-1的速率升温至150℃,保持2min;以20.0℃·min-1的速率升温至240℃,保持2min;以2.0℃·min-1的速率升温至260℃,保持25min。
在上述色谱条件下,标准品的出峰时间为:2-叔戊基-9-蒽酮44.21min、2-叔戊基蒽39.02min、2-叔戊基四氢蒽醌环氧化物43.36min。
2.5 结构表征
3a:1HNMR(400MHz,CDCl3),δ:8.196(d,J=4.4Hz,2H,Ar),8.146(q,J=9.2Hz,2H,Ar),7.703(s,1H,Ar),7.672~7.695(m,2H,Ar),1.663~1.719[m,2H,-C(CH3)2CH2CH3],1.392[s,6H,-C(CH3)2CH2CH3],0.685[q,J=6.4Hz,3H,-C(CH3)2CH2CH3];13CNMR(150MHz,CDCl3),δ:183.3(C=O),182.7(Ar),156.7(Ar),133.8(Ar),133.4(Ar),133.0(Ar),131.9(Ar),131.0(Ar),127.0(Ar),124.5(Ar),38.9[-C(CH3)2CH2CH3],36.6[-C(CH3)2CH2CH3],28.1[-C(CH3)2CH2CH3],9.1[-C(CH3)2CH2CH3];IR(KBr),ν,cm-1:3 483,3 072,2 966,2 877,2 360,2 339,1 675,1 593,1 462,1 401,1 326,1 287,1 234,1 170,971,932,856,794,712,672,637,580。
4a:1HNMR(400MHz,CDCl3),δ:8.040(s,1H,Ar),8.007(d,J=12Hz,1H,Ar),7.657(d,J=12 Hz,1H,Ar),2.602(s,4H,-CH2),1.679~1.757(m,6H,-CH2),1.356[s,6H,-C(CH3)2CH2CH3],0.683[q,J=10.8Hz,3H,-C(CH3)2CH2CH3];13CNMR(150MHz,CDCl3),δ:184.9(C=O),155.8(Ar),144.7(Ar),131.8(Ar),131.0(Ar),129.8(Ar),126.1(Ar),123.6(Ar),38.8(CH2),36.6(CH2),28.2[-C(CH3)2CH2CH3],23.1[-C(CH3)2CH2CH3],21.1[-C(CH3)2CH2CH3],9.0[-C(CH3)2CH2CH3];IR(KBr),ν,cm-1:3 439,2 963,2 937,2 879,1 657,1 623,1 588,1 457,1 383,1 293,1 234,1 176,913,855,731,695,596。
5a:1HNMR(600MHz,CDCl3),δ:8.36(d,J=11.2Hz,2H,Ar),7.97(d,J=6.8Hz,2H,Ar),7.93(d,J=8.9Hz,1H,Ar),7.83(s,1H,Ar),7.49(d,J=8.9Hz,1H,Ar),7.45~7.40(m,2H,Ar),1.76[q,J=7.3Hz,2H,-C(CH3)2CH2CH3],1.41[s,6H,-C(CH3)2CH2CH3],0.76[t,J=7.0Hz,3H,-C(CH3)2CH2CH3];13CNMR(150MHz,CDCl3),δ:146.1(Ar),131.8(Ar),131.4(Ar),130.3(Ar),128.1(Ar),127.8(Ar),126.0(Ar),125.6(Ar),125.1(Ar),124.9(Ar),123.6(Ar),38.2[-C(CH3)2CH2CH3],36.2[-C(CH3)2CH2CH3],28.2[-C(CH3)2CH2CH3],9.3[-C(CH3)2CH2CH3];IR(KBr),ν,cm-1:3 493,3 123,2 961,2 926,2 874,1 626,1 456,1 400,1 310,1 159,959,896,868,805,745,641,476。
5b:1HNMR(600MHz,CDCl3),δ:8.38(d,J=7.7Hz,2H,Ar),8.34(s,1H,Ar),7.6(t,J=7.3 Hz,2H,Ar),7.47(t,J=7.9Hz,2H,Ar),7.43(d,J=8.1Hz,1H,Ar),4.34(s,2H,CH2),1.70~1.74[m,2H,-C(CH3)2CH2CH3)],1.36[s,1H,-C(CH3)2CH2CH3],0.69[t,J=7.4Hz,3H,-C(CH3)2CH2CH3];13CNMR(150MHz,CDCl3),δ:183.3(C=O),148.5(Ar),140.61(Ar),137.7(Ar),132.6(Ar),132.2(Ar),130.9(Ar),128.4(Ar),128.2(Ar),127.6(Ar),128.9(Ar),124.7(Ar),38.1[-C(CH3)2CH2CH3],36.7[-C(CH3)2CH2CH3],32.0(CH2),28.5[-C(CH3)2CH2CH3],9.19[-C(CH3)2CH2CH3];IR(KBr),ν,cm-1:3 483,3 141,2 963,2 925,1 631,1 401,1 291,1 136,1 032,942,874,856,815,793,731,628,473。
6a:1HNMR(600MHz,CDCl3),δ:7.926(s,1H,Ar),7.906(d,J=7.8Hz,1H,Ar),7.692(d,J=8.4 Hz,1H,Ar),2.553~2.521(m,2H,CH2),2.176~2.142(m,2H,CH2),1.711~1.674(m,2H,CH2),1.566~1.547(m,2H,CH2),1.427~1.421(m,2H,CH2),1.325[s,6H,-C(CH3)2CH2CH3],0.661[t,J=7.2Hz,3H,-C(CH3)2CH2CH3];13CNMR(150 MHz,CDCl3),δ:193.2(C=O),156.9(Ar),132.0(Ar),131.6(Ar),129.5(Ar),127.0(Ar),124.5(Ar),64.5(C-O),38.8[-C(CH3)2CH2CH3],36.5[-C(CH3)2CH2CH3],28.1[-C(CH3)2CH2CH3],21.2(CH2),19.0(CH2),9.0[-C(CH3)2CH2CH3];IR(KBr),ν,cm-1:3 424,2 963,2 348,1 694,1 599,1 458,1 435,1 400,1 364,1 290,1 189,1 172,952,901,837,736。
3 结论
以苯和叔戊基氯为原料合成了2-叔戊基蒽、2-叔戊基-9-蒽酮及2-叔戊基四氢蒽醌环氧化物。确定:以苯和叔戊基氯为原料、无水AlCl3作催化剂,合成叔戊基苯的最佳反应温度为15℃;将盐酸(68mmol,14.3 mL)和锡粉(34mmol,4.00g)平均分成12份,每隔10min加1份,即nHCl∶nSn=5.6mmol∶2.8mmol时,2-叔戊基-9-蒽酮的收率最高;当nNaOH∶nH2O2=1∶1时,可得到2-叔戊基四氢蒽醌环氧化物。
[1]LUNSFORD J H.The direct formation of H2O2from H2and O2over palladium catalysts[J].Journal of Catalysis,2003,216(1-2):455-460.
[2]SAMANTA C,CHOUDHARY V R.Direct synthesis of H2O2from H2and O2and decomposition/hydrogenation of H2O2in an aqueous acidic medium over halide-modified Pd/Al2O3catalyst[J].Applied Catalysis A:General,2007,330:23-32.
[3]NISHIMI T,KAMACHI T,KATO K,et al.Mechanistic study on the production of hydrogen peroxide in the anthraquinone process[J].European Journal of Organic Chemistry,2011,2011(22):4113-4120.
[4]CAMPOS-MARTIN J M,BLANCO-BRIEVA G,FIERRO J L.Hydrogen peroxide synthesis:An outlook beyond the anthraquinone process[J].Angewandte Chemie International Edition,2006,45(42):6962-6984.
[5]MORRIS S M,FULVIO P F,JARONIEC M.Ordered mesoporous alumina-supported metal oxides[J].Journal of American Chemical Society,2008,130(45):15210-15216.
[6]SHANG H,ZHOU H J,ZHU Z H,et al.Study on the new hydrogenation catalyst and processes for hydrogen peroxide through anthraquinone route[J].Journal of Industrial and Engineering Chemistry,2012,18(5):1851-1857.
[7]陈柏洲,吴巧珍.2-烷基蒽醌的制备[J].武汉化工,1992,(4):2-8.
[8]KOSYDAR R,DRELINKIEWICZ A,GANHY J P.Degradation reactions in anthraquinone process of hydrogen peroxide synthesis[J].Catalysis Letters,2010,139(3-4):105-113.
[9]HALDER R,LAWAL A.Experimental studies on hydrogenation of anthraquinone derivative in a microreactor[J].Catalysis Today,2007,125(1-2):48-55.
[10]SAMANTA C.Direct synthesis of hydrogen peroxide from hydrogen and oxygen:An overview of recent development in the process[J].Applied Catalysis A:General,2008,350(2):133-149.
[11]YAMANAKA I,ONIZAWA T,TAKENAKA S,et al.Direct and continuous production of hydrogen peroxide with 93%selectivity using a fuel-cell system[J].Angewandte Chemie International Edition,2003,42(31):3653-3655.
[12]BOYER B,KERAMANE E M,MONTERO J L,et al.BiCl3:An efficient agent for selective chlorination of alcohols or for halogen exchange reaction[J].Synthetic Communications,1998,28(10):1737-1741.
[13]DRELINKIEWICZ A,LAITINEN R,KANGAS R,et al.2-Ethylanthraquinone hydrogenation on Pd/Al2O3.The effect of water and NaOH on the degradation process[J].Applied Catalysis A:General,2005,284(1-2):59-67.
[14]DRELINKIEWICZ A,WAKSMUNDZKA-GORA,SOBCZAK J W,et al.Hydrogenation of 2-ethyl-9,10-anthraquinone on Pd/SiO2composite catalyst:The effat of humidity[J].Applied Catalysis A:General,2007,333(2):219-228.
[15]KOSYDAR R,DRELINKIEWICZ A,GURGUL J,et al.The role of alkali modifiers(Li,Na,K,Cs)in activity of 2%Pd/Al2O3catalysts for 2-ethyl-9,10-anthraquinone hydrogenation[J].Applied Catalysis A:General,2011,402(1-2):121-131.
[16]SCHMERLING L,WEST J P.Isomerization accompanying the alkylation of benzene with 1-chloro-3,3-and with 2-chloro-2,3-dimethylbutane[J].Journal of American Chemical Society,1954,76(7):1917-1921.
[17]EGGERSDORFER M,GROSCH W,SIEGEL H,et al.Acylation of aromatics:US,4895984A[P].1990-01-23.
[18]EVANS W L.Manufacture of alkyl anthraquinones:US,4404140A[P].1983-09-13.
[19]姚冬龄.蒽醌法生产过氧化氢工作液中的四氢蒽醌[J].无机盐工业,2008,40(12):4-7.
[20]唐欣,段正康,颜炜伟.2-乙基蒽酮的合成研究[J].精细化工中间体,2006,36(2):50-52.
[21]KROHN K,MICHEEL J.Total synthesis of angucyclines.10.Oxygenation of Diels-Alder products to non-aromatic angucyclinones of the SF-2315and tetrangomycin types[J].Tetrahedron,1998,54(19):4827-4838.
