邻苯二甲酸单丁酯致小鼠肝脏和肾脏组织的氧化损伤
2014-01-14刘志敏曹凤华梅宇飞袁均林
刘志敏,熊 棣,曹凤华,梅宇飞,吴 卓,杨 旭,袁均林
(华中师范大学生命科学学院 遗传调控与整合生物学湖北省重点实验室,湖北 武汉430079)
从20世纪30年代至今,邻苯二甲酸酯(PAEs)主要作为增塑剂大量存在于日常生活中,主要作用是软化塑料和增强塑料的弹性。由于此类材料不是以共价键与终产物结合,可不断释放至土壤、水和大气中,造成环境污染[1-2]。邻苯二甲酸二丁酯(dibutyl phthalate,DBP)是使用量最大、污染最严重的PAEs[3]。检测尿液中PAEs的代谢物发现,DBP的人体内暴露水平最高[4]。由于PAEs在环境中普遍存在,其一级代谢物邻苯二甲酸单丁酯(MBP)在一些环境中也被发现。研究表明,MBP生物活性更高、毒性更大,不仅对生殖、发育、体内激素、核受体、炎症和肥胖等方面都能产生影响,甚至还可以致死、致畸、致突变[5],成为PAEs毒性研究的新热点[6-10]。
近年来,国外科学家通过测定尿液中PAEs的代谢物MBP的含量间接反映PAEs的内接触水平,并基于尿液样品的易得性和检测方法的成熟度,认为MBP是一种较为合适的反映PAEs暴露的生物标志物。对尿液中MBP的研究为评价PAEs在人体的暴露量及对人体健康的影响提供了重要的信息[11-13]。
作者在此对MBP引起的小鼠肝脏和肾脏组织的氧化损伤进行研究,拟为全面评价PAEs对人体健康的影响提供更丰富的信息,也为全面了解PAEs毒性提供依据。
1 实验
1.1 材料、试剂与仪器
SPF级雄性BALB/c小鼠,购于湖北省预防医学科学院动物实验中心。
邻苯二甲酸单丁酯(纯度≥98.5%)、DCFH-DA荧光染料(纯度>99.9%),Sigma公司;硫代巴比妥酸(TBA)、5,5′-二硫代二硝基苯甲酸(DTNB),分析纯,国药集团化学试剂有限公司。
5415R型低温冷冻离心机,德国Eppendorf公司;MS1Minishaker型涡旋仪,德国IKA公司;FLx800型荧光酶标仪,美国Bio-Tek仪器有限公司;DNM-9602型酶标分析仪,北京普朗新技术有限公司;JN-3200DT型超声处理器,宁波江南仪器厂。
1.2 动物分组和染毒
对42只4周龄SPF级雄性BALB/c小鼠先进行1周的实验室环境饲养,1周后随机分为7组,每组6只:空白对照组,溶剂对照组,25mg·kg-1MBP染毒组,50mg·kg-1MBP染毒组,100mg·kg-1MBP染毒组,200mg·kg-1MBP染毒组,100mg·kg-1DBP染毒组。MBP、DBP均用金龙鱼调和油进行配制,每天定时对小鼠给予0.005mL·(g体重)-1灌胃1次,染毒14d。溶剂对照组以等体积的金龙鱼调和油进行灌胃,染毒期间小鼠均可自由进水、进食。
1.3 染毒期间小鼠体征的观察
观察并记录染毒期间7组小鼠的体征变化,并记录染毒期间7组小鼠的平均体重。
1.4 肝脏、肾脏组织切片观察
染毒结束后,取小鼠部分肝脏和一侧的肾脏,用10%的甲醛固定,脱水,透明,浸蜡,包埋,切片,HE染色,在显微镜下观察组织的病理学变化。
1.5 组织匀浆液的制备
分别快速取出小鼠肝、肾,先用冰冷的PBS缓冲溶液漂洗,然后称取适量,加入10BV的PBS缓冲溶液(pH=7.5)制成质量分数为10%的匀浆液,低温离心后取上清液,用于活性氧(ROS)、还原性谷胱甘肽(GSH)和丙二醛(MDA)含量的测定。
1.6 ROS含量的测定
参照Crow[10]的方法并稍加改进。分别取小鼠肝脏和肾脏组织匀浆上清液2μL,加入198μL PBS缓冲溶液稀释100倍;取100μL排列于酶标板中,然后加入100μL荧光染料染色,避光反应5min,用荧光酶标仪检测,以荧光强度表征ROS含量。空白组为100μL PBS缓冲溶液加100μL荧光染料。
1.7 GSH含量的测定
参照Anderson[14]方法并稍加改进。分别取小鼠肝脏和肾脏组织匀浆上清液200μL,加入有机溶剂(V氯仿∶V正丁醇=4∶1)1mL,用涡旋仪混合均匀,在冰上静置10min后10 000×g离心5min;在不破坏蛋白层的情况下取上清液50μL加入酶标板,加150μL浓度为60ng·mL-1的DTNB,室温下避光反应5 min,测其在412nm处的吸光值(OD412)。空白组为50mL PBS缓冲溶液加150μL DTNB。
1.8 MDA含量的测定
参照Draper等[15]方法并稍加改进。分别取500 μL肝脏和肾脏组织匀浆上清液于试管中,加入2mL 0.6%TBA,沸水浴15min;取上清液1mL于EP管中,10 000×g离心5min;取上清液100μL于酶标板中排列,用全波长酶标仪检测,分别在450nm、532nm和600nm波长下测定吸光值(以加PBS缓冲溶液的空白组为对照)。按公式c=6.45(OD532-OD600)-0.56OD450计算MDA的含量。
1.9 统计分析
数据采用Origin6.1统计软件进行检验处理,比较染毒组与对照组测量值的差异:P<0.05为差异显著,P<0.01为差异极显著。
2 结果与讨论
2.1 染毒期间小鼠体征的变化
实验发现:染毒前2d,各实验组小鼠进食、进水正常,无中毒症状及体征变化;染毒后第3~15d,与对照组相比,各染毒组存活小鼠依据染毒剂量的高低分别出现不同程度的中毒症状如轻微精神不振、行动迟缓、食欲下降、皮毛无光泽等,低剂量组小鼠体重总体仍呈上升趋势,而100mg·kg-1MBP、200mg·kg-1MBP和100mg·kg-1DBP染毒组体重均呈下降趋势,且最高剂量染毒组体重下降最为明显,体重相差最大的一只小鼠从染毒第1d的31.07g下降到第14d的24.36g,且皮毛呈炸起状,身体发青,在每天换垫料与清洗鼠笼的情况下,皮毛仍为湿漉状态且局部粘连,并伴有刺激味道。
小鼠在接触MBP过程中所出现的中毒症状随着染毒剂量的增加越来越明显,说明MBP引起了小鼠不同程度的机体损伤。
2.2 小鼠肝脏组织切片观察(图1)
染毒14d后,在显微镜下观察经HE染色的小鼠肝脏组织细胞时发现,肝细胞的损伤程度与染毒剂量水平呈明显的剂量-效应关系,200mg·kg-1MBP染毒组小鼠肝细胞病变最为明显。
由图1可看出:对照组的肝细胞以中央静脉为中心向外呈辐射状排列,肝窦状隙规则分布(图1a、b);100mg·kg-1MBP染毒组(图1e)和200mg·kg-1MBP染毒组(图1f)部分肝细胞水肿、细胞核固缩、破裂、水解、胞浆空亮、核消失、空泡样变、脂肪滴增大融合、局部细胞严重坏死,说明肝细胞存在严重的氧化损伤;25mg·kg-1MBP染毒组(图1c)和50mg·kg-1MBP染毒组(图1d)肝细胞质地相对均匀,局部伴随轻微炎症细胞浸润、细胞核轻微固缩、局部胞浆空亮和局部细胞肿大等症状。
相关研究表明MBP在体内的生物活性并不降低,故本实验另设染毒组DBP,与相同剂量的MBP染毒组比较氧化损伤程度。与100mg·kg-1MBP染毒组(图1e)比较,100mg·kg-1DBP染毒组(图1g)出现了明显的细胞水肿和细胞核固缩,但100mg·kg-1MBP染毒组细胞核固缩、细胞水肿、空泡样变等症状比100mg·kg-1DBP染毒组严重。

图1 不同处理组对小鼠肝脏的病理组织学影响(HE×200)Fig.1 Effects of different treatment groups on the histopathology of mice liver(HE×200)
2.3 小鼠肾脏组织切片观察(图2)
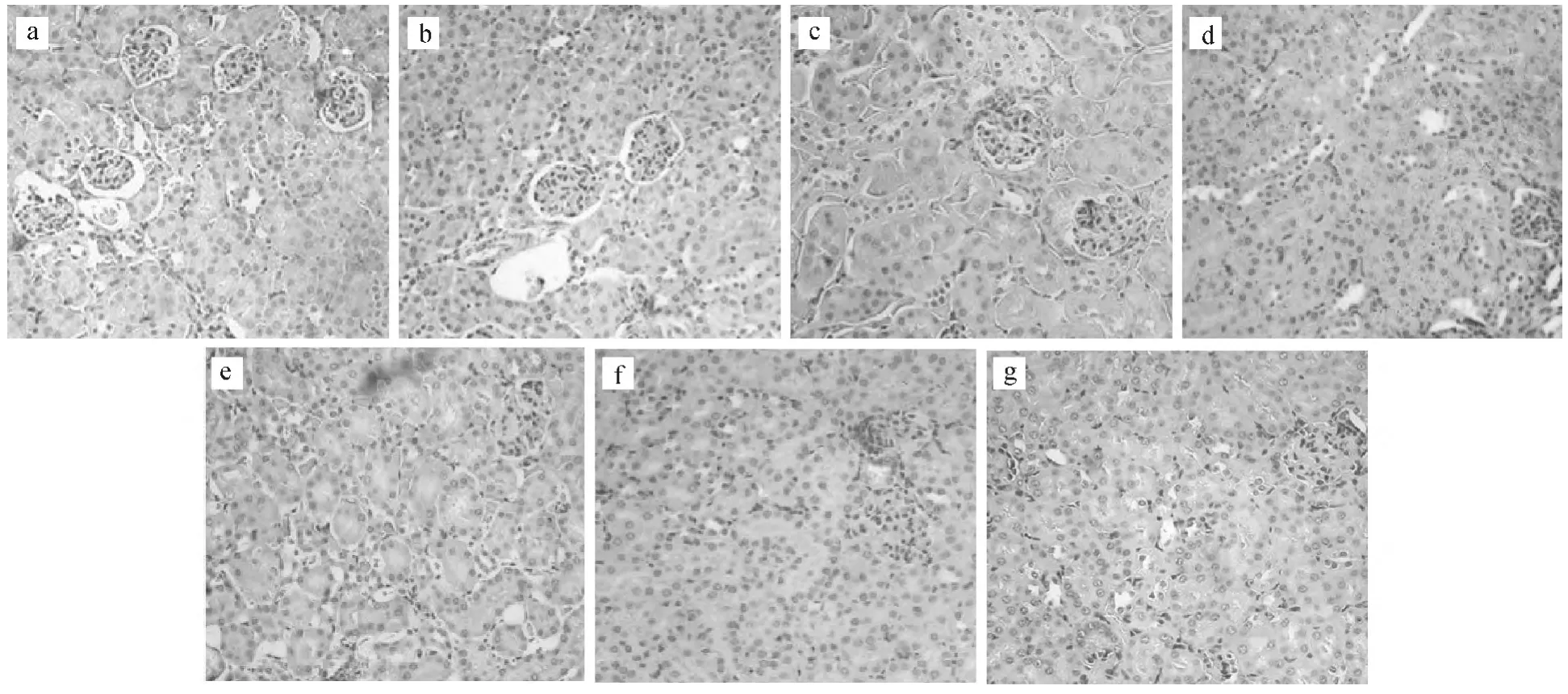
图2 不同处理组对小鼠肾脏的病理组织学影响(HE×200)Fig.2 Effects of different treatment groups on the histopathology of mice kidney(HE×200)
在显微镜下观察经HE染色的肾脏组织细胞时发现,与肝脏组织细胞相比,肾脏组织细胞只发生轻微的变化,小鼠肾脏组织损伤程度与染毒剂量水平无明显的剂量-效应关系。
由图2可以看出,100mg·kg-1MBP染毒组(图2e)和200mg·kg-1MBP染毒组(图2f)与对照组(图2a)比较,出现了局部肾小管上皮细胞脱落于管腔、水样变性等症状,但小鼠肾脏病理切片可见肾皮质和髓质结构清晰,系膜区无增生及沉积物,基底膜未见病变;随着染毒剂量的增加,出现了肾小体数目减少、肾小囊管腔变窄、淋巴细胞浸润程度增大等症状。
100mg·kg-1MBP染毒组(图2e)和100mg·kg-1DBP染毒组(图2g)相比没有明显差别,但与对照组相比,细胞肾小囊管腔均变窄,出现炎症细胞浸润等症状。
2.4 小鼠肝脏和肾脏组织中ROS含量的变化
小鼠经不同处理后,肝脏和肾脏组织中ROS含量的变化如图3所示。
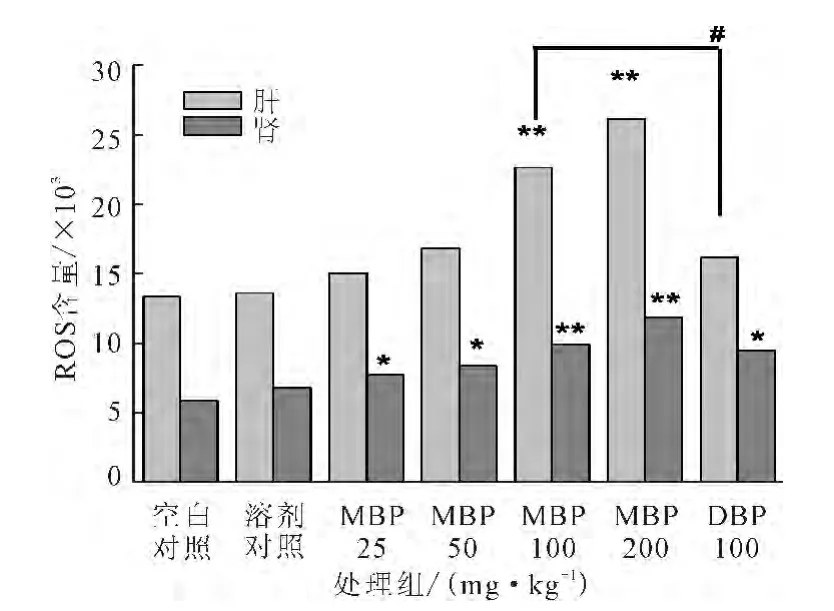
图3 不同处理组对小鼠肝脏和肾脏组织ROS含量的影响Fig.3 Effects of different treatment groups on ROS content in liver and kidney of mice
由图3可知:(1)MBP剂量为25mg·kg-1和50 mg·kg-1时,染毒组肝脏组织ROS含量与对照组无显著性差异(P>0.05);剂量为100mg·kg-1和200 mg·kg-1时,染毒组肝脏组织ROS含量与对照组有极显著性差异(P<0.01)。表明染毒剂量≥100mg·kg-1时MBP可致小鼠肝脏组织ROS含量上升;(2)MBP剂量为25mg·kg-1和50mg·kg-1时,染毒组肾脏组织ROS含量与对照组有显著性差异(P<0.05);剂量为100mg·kg-1和200mg·kg-1时,染毒组肾脏组织ROS含量与对照组有极显著性差异(P<0.01)。表明染毒剂量≥25mg·kg-1时MBP可致小鼠肾脏组织ROS含量上升;(3)相同剂量的MBP和DBP染毒组相比,MBP染毒组肝脏组织ROS含量显著高于DBP染毒组(P<0.05),MBP染毒组肾脏组织ROS含量略高于DBP染毒组,但无显著差异(P>0.05)。
2.5 小鼠肝脏和肾脏组织中GSH含量的变化
小鼠经不同处理后,肝脏和肾脏组织中GSH含量的变化如图4所示。

图4 不同处理组对小鼠肝脏和肾脏组织GSH含量的影响Fig.4 Effects of different treatment groups on GSH content in liver and kidney of mice
由图4可知:(1)MBP剂量为25mg·kg-1、50 mg·kg-1、100mg·kg-1和200mg·kg-1时,染毒组肝脏组织GSH含量与对照组均有极显著性差异(P<0.01)。表明染毒剂量≥25mg·kg-1时MBP可致小鼠肝脏组织GSH含量下降;(2)MBP剂量达到100 mg·kg-1时,染毒组肾脏组织GSH含量与对照组出现显著性差异(P<0.05);剂量增加到200mg·kg-1时,染毒组肾脏组织GSH含量与对照组出现极显著性差异(P<0.01)。表明染毒剂量≥100mg·kg-1时MBP可致小鼠肾脏组织GSH含量下降;(3)相同浓度的MBP和DBP染毒组相比,肝脏和肾脏组织GSH含量均无显著性差异(P>0.05)。
2.6 小鼠肝脏和肾脏组织中MDA含量的变化
小鼠经不同处理后,肝脏和肾脏组织MDA含量的变化如图5所示。

图5 不同处理组对小鼠肝脏和肾脏组织MDA含量的影响Fig.5 Effects of different treatment groups on MDA content in liver and kidney of mice
由图5可知:(1)MBP剂量为25mg·kg-1时,染毒组肝脏组织MDA含量与对照组无显著性差异(P>0.05);剂量为50mg·kg-1、100mg·kg-1时,染毒组肝脏组织MDA含量与对照组有显著性差异(P<0.05);剂量为200mg·kg-1时,染毒组肝脏组织MDA含量与对照组有极显著性差异(P<0.01)。表明染毒剂量≥50mg·kg-1时MBP可致小鼠肝脏组织MDA含量上升;(2)MBP剂量为25mg·kg-1、50 mg·kg-1和100mg·kg-1时,染毒组肾脏组织MDA含量与对照组无显著性差异(P>0.05),剂量为200 mg·kg-1时,染毒组肾脏组织MDA含量与对照组出现显著性差异(P<0.05)。表明染毒剂量≥200mg·kg-1时MBP可致小鼠肾脏组织MDA含量上升;(3)相同剂量的MBP和DBP染毒组相比,MBP染毒组肝脏和肾脏组织的MDA含量比DBP染毒组含量略高,无显著性差异(P>0.05)。
2.7 讨论
ROS是超氧阴离子自由基、过氧化氢、羟基自由基和脂质过氧化的不稳定中间体的统称,大部分ROS超过一定浓度时会对其它生物分子产生不利影响[16]。MBP引起的ROS含量上升与其对肝脏和肾脏的促炎症效应有直接关系,因此ROS的生成和氧化应激反应是解释MBP造成肝脏和肾脏炎症的主要方式。实验表明,在染毒剂量≥100mg·kg-1和≥25mg·kg-1时,MBP可分别导致小鼠肝脏和肾脏组织ROS含量上升。
除抗氧化性的酶外,GSH提供了抵抗ROS的第一道防线,不仅能清除自由基及降低过氧化氢水平,还能修复由自由基引起的生物学损伤。当细胞GSH含量降低到一定程度时,细胞会受到不可逆损伤[17]。因此GSH的含量是反映细胞状态的标志之一。实验表明,在染毒剂量≥25mg·kg-1和≥100mg·kg-1时,MBP可分别导致小鼠肝脏和肾脏组织GSH含量下降。可能是由于持续的MBP的氧化应激产物ROS所引起,同时GSH由于去除过氧化氢而被消耗减少[18]。
研究表明,随着自由基的增加,细胞毒性也逐渐增大。同时,自由基引起脂类的连续氧化反应导致脂质过氧化产物增加。MDA是较典型的脂类氧化的分解产物,MDA的含量可以衡量脂类氧化的程度,间接反映引起脂类氧化的活性氧水平[19]。实验表明,在染毒剂量≥50mg·kg-1和≥200mg·kg-1时,MBP可分别导致小鼠肝脏和肾脏组织MDA含量上升,使小鼠肝脏和肾脏活性氧水平上升,是MBP毒性损伤的显著性表现。综上,在MBP的浓度达到一定量的情况下,小鼠肝脏和肾脏组织中可能会产生过量的活性氧自由基,这些自由基可以作用于生物膜,也可以作用于蛋白质等发挥破坏作用。与先前Prasanth等[8]报道的DBP和MBP对SOD的抑制作用削弱了自由基的清除机制,引起机体氧化损伤,对身体有不利影响的结果相吻合。
相同浓度的MBP和DBP染毒组相比,除了在肝脏中的ROS含量MBP染毒组显著高于DBP染毒组外,GSH和MDA的含量均无显著性差异,这证明了在100mg·kg-1的浓度下MBP在体内的生物活性并不降低,与赵雅辉等[5]的结论是一致的。
实验还发现,高剂量MBP染毒组有2只小鼠的肝脏和肾脏组织MDA含量在反复测量的情况下仍有明显下降趋势,因此推测,小鼠肝脏和肾脏组织MDA含量的变化与ROS的变化并不完全符合对应关系,提示在导致组织细胞过氧化的过程中还存在其它作用机制。
3 结论
为了探究邻苯二甲酸单丁酯(MBP)对小鼠肝脏和肾脏的氧化损伤,将42只BALB/c小鼠随机分为7组,每组6只,分别为25mg·kg-1、50mg·kg-1、100 mg·kg-1、200mg·kg-1的4个MBP染毒组、1个100mg·kg-1的邻苯二甲酸二丁酯(DBP)染毒组、1个空白对照组、1个溶剂对照组。染毒期间对小鼠的体征进行观察;14d后取其肝脏和肾脏组织,制作小鼠肝脏和肾脏组织的切片,对肝脏和肾脏的组织学形态进行观察;制作组织匀浆液用于检测肝脏和肾脏组织细胞的ROS、GSH、MDA的含量,以了解MBP对肝脏和肾脏组织的氧化损伤作用。结果显示:各剂量组小鼠肝细胞和肾小管上皮细胞均出现不同程度的细胞核固缩、细胞水肿、空泡样变、脂肪滴增大融合等症状;ROS和MDA的含量与MBP的染毒剂量呈正相关,GSH的含量与MBP的染毒剂量呈负相关;相同剂量的DBP与MBP染毒组相比,MBP染毒组的ROS和MDA含量较高、GSH含量较低。表明,MBP的暴露与小鼠肝脏和肾脏组织的氧化损伤存在直接联系。
[1]MENDIS-HANDAGAMA S M L C,ARIYARATNE H B S.Differentiation of the adult Leydig cell population in the postnatal testis[J].Biology Reproduction,2001,65:660-671.
[2]游海燕.Leydig细胞睾酮合成的调节[J].中国男科学杂志,2003,17(2):138-141.
[3]柯翔鸿.邻苯二甲酸(2-乙基己基)酯对小鼠的氧化损伤和生殖毒性分子机制研究[D].武汉:华中师范大学,2008.
[4]FROMME H,BOLTE G,KOCH H M,et al.Occurrence and daily variation of phthalate metabolites in the urine of an adult population[J].Int J Hyg Environ Health,2007,210(1):21-33.
[5]赵雅辉,王小逸,林兴桃,等.邻苯二甲酸酯类化合物的体内代谢及毒性研究进展[J].环境与健康杂志,2010,(2):184-187.
[6]SUZUKI T,YAGUCHI K,SUZUKI S,et al.Monitoring of phthalic acid monoesters in river water by solid-phase extraction and GC-MS determination[J].Environ Sci Technol,2001,35(18):3757-3763.
[7]JONSSON S,EJLERTSSON J,SVENSSON B H.Behaviour of mono-and diesters of o-phthalic acid in leachates released during digestion of municipal solid waste under landfill conditions[J].Advances in Environmental Research,2003,7(2):429-440.
[8]PRASANTH G K,DIVYA L M,SADASIVAN C.Effects of mono and di(n-butyl)phthalate on superoxide dismutase[J].Toxicology,2009,262(1):38-42.
[9]HAUSER R,MEEKER J D,DUTY S,et al.Altered semen quality in relation to urinary concentrations of phthalate monoester and oxidative metabolites[J].Epidemiology,2006,17(6):682-691.
[10]CROW J P.Dichlorodihydrofluorescein and dihydrorhodamine 123are sensitive indicators of peroxynitrite in vitro:Implications for intracellular measurement of reactive nitrogen and oxygen species[J].Nitric Oxide,1997,1(2):145-157.
[11]DUTY S M,CALAFAT A M,SILVA M J,et al.The relationship between environmental exposure to phthalates and computer-aided sperm analysis motion parameters[J].J Androl,2004,25(2):293-302.
[12]BRADBURY J.UK Panics over phthalates in baby milk formula[J].The Lancet,1996,347:1541.
[13]FREDRICSSON B,MILLER L,POUSETTE A,et al.Human sperm motility is affected by plasticizers and diesel particle extracts[J].Pharmacol Toxicol,1993,72(2):128-133.
[14]ANDERSON M E.Determination of glutathione and glutathione disulfide in biological samples[J].Methods Enzymol,1985,113:548-555.
[15]DRAPER H H,HADLEY M.Malondialdehyde determination as index of lipid peroxidation[J].Methods Enzymol,1990,186:421-431.
[16]JURCZUK M,MONIUSZKO-JAKONIUK J,BRZOSKA M M.Involvement of some low-molecular thiols in the peroxidative mechanisms of lead and ethanol action on rat liver and kidney[J].Toxicology,2006,219(1-3):11-21.
[17]PASTORE A,FEDERICI G,BERTINI E,et al.Analysis of glutathione:Implication in redox and detoxification[J].Clin Chim Acta,2003,333(1):19-39.
[18]YADAV P,SARKAR S,BHATNAGAR D.Action of capparis decidua against alloxan-induced oxidative stress and diabetes in rat tissues[J].Pharmacol Res,1997,36:221-228.
[19]MORIEL P,PLAVNIK F L,ZANELLA M T,et al.Lipid peroxidation and antioxidants in hyperlipidemia and hypertension[J].Biol Res,2000,33(2):105-112.
