红腐乳中桔霉素的HPLC-FLD分析方法研究
2014-01-13李秀利曹学丽
李秀利, 曹学丽
(北京工商大学食品学院/食品添加剂与配料北京市高校工程研究中心,北京 100048)
红腐乳中桔霉素的HPLC-FLD分析方法研究
李秀利, 曹学丽*
(北京工商大学食品学院/食品添加剂与配料北京市高校工程研究中心,北京 100048)
建立了一种检测红腐乳中桔霉素的高效液相色谱-荧光检测(HPLC-FLD)定量分析方法.比较了不同萃取剂、料液比、提取温度、超声波处理时间、提取次数对桔霉素提取效果的影响.采用ODSWondaSil C18(150 mm×4.6mm i.d.,5μm)色谱柱,体积比为45∶55的乙腈与0.03%磷酸水溶液为流动相,荧光检测器检测,波长λex为331 nm,λem为500 nm,在此条件下进行检测.结果表明:采用甲苯-乙酸乙酯-甲酸体积比为1∶9∶1的复合萃取剂,以料液比为1∶15在60℃下超声提取10min,提取3次可将桔霉素提取完全.在桔霉素质量浓度为0.5~1 000μg/L时,桔霉素质量浓度与荧光检测器响应值呈良好线性关系(R2=0.999 9),该方法的检出限为0.5μg/L,重复实验的RSD 为1.58%,样品平均加标回收率为94%.本方法可用于红腐乳产品中桔霉素的定量分析检测.
桔霉素;红腐乳;高效液相色谱;荧光检测
桔霉素分子式为C13H14O5,是真菌次级代谢产生的毒素.1931年从青霉菌Penicillium citrinum中首次分离得到[1],1995年法国学者Balanc[2]证明某些红曲霉菌株也能够代谢产生桔霉素.由于桔霉素具有肝毒性、肾毒性、生殖毒性、能诱导细胞畸变和凋亡[3],目前世界各国对桔霉素的食品污染及安全评价都十分关注.在我国受桔霉素污染的食物主要是霉变的谷物、饲料、红曲及其相关产品.一般来说,食物中桔霉素的含量较低,被污染后,外观变化不明显,因此建立灵敏快速的桔霉素检测方法是发现和控制该类真菌毒素污染的关键.目前用于检测桔霉素的方法有分光光度法、薄层色谱法、高效液相色谱法、色谱-质谱联用法、毛细管电泳法、免疫法、电化学法[4-6].其中高效液相色谱法以及液-质联用法是检测桔霉素最常用的方法.目前红曲制品是我国桔霉素检测的主要对象[7-8],但是对于红腐乳这种以红曲霉作为重要辅料的我国传统食品中桔霉素的分析检测方法还未见报道,也没有其中桔霉素的限量标准.本研究建立了一套针对红腐乳中桔霉素含量的测定方法,以期为该类产品的质量安全检测提供技术基础.
1 材料与方法
1.1 试剂与仪器
桔霉素标准品(纯度≥98%),Sigma公司;红腐乳,北京美廉美超市;甲苯、乙酸乙酯、甲酸、甲醇(分析纯),北京化工厂;乙腈、磷酸(色谱纯),美国赛默飞世尔公司.
Agilent 1260型高效液相色谱仪(配荧光检测器),美国安捷伦公司;ALPHA2-4LSC型真空冷冻干燥箱,德国CHRIST公司;KQ-400DB型数控超声波清洗器,昆山市超声仪器有限公司;Eppendorf5810R型高速冷冻离心机,德国Eppendorf公司.
1.2 色谱分析条件的建立
通过对流动相组成、流速、进样量的优化[9],最终得到桔霉素的液相色谱检测条件.色谱柱采用岛津ODS柱(WondaSil C18 150×4.6mm,5μm);流动相 V(乙腈)与V(水)(含0.03%磷酸)之比45∶55;流速为1.0mL/min;柱温为28℃;进样量为10μL;检测器为荧光检测器;检测波长:λex=331 nm,λem=500 nm.
1.3 标准溶液的配制
取桔霉素标准品1.00 mg,用甲醇溶解并稀释定容至10mL,配置成100mg/L的储备溶液,于4℃冰箱避光保存备用.临用时,用甲醇分别稀释为1 000,500,200,50,20,0.5μg/L的桔霉素标准溶液,备用.
1.4 单因素实验
1.4.1 提取剂对提取率的影响实验
根据文献中对提取剂的研究[10-11],选择不同配比的甲苯、乙酸乙酯、甲酸系列复合萃取剂(简称TEF)研究其对红腐乳中桔霉素的提取效率.将冷冻干燥后的腐乳样品粉碎,过40目筛,保存于干燥器内,随用随取.称取1.00 g干腐乳,准确加入25 mL提取剂,50℃超声提取30min,8 000 r/min,离心10min,取2mL浓缩至干,加入1m L甲醇溶解,用孔径为0.45μm的有机膜微滤后进行HPLC分析.每组实验做3组平行.
1.4.2 料液比对提取率的影响实验
称取1.00 g干腐乳,分别准确加入体积比为1∶9∶1的TEF提取剂,使料液比(g/m L)为1∶5,1∶10,1∶15,1∶20,1∶25,1∶30,1∶35,1∶40,50℃超声提取30min,8 000 r/min,离心10 min,取2 m L浓缩至干,加入1mL甲醇溶解,用孔径为0.45μm的有机膜微滤后进行HPLC分析.每组实验做3组平行.
1.4.3 提取温度对提取率的影响实验
称取1.00 g干腐乳,准确加入15mL体积比1∶9∶1 的TEF提取剂,超声提取30min,温度分别设定为30, 40,50,60,70℃,8000 r/min,离心10min,取2mL浓缩至干,加入1mL甲醇溶解,用孔径为0.45μm的有机膜微滤后进行HPLC分析.每组实验做3组平行.
1.4.4 提取时间与次数对提取率的影响实验
称取1.00 g干腐乳,准确加入15 m L体积比为1∶9∶1的TEF提取剂,60℃超声提取10 min,连续提取4次,将4次提取液分别离心,取2 mL浓缩至干,加入1m L甲醇溶解,用孔径为0.45μm的有机膜微滤后进行HPLC分析.每组实验做3组平行.
1.5 样品加标回收实验
称取9份已知桔霉素含量的红腐乳冻干样品各1 g,分成3组,分别向每组中加入1 000,200,5μg/L的标准溶液1 mL,按本实验优化的前处理步骤和液相色谱检测条件进行测定.
1.6 精密度实验
对同一腐乳样品预处理后,HPLC重复进样6 次,得到的桔霉素峰面积,并计算相应的标准偏差.
1.7 实际样品的分析
在北京超市中选购了常见的5种不同的红腐乳产品,分别采用上述优化的前处理及检测方法对其进行测定,根据峰面积,用外标法测得不同腐乳样品中桔霉素含量.
2 结果与讨论
2.1 高效液相色谱条件的优化
通过比对桔霉素标品和红腐乳提取物的液相色谱图,找到桔霉素在红腐乳提取物中的出峰位置,改变液相色谱条件优化桔霉素在红腐乳提取物中的分离度.主要对流动相中乙腈和磷酸水溶液的比例进行了优化[12-13],分别采用乙腈与磷酸水溶液的体积比为35∶65,40∶60,45∶55,50∶50作为流动相,对同一腐乳样品进行色谱分析,依次如图1中(a)~(d).由图中可以看出,随着流动相中乙腈比例的提高,洗脱能力提高,物质的出峰时间提前,桔霉素的出峰时间逐渐缩短,峰形由宽变窄,与相邻峰之间的分离度也有降低的趋势.综合考虑,最终选择V(乙腈)与V(水)之比为45∶55,流速为1mL/min作为检测桔霉素液相色谱条件.在此色谱条件下,1000μg/L的桔霉素标准品溶液色谱图为图1(e),出峰时间为7.310min,峰形良好,且与相邻峰能够实现基线分离.
2.2 线性范围与检出限
在本实验色谱条件下,测定桔霉素的标准溶液系列,以桔霉素质量浓度为纵坐标,HPLC测得的峰面积为横坐标绘制标准曲线,见图2.由图2可知,在0.5~1 000μg/L质量浓度范围内,桔霉素质量浓度与荧光检测器响应值呈良好线性关系,计算回归方程为:

图1 不同色谱条件下腐乳样品及标准样品中桔霉素的HPLC-FLD色谱Fig.1 HPLC-FLD chromatograms of citrinin in sofu samples and standards under different conditions

用稀释的标准桔霉素溶液作最低检测浓度的实验,根据3倍信噪比的峰响应值[14],得出仪器的检出限为0.5μg/L;根据10倍信噪比的峰响应值,得出定量限为2μg/L.

图2 桔霉素标准溶液含量测定标准曲线Fig.2 Citrinin standard curve(fluorescence detector-HPLC)
2.3 单因素实验结果
2.3.1 提取剂对提取率的影响
TEF萃取剂比例不同,对红腐乳样品中桔霉素的提取效果也不同,结果见表1.

表1 不同的萃取剂萃取红腐乳样品的效果比较Tab.1 Effect of different solution on extraction yield of citrinin
从表1可看出,随着乙酸乙酯比例不断提高,对桔霉素的提取率也不断提高,当TEF体积比为1∶9∶1时对桔霉素的提取效果最好,主要是因为提取剂比例不同,极性不同,当提取液的极性与桔霉素极性相似时,提取率达到最高,且提取色素量少,甲苯的用量也低.
2.3.2 料液比对提取率的影响
通过对1∶5至1∶40的料液比进行实验,得出桔霉素的提取效果随料液比的变化趋势,如图3.
由图3可以看出,在料液比由1∶5到1∶15的变化过程中,桔霉素提取率在逐渐升高;当料液比达到1∶15时,桔霉素的提取率达到最高;继续增加提取液的比例,桔霉素的提取率会呈下降趋势.原因可能是当料液比过大时,溶出较多杂质成分,影响桔霉素的提取.

图3 料液比对提取率的影响Fig.3 Effect of thematerial/liquid ratio on extraction yield of citrinin
2.3.3 提取温度对提取率的影响
在30,40,50,60,70℃下,对红腐乳中桔霉素进行提取,结果如图4.
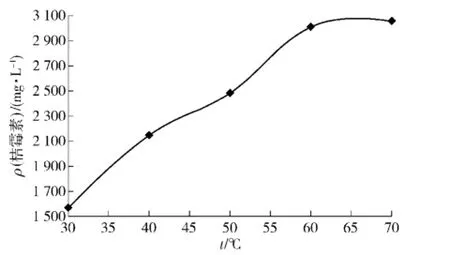
图4 温度对提取率的影响Fig.4 Effect of temperature on extraction yield of citrinin
从图4可以看出,桔霉素的提取率随提取温度的提高呈上升趋势,但30~60℃上升的较快,到70℃时上升趋势变得较缓,与60℃时变化不大,可能长时间的高温会导致部分桔霉素分解.为了最大限度得到桔霉素,选择60℃作为提取的最佳温度.
2.3.4 提取时间与次数对提取率的影响
不同提取时间对提取率的影响很小,所以选择10min作为单次提取时间.在此基础上,提取次数对提取率的影响如图5.
由图5可以看出,增加提取次数,提取量不断升高,但增加量不断减小.以4次提取桔霉素的量为总量,则前3次提取的桔霉素占总量的99.22%,基本上提取完全.不同提取时间对提取率的影响很小,所以选择10min作为单次提取时间.
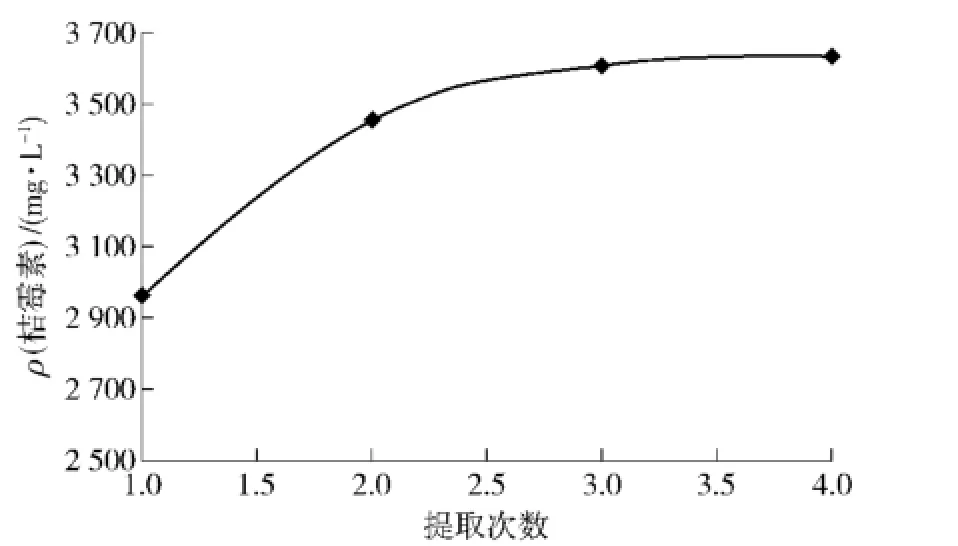
图5 提取次数对提取率的影响Fig.5 Effect of numbers of repeated extractions on extraction yield of citrinin
总结单因素实验结果,腐乳中桔霉素的最佳提取条件为,1 g红腐乳干粉,提取液甲苯∶乙酸乙酯∶甲酸的体积比为1∶9∶1、料液比1∶15、60℃超声10 min,重复提取3次.合并提取液并定容至50mL,取2m L浓缩至干,加入1 mL甲醇溶解,孔径为0.45 μm的有机膜微滤后进行HPLC分析.
2.4 加标回收率实验结果
在已建立的提取条件和色谱条件下,重复测定样品液中桔霉素的含量,计算桔霉素标准品的加标回收率,实验结果见表2.由表2可知,桔霉素平均回收率达到94%,RSD为9.5%.说明实验建立的高效液相色谱的检测方法是切实可行的.

表2 样品加标回收率实验Tab.2 Sample recovery experiment
2.5 精密度实验结果
对同一腐乳样品预处理后,HPLC重复进样6 次,得到的桔霉素峰面积的相应误差如表3.表3表明,本实验具有的重现性良好,色谱条件合理.

表3 精密度数值Tab.3 Value of accuracy test
2.6 实际样品的分析结果
本实验所检测的5种红腐乳中都含有桔霉素,结果见表4,其质量分数为281.08~2548.35μg/kg,其中3种红腐乳中的桔霉素含量明显低于另外两种,可能是由于所用菌种和加工条件的不同而导致.
许赣荣[15]曾经检测了国内外部分企业100多个红曲样品中的桔霉素含量,其质量分数为0.18~1 739.93mg·kg-1,可见大多数红曲中含有桔霉素,但不同厂家的样品含量相差悬殊.红曲又是红腐乳生产不可缺少的辅料之一,因此若想从根本上摆脱桔霉素的困扰,还应从菌种改造方面着手,研究和筛选出不产桔霉素的红曲霉菌株.

表4 不同红腐乳样品中桔霉素的含量Tab.4 Citrinin contents in sofu samples
3 结 论
采用HPLC荧光检测法可以不经过复杂的样品前处理,对红腐乳样品中的桔霉素进行快速准确测定.其在实际样品中的检出限可以达到 12.5 μg/(kg干重),定量限达到50μg/(kg干重).QB/T 2847—2007[16]中功能性红曲米中桔霉素含量(以绝干计)≤50μg/kg,欧盟对桔霉素的限量标准[17]是≤100μg/kg,可见本方法可以满足腐乳样品中桔霉素的快速检测要求.从实际样品的分析结果来看,红腐乳中桔霉素的存在量有高有低,但总体水平还是比较高的,应该引起生产企业和消费者的关注.
[1] Hetherington A C,Raistrick H.Studies in biochemistry ofmicroorganism XI on the production and chemical constitution of a new yellow colouringmatter,citrinin,produced from glucose by Penicillium citrinum Thom[J]. Philosophical Transactions of the Royal Society of London Series B—Biological Sciences,1931,220:269-297.
[2] Balanc P J.Characterization of monascidin A from monascus as citrinin[J].Food Microbiol,1995,27:201 -203.
[3] 鲁银,袁慧.桔青霉毒素细胞毒性及其检测方法研究[J].中国畜牧兽医,2012,39(1):60-63.
[4] 连喜军,卢晓翔,刘勤生,等.桔霉素的定性及定量测定方法研究进展[J].2007,24(11):935-937.
[5] Arevaol F J,Granero A M,Fernandez H,et al.Citrinin (CIT)determ ination in rice samples using amicro fluidic electrochemical immunosensor[J].Talanta,2011,83: 966-973.
[6] Zachetti V G L,Granero A M,Robledo SN,et al.Development of an amperometric biosensor based on peroxidases toquantify citrinin in rice samples[J].Bioelectrochemistry,2013,91:37-43.
[7] 中国疾病预防控制中心营养与食品安全所,江南大学.GB/T5009.222—2008红曲类产品中桔青霉素的测定[S].北京:中国标准出版社,2009:1-5.
[8] 中华人民共和国湖北出入境检验检疫局.SN/ T2426—2010进出口粮谷中桔霉素含量检测方法液相色谱法[S].北京:中国标准出版社,2010:1-10.
[9] 陈蕴,许赣荣,虞慧玲.红曲桔霉素高效液相色谱测定条件的优化[J].食品与发酵工业,2004,30(1): 118-123.
[10] Abrunhosa L,Paterson R R M,Kozakiewicz Z,et al. Mycotoxin production from fungi isolated from grapes [J].Letters in Applied Microbiology,2001,32(4): 240-242.
[11] Odhav B,Naicker V.Mycotoxins in South African traditionally brewed beers[J].Food Additives and Contaminants,2002,19(1):55-61.
[12] Li Xuemei,Shen Xinghai,Xue Lan,etal.A validated RP-HPLC method for the determination of citrinin in Xuezhikang capsule and othermonascus-fermented products[J].E-Journal of Chemistry,2012,9(1):260-266.
[13] 陈蕴,夏永军,许赣荣,等.红曲液态发酵高产色素地产桔霉素的工艺条件[J].食品与发酵工业, 2007,33(10):10-13.
[14] 鲁静,付凌燕,王旭.质量分析方法验证中检出限和定量限测定方法探讨[J].中国药品标准,2012,13 (1):33-35.
[15] 许赣荣.红曲桔霉素的检测及发酵控制技术[D].无锡:江南大学,2004.
[16] 中国食品发酵工业研究院.QB/T 2847—2007功能性红曲米(粉)[S].北京:中国轻工业出版社, 2007:1-9.
[17] 王瑶.食品中桔霉素快速检测方法的研究[D].济南:山东师范大学,2009.
Determ ination of Citrinin Content in Red Sofu by HPLC
LIXiuli, CAO Xueli*
(School of Food and Chemical Engineering/Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients,Beijing Technology and Business University,Beijing 100048,China)
A high performance liquid chromatography(HPLC)method for determination of citrinin in red sofu was developed.The effects of different factors including extracting solvent,material-liquid ratio,extraction temperature,ultrasonic extraction time,and extraction times on the extraction of citrinin were compared.The chromatographic separations was carried on a ODSWondaSil C18(150mm×4.6 mm i.d., 5μm)column by using acetonitrile and 0.03%phosphoric acid(45∶55,v/v),and then was detected by a fluorescence detector atλex=331 nm,λem=500 nm.The results showed that citrinin was completely extracted by toluene-ethyl acetate-formic acid(1∶9∶1,v/v/v)atmaterial-liquid ratio of 1∶15(v/v), ultrasonic extraction 10min at 60℃ for 3 repeated extractions.There was a good linear relationship between the fluorescence detection values and citrinin contents in the range of 0.5-1 000μg/L(R2= 0.999 9).The minimum detectable content of citrinin was 0.5μg/L.The RSD of repeated test was 1.58%.The average recovery with standard was 94%.Thismethod could be used for determining the citrinin content in red sofu products.
citrinin;red sofu;HPLC;fluorescence detection
TS201.3
10.3969/j.issn.2095-6002.2014.04.014
2095-6002(2014)04-0075-06
(责任编辑:叶红波)
李秀利,曹学丽.红腐乳中桔霉素的HPLC-FLD分析方法研究.食品科学技术学报,2014,32(4):75-80. LIXiuli,CAO Xueli.Determination of citrinin content in red sofu by HPLC.Journal of Food Science and Technology, 2014,32(4):75-80.
2013-12-18
国家十二五科技支撑计划项目(2012BAK17B11-4).
李秀利,女,硕士研究生,研究方向为生物分离工程;*曹学丽,女,教授,博士,主要从事生物分离技术方面的研究.通讯作者.
