茶多酚的提取及其对抗生素所致肠道菌群失衡的调整和预防作用
2014-01-10关家伟刘艳艳杨泰浩吴大畅
张 凯,关家伟,季 煜,刘艳艳,杨泰浩,姜 涛,吴大畅
大连医科大学生物技术系,大连 116044
抗菌药物是防治感染性疾病的主要手段,在抗菌药物的临床应用中,过多使用和滥用情况已很突出,抗生素相关性腹泻(AAD)、二重感染等报道日益增多[1]。此外,抗生素滥用加剧细菌耐药已成为全世界面临的严重问题。因此,合理使用抗生素、抗生素-天然产物(主要是益生元)配伍使用及寻找抗生素的替代品用于感染性疾病的治疗具有重要理论和应用价值。
茶多酚(Tea Polyphenols,TP)是茶叶中多羟基酚类化合物的总称,含量约占茶叶干重20%~30%。大量研究表明,TP 具有极强的抗自由基和抗菌、抗病毒、抗肿瘤、防治心血管疾病等作用[2],研究价值和应用前景良好。儿茶素类是TP 的主体组分,约占65%~80%,是其药理作用最为显著的部分,其中表没食子儿茶素没食子酸酯(EGCG)含量最高[3],且其抗自由基等活性也最为突出。茶多酚提取物容易获得且价格低廉,如能够与抗生素联合使用,既达到抗感染的目的,又保证肠道菌群的平衡,将对促进健康、提高全民生活质量具有重要意义。
本实验对茶多酚进行提取,通过HPLC 对茶多酚中有效成分EGCG 进行检测。方法中所使用的均为无毒或毒性较小的试剂,保证后续进行动物体内实验结果的可靠性。传统的培养技术对肠道菌群的检测周期长、灵敏度低、重复性差,而且肠道中大部分微生物属于厌氧或兼性厌氧菌,对培养条件要求极为苛刻,体外培养十分困难。基于此,本实验对文献报道的粪便细菌DNA 提取方法进行了改良,建立了一种简便、快捷、有效的DNA 提取方法,并采用分子微生态学PCR-DGGE(Polymerase Chain Reaction-Denaturing Gradient Gel Electrophoresis)技术评价茶多酚对改善和预防抗生素所致小鼠肠道菌群失衡的作用,以期为进一步推广应用茶多酚提供实验依据和理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级,体重(20 ±2)g 雌性BALB/c 小鼠24只,由大连医科大学实验动物中心提供[动物合格证号:SCXK(辽)2008-0002]。
1.1.2 主要试剂
绿茶(特级,福建当年产);溶菌酶(Amresco,L0663);蛋白酶K(Merck,1245680100);表没食子儿茶素没食子酸酯标准品(批号:100422);头孢拉定(修正药业集团股份有限公司,批号:100608)溶于无菌水,制成25 mg/mL 的头孢拉定溶液;PCR 引物由大连宝生物公司合成,Ex Taq DNA 聚合酶购自大连宝生物公司,丙烯酰胺、甲叉双丙烯酰胺购自美国Sigma 公司;去离子甲酰胺、尿素、四甲基乙二胺(TEMED)、溴化乙锭(EB)等购自上海生物化学试剂工程公司;乙醇(色谱纯),乙腈(色谱纯)。
1.1.3 主要仪器
DCode 变性梯度凝胶电泳系统(大连竞迈生物科技有限公司),PCR2400 循环仪(Thermo,USA),凝胶成像系统(大连竞迈生物科技有限公司),微量核酸蛋白测定仪(NanoVue,USA),FA2004 分析天平(上海越平科学仪器有限公司),CT15RT 高速冷冻离心机(上海天美科学仪器有限公司),电泳仪(大连竞迈生物科技有限公司),PHs-3C 精密pH 计(上海精密科学仪器有限公司),离心浓缩仪(Thermo Scientific ISS110),索氏提取器(上海矩源机械设备有限公司),高效液相色谱仪(Waters 1525 HPLC)。
1.2 方法
1.2.1 茶多酚的提取
[4]方法并加以改进:准确称取30g 茶叶末于索氏提取器中,加入300 mL 70%乙醇,70 ℃条件下回流2 h。移取浓缩后的茶多酚提取液10 mL 于小烧杯中,加入0.415 mol/L ZnCl2水溶液,摇匀,用质量分数15% NaHCO3水溶液调节为pH=6.0,离心得茶多酚—锌盐沉淀,用蒸馏水洗涤沉淀2 次后转移至烧杯中,加入2 倍体积的蒸馏水混匀,再加入2 倍体积的2 mol/L 硫酸溶液,使沉淀物溶解,离心去除少量胶状沉淀。茶多酚酸转移液用15% NaHCO3溶液调节pH=5.0,再用乙酸乙酯在室温下分两次萃取,合并萃取液(20 ℃以下,转溶15 min)。在乙酸乙酯相中加入质量分数为2%的维生素C 水溶液(用柠檬酸调节pH 为3.0),两者体积比为2∶1,洗涤两次。60 ℃减压浓缩酯相,离心浓缩后得到茶多酚粉末。
1.2.2 HPLC 检测茶多酚
精密称取1.2.1 制备的茶多酚粉末100 mg 溶于2 mL 去离子水中,摇匀,经0.45 μm 微孔滤膜过滤,取滤液,即得质量浓度为50 g/L 的供试品溶液。以0.2 mg/mL EGCG 为标准品,处理方法同上。色谱条件:色谱柱:Agilent ZORBAX SB-C18柱(4.6mm×250 mm,5 μm);流动相:A 为2%乙酸水溶液,B为乙腈;梯度洗脱:0~20 min,5%B;20~40 min,30%B;40~50 min,70%B;50~55 min,100%B;柱温:30 ℃;检测波长:280 nm;流速:0.8 mL/min;进样量:20 μL。茶多酚主要成分的定量分析结果通过和标准品检出时间和波峰的峰面积对比得到。
1.2.3 小鼠模型的建立与样品采集
将24 只BALB/c 小鼠随机均分4 组。分别为正常对照组(0.2 mL/d 的蒸馏水连续灌胃7 d)、失调模型组(头孢拉定0.2 mL/d 连续灌胃7 d)、治疗组(头孢拉定0.2 mL/d 的剂量连续灌胃7 d 后以0.5 g/Kg/d 量的茶多酚灌胃7 d)和预防组(与治疗组相反药物使用顺序灌胃)。于四组小鼠最后一天灌胃后采集洁净无污染的粪便一次,-80 ℃保存,备用。
1.2.4 粪便样品的预处理
称取0.1 g 粪便于无菌Ep 管中,加入1 mL PBS(pH 7.4),旋窝震荡混匀,200 g 离心5 min,取上清(冰水浴)。向沉淀中加入1 mL 的PBS,重复上述步骤。混合两次上清,用300 g 离心5 min,弃沉淀。上清用10000 rpm 离心8 min,沉淀菌体。以PBS 洗涤至上清无色。-20 ℃过夜保存。
1.2.5 粪便细菌总DNA 的提取
参照郑刚等[5]改进溶菌酶法并加以优化,对粪便细菌总DNA 进行提取:取样品加入0.8 mL 溶菌酶溶液(10 mg/mL),10 μL 蛋白酶k(20 mg/mL),混合物在37 ℃摇床下200 rpm 震荡1 h。加入经65℃预热的0.3 mL 裂解液(10%十二烷基磺酸钠、0.1mL NaCl、0.5 mol/L Tris-HCl,pH 8.0),0.3 mL磷酸盐缓冲液(pH 8.8),0.6 mL 氯仿-异戊醇(体积比24∶1),65 ℃水浴10min,每隔2~3 min 上下颠倒震荡30 s。5000 rpm 离心3 min 后小心吸取上清转入另一2 mL 离心管中,并加入0.6 倍体积的异丙醇,冰水浴沉淀15 min。然后12000 rpm 离心10 min,弃去液相,沉淀以75%乙醇(4 ℃预冷)1 mL 轻微震荡洗涤,4 ℃条件下13000 rpm 离心2 min,待乙醇彻底挥发后,加入100 μL TE 缓冲液溶解DNA。取1 μL 于微量核酸蛋白测定仪上测定其DNA 浓度,并通过1%琼脂糖凝胶(含EB 0.5 g/mL)电泳检测其质量。于-20 ℃保存备用。
1.2.6 16S rRNA 片段的PCR 扩增
利用通用引物扩增所有细菌16S rRNA 基因的V3 可变区,引物设计时需在上游引物5'端加上GC夹。通用引物以及GC 夹的序列如下[6]:
上游引物:GC-341F(5'-CGCCCGGGGCGCGCCCCGGGCGGGGCGGGGGCACGGGGGGCCTACGGG AGGCAGCAG-3')(粗体部分为40bp“GC 夹”)
下游引物:518R(5'-ATTACCGCGGCTGCTGG-3')
扩增体系(25 μL)为:10 × Ex PCR Buffer(Mg2+plus)5 μL,dNTP mixture 4 μL,1% BSA(1 mg/mL)2.5 μL,20 μmol/L 的上下游引物各0.5 μL,5 U/μL Ex Taq DNA 聚合酶0.25 μL,总DNA 2 μL 作为模板,ddH2O 10.25 μL 补充体系至25 μL。PCR 反应条件:95 ℃,5 min;30个循环(94 ℃30 s,54 ℃30 s,72 ℃30 s);72 ℃7 min。PCR 产物经1%琼脂糖凝胶电泳检测,-20 ℃保存。
1.2.7 DGGE 电泳分析
参照Walter J 等[7]方法,对1.2.6 获得的16S rRNA 基因的V3 可变区的扩增产物进行DGGE 电泳。DGGE 采用8.0%聚丙烯酰胺凝胶,变性梯度为30%~50%(100%变性剂溶液包括40%去离子甲酰胺和7M 尿素)。电泳温度为60 ℃,以100 V 电压预电泳10 min,再将电压调至40 V,电泳5 h。电泳完毕后,进行EB 染色,利用Phoretix 1D(Phoretix,Newcastle upon Tyne,UK)软件分析PCR-DGGE 胶图谱[8]。包括条带数目、灰度值以及通过聚类分析显示DGGE 图谱的相似性,各条带的聚类分析应用UPGMA 算法进行分析。利用Shannon-Weaver index(H’)计算条带的多样性。并采用均匀度Evenness(E)分析菌群分布的统一性,由于数据不服从正态分布,故利用非参数统计分析U 检验。H’和E 通过以下公式获得:Shannon-Weaver index (H’)=-∑(Pi)(In Pi),Evenness (E)=H’/InS,其中Pi=ni/N,ni 为单个条带的灰度值,N 为所有条带的灰度值,S 为样品条带数目。
1.2.8 DGGE 图谱中部分优势条带的序列分析
切下DGGE 图谱中清晰且亮度高的条带,放入Ep 管中捣碎,加入50 μL 去离子水-20 ℃过夜。90℃水浴10 min,离心(10000 g,5 min)。以上清液为模板,利用无GC 的V3 区引物341F 和518R,再次进行PCR 反应,反应条件同1.2.6,1%琼脂糖电泳确认是否出现单一条带。PCR 产物由Invitrogen(北京公司)测序,测序结果经DNAStar 软件分析,所得序列在GenBank 数据库中进行Blast 比对分析。
2 实验结果
2.1 茶多酚的提取
HPLC 检测结果如图1 所示,EGCG 的保留时间约为13.5 min,各峰分离度较好。由样品色谱图(A)可见,所提取的茶多酚原料中除EGCG(主峰)外,还有其他色谱峰,可能为表儿茶素没食子酸(ECG)等成分,这也与前言所述理论相符,提示茶多酚的提取效果比较好,能够进行后续实验。以样品EGCG 峰面积与标准品峰面积之比及公式[EGCG 含量(%)=测得的EGCG 平均含量/茶多酚质量×100%]换算出TP 中EGCG 百分含量为42.67%。
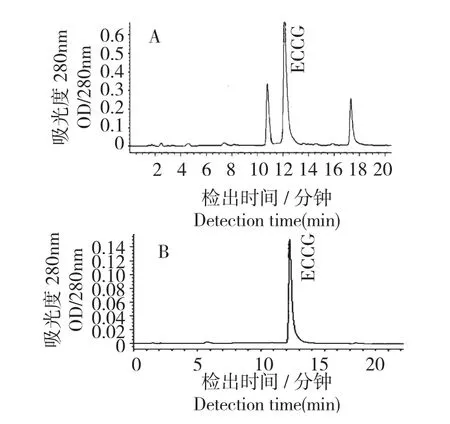
图1 茶多酚样品(A)及EGCG 标准品(B)的HPLC 图谱Fig.1 HPLC chromatograms of Tea Polyphenols (A)and EGCG standard (B)
2.2 粪便细菌总DNA 的提取
使用改进溶菌酶方法提取的细菌总DNA 用1%琼脂糖电泳后可在紫外灯下看到清晰的单一条带,且亮度较强,偶见上样口有少许亮带(图2),分析可能是由于在提取的过程中蛋白没有除净,这也与表1 中OD260nm/OD280nm小于1.8,提示有蛋白污染结果吻合。该污染经证实对PCR 影响较小,可进行后续实验。
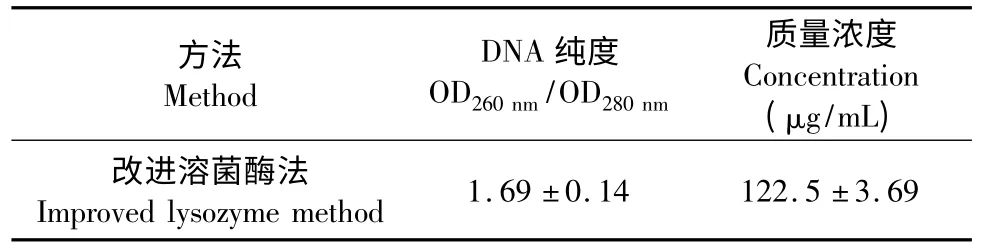
表1 DNA 纯度和浓度检测结果Table 1 Detection of DNA purity and concentration

图2 粪便细菌基因组提取结果Fig.2 Extraction results of total DNA of fecal microorganism
2.3 16S rRNA 目的基因的PCR 扩增
利用通用引物扩增各组小鼠肠道细菌16S rRNA V3 区基因。目的条带片段长度约200bp(图3)。

图3 V3 区16S rRNA 基因扩增Fig.3 PCR amplification of V3 region of 16S rRNA gene
2.4 DGGE 图谱分析
各实验组小鼠肠道菌群的DGGE 图谱显示,各泳道的均匀性较好(表2),通过香农指数Shannon-Weaver indexes (H’)比较肠道菌群种类的多样性差异(表2,图4、5),图谱主要分为两簇:第一簇是泳道1、4、5;第二簇是泳道2 和3;簇间具有较高的相似度。结果提示经抗生素致失衡后小鼠肠道菌群发生显著改变(P<0.05),茶多酚预防与治疗后与正常对照组比较差异明显减小,菌群多样性基本一致。
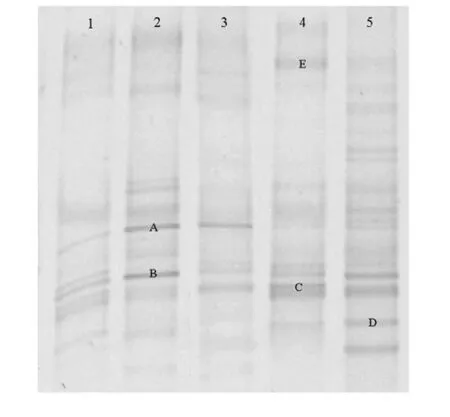
图4 各实验组DGGE 图谱Fig.4 DGGE profiling of different experiment group

表2 各实验组微生物多样性分析Table 2 Microbiota diversity index analysis of each group

图5 各组小鼠肠道菌群UPGMA 相似性聚类分析Fig.5 Dendrogram of DGGE profiles analyzed by UPGMA method
2.5 测序结果分析
对DGGE 图谱中的主要差异条带进行测序,所得结果在GenBank 数据库中进行Blast 比对和同源性比较,结果如表3。
3 讨论
人体是一个巨大的微生态系统,尤其肠道菌群的平衡对机体健康具有重要意义,如:促进消化,抵御致病菌侵袭,营养物质的代谢吸收、维生素的摄取,增强机体免疫力等。多种因素可以导致肠道菌群失衡,如精神压力、饮食、服用某些药物等。临床上,长期大量使用抗生素进行治疗的患者极易造成肠道菌群的失调,因此寻找一种有效且副作用小的治疗与预防药物具有十分重要的意义。

表3 DGGE 主要差异条带分析结果Table 3 Identification by sequence of V3 fragments excised from DGGE dominant bands of total microbial community
本实验对茶多酚的提取以及其对抗生素所致肠道菌群失调的调整和预防作用进行了研究,结果表明,使用ZnCl2沉淀,乙酸乙酯进行萃取的方法可以有效的对茶叶中的茶多酚进行提取,且HPLC 检测茶多酚中的有效成分EGCG 的含量可达42.67%。使用自主改进的溶菌酶方法对粪便中细菌总DNA提取效果显著,后续实验中,基因组中16S rRNA 片段可有效进行PCR 扩增。DGGE 图谱分析显示,使用抗生素作用小鼠后,电泳条带数量和强度都有明显变化,提示肠道菌群的丰富度与多样性改变,证明抗生素的使用导致肠道内环境发生改变,引起菌群紊乱。茶多酚作用后,小鼠肠道菌群失调状况有所纠正,并且由UPGMA 相似性聚类分析可知预防组在给茶多酚后再用抗生素致紊乱,发现其肠道菌群和正常组肠道菌群的相似度最高,说明茶多酚预防作用效果良好,并优于治疗作用。对于茶多酚发挥作用的确切靶细菌,DNA 测序及比对分析提示主要有:费克蓝姆菌、产黑色普雷沃菌、酵单胞菌、亚硝化螺菌、拟杆菌。已有研究表明,拟杆菌是肠道绝对优势菌,这种优势菌通过自身的定植直接抑制其他有害菌群的黏附,而且在菌群失调时重新引入拟杆菌,可以尽快使宿主肠道内微生态体系恢复平衡状态[9],本研究结果表明茶多酚可以发挥益生元的作用促进肠道益生菌的增殖,进而促进肠道菌群平衡的重建。
茶叶中的茶多酚廉价易得,且属于天然产物,对机体的毒副作用小,因此具有极大的商业价值。本实验进一步证明了茶多酚在肠道菌群失衡中的作用,为其在临床治疗上的应用提供了一定的理论基础。相信茶多酚在工业生产以及临床上会有更加广阔的应用前景。
参考文献
1 Zhou XY(周雪艳).Pathogenesis of antibiotic associated diarrhea.Chin J Microecol(中国微生态学杂志),2004,16:376.
2 Wang JS,Luo HT,Wang PW,et al.Validation of green tea polyphenol biomarkers in a phase II human intervention trial.Food Chem Toxicol,2008,46:232-240.
3 Wang D(王东),Sui LH(隋丽华),Li N(李楠),et al.Study on quality standard for compound tea polyphenols liniments.Chin New Drugs J(中国新药杂志),2007,16:1879-1881.
4 Hu LJ(胡莉娟).Technical research of tea polyphenols extraction from green tea.J Yunnan Agric Univ (云南农业大学学报),2011,26:426-429.
5 Zheng G(郑刚),Chen YR(陈己任),Hu BW(胡博文),et al.Genomic DNA extraction from rat faecal and intestinal microflora based on DGGE analysis.Bioengineering(生物工程),2011,32:215-218.
6 Li XL(李新莉),Wu DC(吴大畅),Zhang CL(张翠丽),et al.The effects of roxithromycin on the intestinal microbiota of BALB/c mice.Chin J Antibiotics (中国抗生素杂志),2012,37(3):S4-S7.
7 Walter J,Tannock GW,Tilsala-Timisjarvi A,et al.Detection and identi?cation of gastrointestinal Lactobacillus species by using denaturing gradient gel electrophoresis and speciesspeci?c PCR primers.Appl Environ Microbiol,2000,66:297-303.
8 Gavin PG,Victoria SL,Graham JR,et al.Statistical analyses of complex denaturing gradient gel electrophoresis profiles.J Clin Microbiol,2005,43:3971-3978.
9 Li YD(李亚丹),Ren HW(任宏伟),Wu YB(吴彦彬),et al.Bacteroides and gut microbial ecology.Microbiol (微生物学通报),2008,35:281-285.
