吉西他滨不同输注法联合奥沙利铂方案治疗进展期胰腺癌的疗效评价
2014-01-09徐丽娟宋亚颀惠红霞陈小飞
刘 华,徐丽娟,宋亚颀,惠红霞,陈小飞
(南京医科大学附属淮安第一医院肿瘤内科,江苏 淮安223300)
胰腺癌是较为常见的消化系统肿瘤之一,由于病变隐蔽,早期诊断困难[1],临床80% ~90%以上胰腺癌患者就诊时已无法行手术切除,5 年生存率仅为5%[2]。对于手术无法切除及转移性胰腺癌患者,化疗是可供选择的治疗手段之一。吉西他滨单药已取代5-Fu 作为进展期胰腺癌的标准一线化疗方案[3]。虽然目前30 min 吉西他滨静滴方案被普遍认为是常规的胰腺癌吉西他滨化疗方案,但2014NCCN 指南中,固定剂量率吉西他滨用药方案也做为IIB 证据被提及。本研究对吉西他滨固定剂量率输注法与标准输注法联合奥沙利铂方案治疗进展期胰腺癌疗效及安全性进行了探讨,为进一步提高进展期胰腺癌治疗疗效,优化化疗方案,提供更好、更高的循证医学证据。
1 对象与方法
1.1 研究对象 选取2010 年1 月至2013 年12 月在南京医科大学附属淮安一院经临床及影像学诊断为无手术指征或转移性胰腺癌患者共90 例,按1997 年国际抗癌联盟(UICC)TNM 标准进行分期。初治、胰腺癌临床TNM 分期Ⅲ/Ⅳ期、PS 评分0 ~2分、预计生存期≥3 个月的患者入组本研究。所有病例先前未接受过化疗及放疗;治疗前患者无化疗禁忌证,临床指标符合外周血白细胞≥4.0×109/L、血小板≥100×109/L;无明显的肝、肾功能损害;如伴胆道梗阻者经行PTCD 或ERCP 后黄疸指数≤1.5 倍正常值、转氨酶≤2.5 倍正常值者;心电图正常。所有病例均有可测量的临床肿瘤客观评价病灶。入选所有患者均签署化疗知情同意书。
入组90 例患者临床资料均完整,且符合疗效评价标准。采用随机方法分为研究组(46 例)和对照组(44 例)。其中,男59 例,女31 例;年龄51 ~75岁,中位年龄64 岁;病变位于胰头者43 例,其中伴胆道梗阻者19 例,胰腺体、尾部47 例;Ⅲ期58 例,Ⅳ期32 例。治疗前两组患者的年龄、性别、临床分期及PS 评分具有均衡性,差异均无统计学意义(P>0.05),见表1。
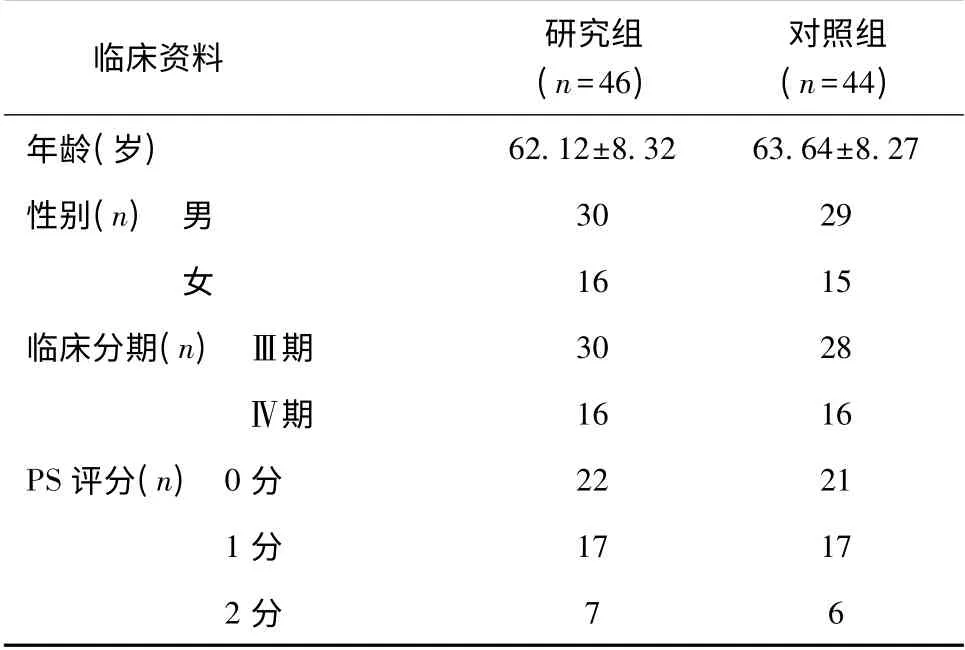
表1 两组患者临床资料比较
1.2 治疗方法 两组均给予奥沙利铂130 mg/m2,避光维持3 h d1。在此基础上,研究组以吉西他滨1000 mg/m2按10 mg/(m2·min)固定剂量率恒速静脉输注,d1、d8;对照组以吉西他滨1000 mg/m2静脉输注30 min,d1、d8,每21d 重复,每2 周期评价1次疗效,每例患者接受4 周期,至少2 周期化疗。化疗前均常规给予5-HT3 受体拮抗剂止吐,视情况及有无禁忌证,酌情使用地塞米松。治疗中出现Ⅲ、Ⅳ度骨髓抑制时预防性应用抗生素、G-CSF 或IL-11,必要时输血处理。
1.3 疗效评价 疗效评价按照实体瘤疗效评价标准1.1 版(RECIST 1.1),分为完全缓解(CR),部分缓解(PR),稳定(SD)和进展(PD)。CR+PR 为客观缓解率(ORR),CR+PR+SD 为临床获益率。胰腺癌患者临床受益反应(clinical benefit response,CBR)指对疼痛、体力状况及体重改变做出评估,其评判标准为凡符合下列任一项指标(持续4 周以上),并无任一项恶化者,定义为临床受益反应者:①疼痛强度减轻≥50%;②镇痛药物用量减少≥50%;③体力状况改善≥20 分(Karnofsky 评分);④如疼痛程度及体力状况均稳定,而非体液滞留时体重增加≥7%。所有患者每一化疗周期结束后均按照NCI-CTC 标准对血液学及非血液学毒副反应进行评价、分级。
1.4 统计学方法 采用SPSS 13.0 统计软件包,计数资料组间比较采用卡方检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组近期疗效比较 90 例患者共完成346 周期数化疗,其中研究组178 周期数,对照组168 周期数。完成4 周期化疗83 例,完成2 周期化疗7 例(研究组3 例、对照组4 例)。研究组ORR、临床获益率及CBR 均优于对照组,差异有统计学意义(P<0.05),见表2。
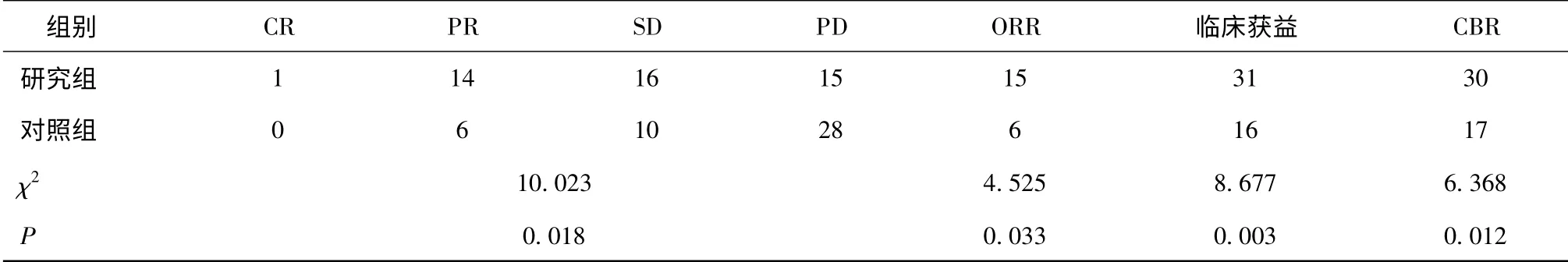
表2 两组化疗效果比较 (n)
2.2 两组化疗毒副反应比较 研究组患者主要化疗毒副反应表现在血液学方面,其中Ⅲ~Ⅳ度白细胞、血小板减少发生率分别为16.85%(30/178)和14.61%(26/168),明显高于对照组(P<0.05);而血红蛋白下降以及非血液学毒副反应与对照组差异无统计学意义(P>0.05),见表3。
3 讨论
一直以来吉西他滨是治疗胰腺癌最有效的化疗药物之一,而含吉西他滨的多药化疗方案是目前治疗胰腺癌最有效的方案。尽管如此,含吉西他滨方案药物治疗胰腺癌的效果仍不理想。吉西他滨联合奥沙利铂(GEMOX)方案对于体能状态良好者较单药吉西他滨更具有生存优势,但其总生存时间(OS)及至肿瘤进展时间(TTP)亦仅为9.0 月、5.8 月,与单药吉西他滨比较无统计学意义[4]。此外,吉西他滨联合厄罗替尼较单药吉西他滨获得了统计学差异,但其中位生存时间仅为6.34 月,1 年生存率23%[5]。在吉西他滨联合厄罗替尼基础上联用抗血管的贝伐单抗虽改善了中位TTP,而OS 并没有获得统计学差异[6]。如何提高进展期胰腺癌化疗疗效,是目前临床研究的热点和难点。
吉西他滨是一种具有独特作用机制和毒性反应特点的新型抗嘧啶核苷酸代谢化疗药物,作用于DNA 的合成期和晚Gl 期,并可阻止细胞由Gl 期进人S 期[7]。有文献报道增加剂量不会增加治疗指数,故延长输注时间,增加细胞内浓度或维持更长时间的有效血药浓度,对增加药物的有效性有显著的临床意义[8,9]。国外临床研究评价了吉西他滨延长输注时间治疗恶性肿瘤的可行性及有效性[10,11]。Soo 等[10]以吉西他滨联合卡铂方案治疗15 例晚期非小细胞肺癌患者,3 种剂量的吉西他滨(300、750、900 mg/m2)以固定剂量率给药,发现血浆药物浓度虽均未达到稳定状态,但所有患者在给药后20 ~90 min 内血药浓度维持在有效抗肿瘤浓度10 μmol/L以上,从而提高了治疗效果,且血液学与非血液学毒性均可耐受。
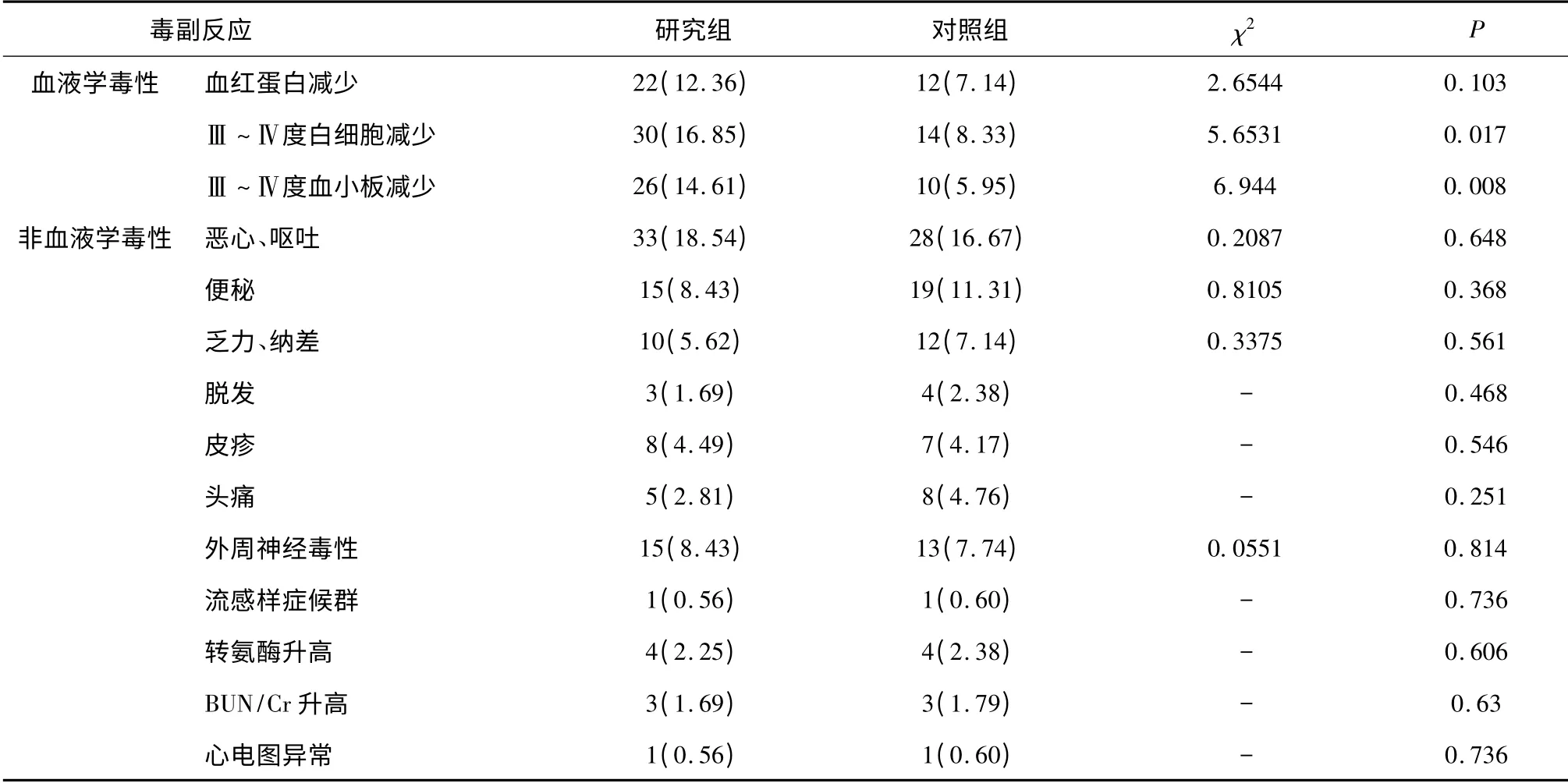
表3 两组Ⅲ~Ⅳ度化疗毒副反应发生率比较 [n(%)]
近年的一些研究表明:当吉西他滨以固定剂量率(fixed dose rate,FDR)即10 mg/(m2·min)速度输注时,血浆吉西他滨浓度维持在15 ~20 μmol/L水平,使细胞内活性成份吉西他滨三磷酸盐达到最高浓度,从而提高治疗效果。而标准30 min 输注时吉西他滨代谢酶由于过饱和反而影响了细胞内吉西他滨三磷酸盐的累积使临床疗效降低[12~14]。因此,通过改变吉西他滨的用药方法,即FDR 有可能提高进展期胰腺癌化疗疗效。
基于吉西他滨独特药代动力学及作用机理,同时可增加铂类化疗药物与DNA 嵌合的稳定性,并抑制DNA 损伤后的修复,故与铂类化疗药物之间有协同作用,两者间并无交叉耐药,毒副反应重叠部分少[15]。因此GEMOX 方案成为进展期胰腺癌标准、一线方案。本研究采用随机对照方法,比较同等化疗剂量下,吉西他滨固定剂量率输注法GEMOX 与吉西他滨标准输注(30 min)联合奥沙利铂方案的疗效及不良反应。结果显示研究组ORR、临床获益率及CBR 均显著优于对照组,二者比较差异有统计学意义(P<0.05);而在毒副反应方面,由于延长了吉西他滨输注时间,研究组血液学毒性,特别是Ⅲ~Ⅳ度白细胞、血小板下降发生率显著高于对照组,差异有统计学意义(P<0.05),经应用粒细胞集落刺激因子、白细胞介素11 以及输注血小板,均能恢复至正常范围,无相关死亡病例发生。而在血红蛋白下降以及非血液学毒副反应发生率二者比较差异无统计学意义(P<0.05)。
综上所述,采用吉西他滨联合奥沙利铂方案治疗进展期胰腺癌,固定剂量率输注具有较高的客观缓解率、临床获益率及临床受益反应;非血液学毒副反应较轻,患者耐受性较好。值得在临床上进一步研究应用,但其血液学毒性较为显著,需引起足够重视,以便获取更好、更高的循证医学证据。
[1]Siegel R,Ma J,Zou Z,et al. Cancer statistics[J]. Cancer J Clin,2014,64(1):9-29.
[2]Huguet F,Girard N,Guerche CS,et al. Chemoradiotherapy in the management of locally advanced pancreatic carcinoma:aqualltative systematic review[J].J Clin Oncol,2009,27:2269-2277.
[3]Burris HA,Moore MJ,Andersen J,et al. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer.a randomized trial[J].J Clin Oncol,1997,15:2403-2413.
[4]Louvet C,Labianca R,Hammel P,et al.Gemcitabine in combination with oxaliplatin compared with gemcitabine alone in locally advanced or metastatic pancreatic cancer:results of a GERCOR and GISCAD phase III trial[J].J Clin Oncol,2005,23:3509-3516.
[5]Moore MJ,Goldstein D,Hamm J,et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer:a phase III trial of the National Cancer Institute of Canada Clinical Trials Group[J].J Clin Oncol,2007,25:1960-1966.
[6]Vervenne W,Bennouna J,Humblet Y,et al. A randomized,doubleblind,placebo(P)controlled,multicenter phase III trial to evaluate the efficacy and safety of adding bevacizumab(B)to erlotinib(E)and gemcitabine(G)in patients(pts)with metastatic pancreatic cancer[J].J Clin Oncol,2008,26:4507.
[7]Hertel LW,Bonder GB,Stakroin JS,et al.Evaluation of the antitumor activity of gemcitabine[J].Cancer Res,1990,50:4417-4422.
[8]Tempero M,Plunkett W,Ruiz VHV,et al.Randomized phase II comparison of dose-intensive gemcitabine:thirty-minute infusion and fixed dose rate infusion in patients with pancreatic adenocarcinoma[J].J Clin Oncol,2003,21:3402-3408.
[9]Soo RA,Wang LZ,Tham LS,et al.A Multicentre randomised phase II study of carboplatin in combination with gemcitabine at standard rate or fixed dose rate infusion in patient with advanced stage non-smallcell lung cancer[J].Ann Oncol,2006,17:1128-1133.
[10]Maurel J,Zorrilla M,Puertolas T,et al. Phase I trial of weekly gemcitabine at 3-h infusion in refractory,heavily pretreated advanced solid tumors[J].Anticancer Drugs,2001,12:713-717.
[11]Spath-Schwalbe E,Genvresse I,et al.Phase II trial of gemcitabine in patients with pretreated advanced soft tissue sarcomas[J].Anticancer Drugs,2000,11:325-329.
[12]Gelibter A,Malaguti P,Di Cosimo S,et al. Fixed dose rate gemcitabine infusion as first line treatment for advanced-stage carcinoma of the pancreas and biliary tree[J].Cancer,2005,104:1237-1245.
[13]Bengala C,Guarneri V,Giovannetti E,et al. Prolonged fixed dose rate infusion of gemcitabine with autologous haemopoietic support in advanced pancreatic adenocarcinoma[J].Br J Cancer,2005,93:35-40.
[14]Sun W,Haller D. Irinotecan and fixed dose rate gemcitabine in advanced pancreatic and biliary cancer:phase I study[J].Oncology,2003,17:16-19.
[15]van Moorsel CJ,Pinedo HM,Veerman G,et al.Mechanisms of synergism between cisplatin and gemcitabine in ovarian and non-small cell lung cancer cell lines[J].Br J Cancer,1999,80:981-990.
