黑荆人工林植被稀少的成因
——基于植物化感作用的研究
2013-12-28黄新会史晓莹于福科
何 勇,黄新会 ,史晓莹 ,于福科 ,夏 虹
(1.西南林业大学 环境科学与工程学院,云南 昆明 650224;2. 云南大学生命科学学院 环境科学与生态修复研究所,云南 昆明 650091)
黑荆人工林植被稀少的成因
——基于植物化感作用的研究
何 勇1,黄新会1,史晓莹1,于福科2,夏 虹1
(1.西南林业大学 环境科学与工程学院,云南 昆明 650224;2. 云南大学生命科学学院 环境科学与生态修复研究所,云南 昆明 650091)
从植物化感作用的影响与效应入手,研究了黑荆Acacia mearnsii人工林植被稀少的成因。用室内生物模拟实验法,测定了黑荆叶片的水提液原液(料液比1∶50)及其5倍、10倍、15倍稀释液对受体植物紫茎泽兰Ageratina adenophora、白三叶Trifolium repens、大叶桉Eucalyptus robusta、赤桉Eucalyptus camaldulensis的种子萌发和幼苗生长的干扰作用。实验结果表明:黑荆叶片水提液原液及其稀释液对四种受体植物的种子萌发及幼苗生长均存在抑制作用,综合效应指数SEI介于-0.246到-0.002。其中,对紫茎泽兰及白三叶的抑制作用有较明显的规律性,抑制作用随着处理液稀释倍数增加而减弱,原液对紫茎泽兰的抑制作用的SEI达到-0.246;对大叶桉、赤桉的抑制作用没有规律性,原液和10倍稀释液处理组的抑制作用较其他两组明显,5倍稀释液处理大叶桉的SEI值为-0.002。得出研究结论:黑荆人工林植被稀少可能是黑荆植株水溶物的化感作用所致。
黑荆人工林;植被稀少成因;植物化感作用
过去几十年来,我国在林木引种方面取得了巨大成就[1]。据统计,我国已引进外来树种超过1 700种。这些树种在带来巨大经济效益的同时,也带来了生态安全隐患[2]。在入侵我国的有害植物中,有58%是以食用、药用、园林绿化、农林业生产等目的引入却未能对其有效管理和控制造成的[3],引种不当或管理不当所导致的严重生态后果如生物多样性下降等已在不少地区凸现,尽快探索和认知物种引入对本地物种的影响与发生机制已成为区域环境保护与生态恢复的迫切需求。
黑荆Acacia mearnsii为含羞草科金合欢属植物,原产于澳大利亚,于上世纪50年代引入我国。因其具有良好的经济效益,在我国南方各省大面积栽培。有报道指出,黑荆在国外有很长的入侵历史,已在南非和津巴布韦等地形成入侵,被列为世界100种恶性外来入侵物种之一[4]。国内有研究发现,黑荆纯林物种丰富度低于其他人工林群落[5]。笔者在云南也多次观察到黑荆纯林内植被稀少的现象。导致这一现象的原因可能是多方面的,如植物间的化感作用、植物间的竞争能力、植物对自然环境的适应能力等。由于植物化感作用已被证实是许多外来入侵植物成功入侵的“Novel weapon”[6],如豚草Ambrosia artemisiifolia[7]、一年蓬 Erigeron annuus[8]、紫茎泽兰Ageratina adenophora[9]、加拿大一枝黄花Solidago canadensis[10]等通过释放化感物质来抑制新生境的植物,影响本地植物群落结构及其演替,从而排挤其他植物,形成单优势群落。化感作用也是植物在竞争中取胜的利器之一[11]。基于此,本研究选择从植物化感作用的角度,采用室内生物模拟实验,探索黑荆人工林植被稀少的成因,以期为黑荆人工林生态退化成因的科学识别及其科学管理和持续经营等提供理论依据。
1 材料与方法
1.1 实验材料收集与预处理
1.1.1 实验材料收集
本研究选用黑荆叶片作为实验供体,选用紫茎泽兰Ageratina adenophora、白三叶Trifolium repens、 大 叶 桉Eucalyptus robusta及 赤 桉Eucalyptus camaldulensis种子作为实验受体。黑荆叶片于2012年3月采自昆明市金殿公园后山,紫茎泽兰种子于2012年4月采集于西南林业大学树木园,白三叶、赤桉和大叶桉的种子均购自种子市场。
1.1.2 实验材料预处理
实验前,将采集的黑荆叶片晾干并研磨成粉末待用,并对四种受体种子进行甄选和预处理,即分别选取颗粒饱满、大小一致的种子,用0.1%NaClO溶液消毒10 min,再用蒸馏水冲洗3遍备用。
1.2 生物模拟实验布设
1.2.1 黑荆叶片水提液的制备
取一定质量的黑荆叶片粉末置于100 mL的锥形瓶,按料液比1∶50添加蒸馏水,封口后将其置于振荡器中处理30 min,再静置2 h后用定性滤纸过滤,滤液即为水提液原液(1 ×),再取部分原液用配制5倍稀释液(5 ×)、10倍稀释液(10×)、15倍稀释液(15 ×)。
1.2.2 生物模拟实验布设与观测
生物模拟实验分为种子萌发模拟实验和幼苗生长模拟实验,均采用培养皿滤纸法[12]完成。种子萌发模拟实验:取直径为10 cm的玻璃培养皿40个,将其洗净并置于80 ℃烘箱烘干,冷却后分成4组,组号分别为Ⅰ、Ⅱ、Ⅲ、Ⅳ;在每个培养皿底层铺设两张直径为9 cm的定性滤纸;用移液枪向铺设滤纸的培养皿注入某一浓度的黑荆叶片水提液3 mL,每组培养皿中,注入同一浓度水提液的培养皿有2个,另有2个培养皿注入蒸馏水作为对照(CK);向组号为Ⅰ、Ⅱ、Ⅲ、Ⅳ的四组培养皿分别放入紫茎泽兰、白三叶、大叶桉、赤桉的种子,每个培养皿中放入种子数量为30粒(圆形滤纸均分为3个扇区,每个扇区均匀放置10粒种子);将布设好种子的培养皿放入恒温培养箱(温度25℃,湿度80%)培养,每隔1 d观察并记录种子的发芽数(以胚根突破种皮为发芽标准),同期向培养皿内的滤纸补充蒸馏水以保持湿度整个实验重复2次。
幼苗生长模拟实验:预先将四种受体种子置于添加蒸馏水的培养皿中进行预发芽,取已发芽的种子为实验材料进行幼苗生长模拟实验,实验设计与种子萌发实验相同,在幼苗生长模拟实验布设后第7 d用电子游标卡尺测量幼苗的胚根长及胚轴长,整个实验重复2次。
1.3 测试指标及计算方法
1.3.1 种子萌发和幼苗生长指标
种子萌发测试指标采用发芽率、发芽指数,二者分别采用公式计算,如下。
发芽率(%)=(发芽种子总数/供试种子总数)×100%;发芽指数式中,G表示在时间t日的发芽数,Dt表示相应的发芽日数。
幼苗生长指标采用直接测定的方法测定胚根长度和胚轴长度(mm)。
1.3.2 化感效应指数
化感效应指数包括单一指标的化感效应指数(RI)和多指标综合化感效应指数(SEI)。
单一指标的化感效应指数(RI)[13]按下式计算:RI=1- C/T(当T≥C时)或 RI= T/C-1(当T<C时)。式中,C为对照值,T为处理值。RI>0为促进作用,RI<0为抑制作用,RI的绝对值越大,其化感作用潜力(促进或抑制作用)越大。
多指标综合化感效应指数(SEI)[14]为供体对同一受体4个测试项目的化感效应指数的算术平均值,综合效应指数有正值和负值,正值表示促进作用,负值表示抑制作用,对照值为0。对实验统计的种子萌发和幼苗生长指标,采用SPSS11.5统计软件作平均值、标准差计算及其差异显著性分析。
2 结果与分析
2.1 黑荆叶片水提液对四种受体植物种子萌发的影响
黑荆叶片水提液在不同浓度条件下对四种受体植物种子萌发的影响见表1。
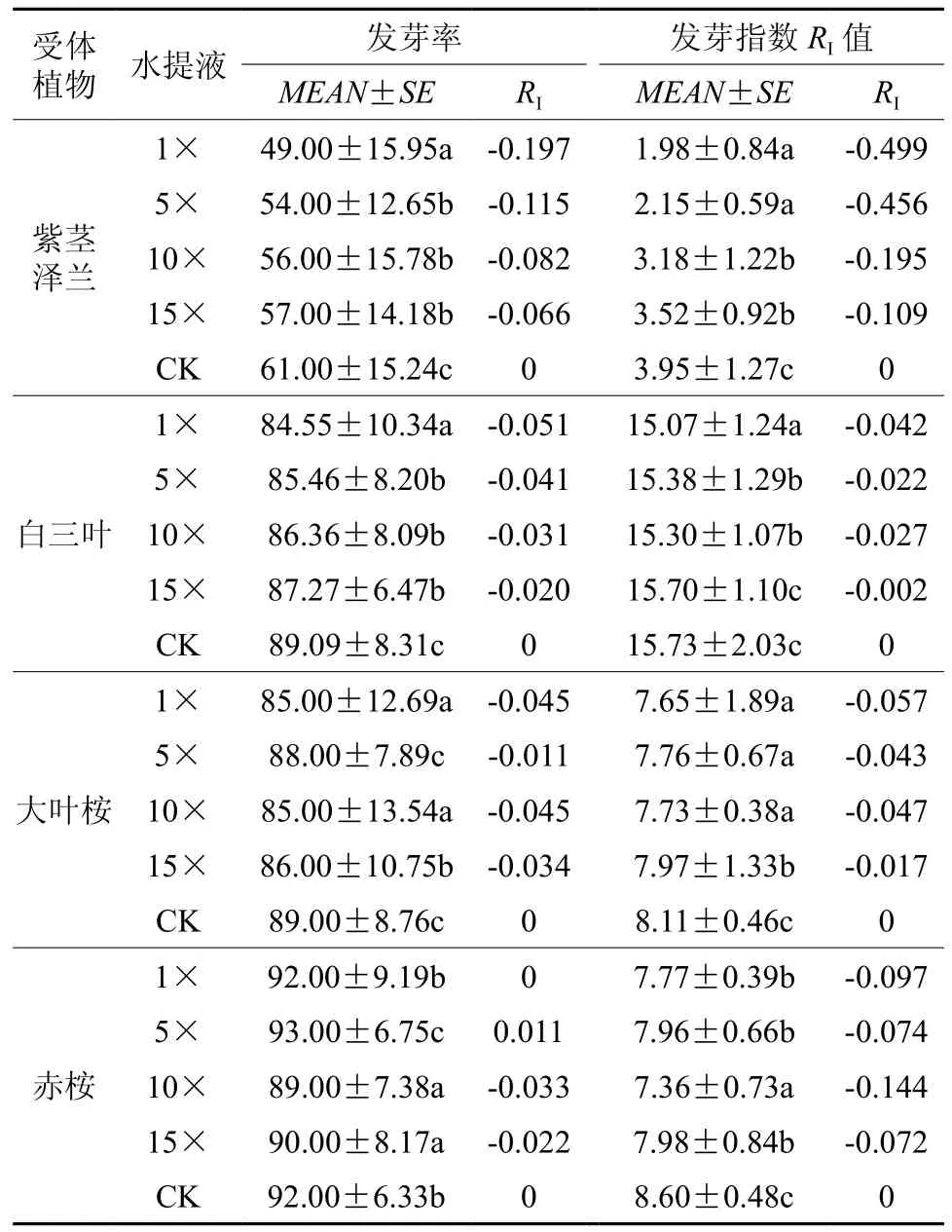
表 1 黑荆叶片水提液对四种植物种子萌发的影响†Table 1 Allelopathic effects of leaf water extract from Acacia mearnsii on seed germination of four plant species
据表1分析,黑荆叶片不同浓度水提液对四种受体植物种子萌发均存在不同程度的化感作用影响。其中,4种水提液均显著抑制紫茎泽兰种子发芽率和发芽指数,且抑制作用强度随提取液稀释倍数增大而逐渐减弱,对发芽率的抑制作用,1×显著强于5×、10×、15× 3种稀释液处理,而3种稀释液处理之间无显著差异,RI值介于-0.066到-0.197;对发芽指数的抑制作用,1×、5×显著高于10×、15×,但1×与5×处理之间,以及10×与15×处理之间无显著差异,RI值介于 -0.109到 -0.499。
对白三叶的作用规律与紫茎泽兰相似,四种水提液均显著抑制白三叶种子发芽率和发芽指数(15×除外),且其抑制作用强度随稀释倍数增大而减弱,对发芽率的抑制作用,1×显著强于5×、10×、15×,而3种稀释液处理之间无显著差异,RI值介于-0.020到-0.051;对发芽指数的抑制作用,1×显著高于5×、10×和15×,5×和10×无显著差异,15×与CK无显著差异,RI值介于-0.002到-0.042。
4种水提液均显著抑制大叶桉种子的发芽率(5×除外)和发芽指数,对发芽率的抑制作用,1×与10×无显著差异,显著强于5×与15×,5×与CK无显著差异,RI值介于-0.011到-0.045;对发芽指数的抑制作用,抑制作用强度随提取液稀释倍数增大而逐渐减弱(10×除外),15×显著低于1×、5×和10×,而1×、5×和10×三个处理之间无显著差异,RI值介于-0.017到-0.057。
4种水提液均显著抑制赤桉种子的发芽指数,而对发芽率影响有促进也有抑制,对发芽率的影响,1×与CK无显著差异,5×显著高于CK,10×与15×无显著差异,10×与15×显著低于CK,RI值介于-0.022到0.011;对发芽指数的抑制作用,10×处理显著强于1×、5×和15×,但1×、5×和15× 3个处理之间无显著差异,RI值介于-0.072到-0.144。
2.2 黑荆叶片水提液对四种植物幼苗早期生长的影响
黑荆叶片水提液在不同浓度条件下对四种植物幼苗早期生长的影响如表2所示。
据表2分析,黑荆叶片不同浓度水提液对4种受体植物幼苗早期生长均存在不同程度的化感作用影响。其中,4种水提液均显著抑制紫茎泽兰幼苗早期生长的胚轴长和胚根长(15×除外),且抑制作用强度随提取液稀释倍数增大逐渐减弱,对胚根长的影响,1×处理抑制作用显著强于 10×、15× 处理,1× 与 5× 无显著差异,15×表现促进作用,与CK无显著差异,RI值介于-0.176到0.004;对胚轴长的抑制作用,1×显著高于5×、10×、15×,但10×与15×之间无显著差异,RI值介于-0.112到-0.030。
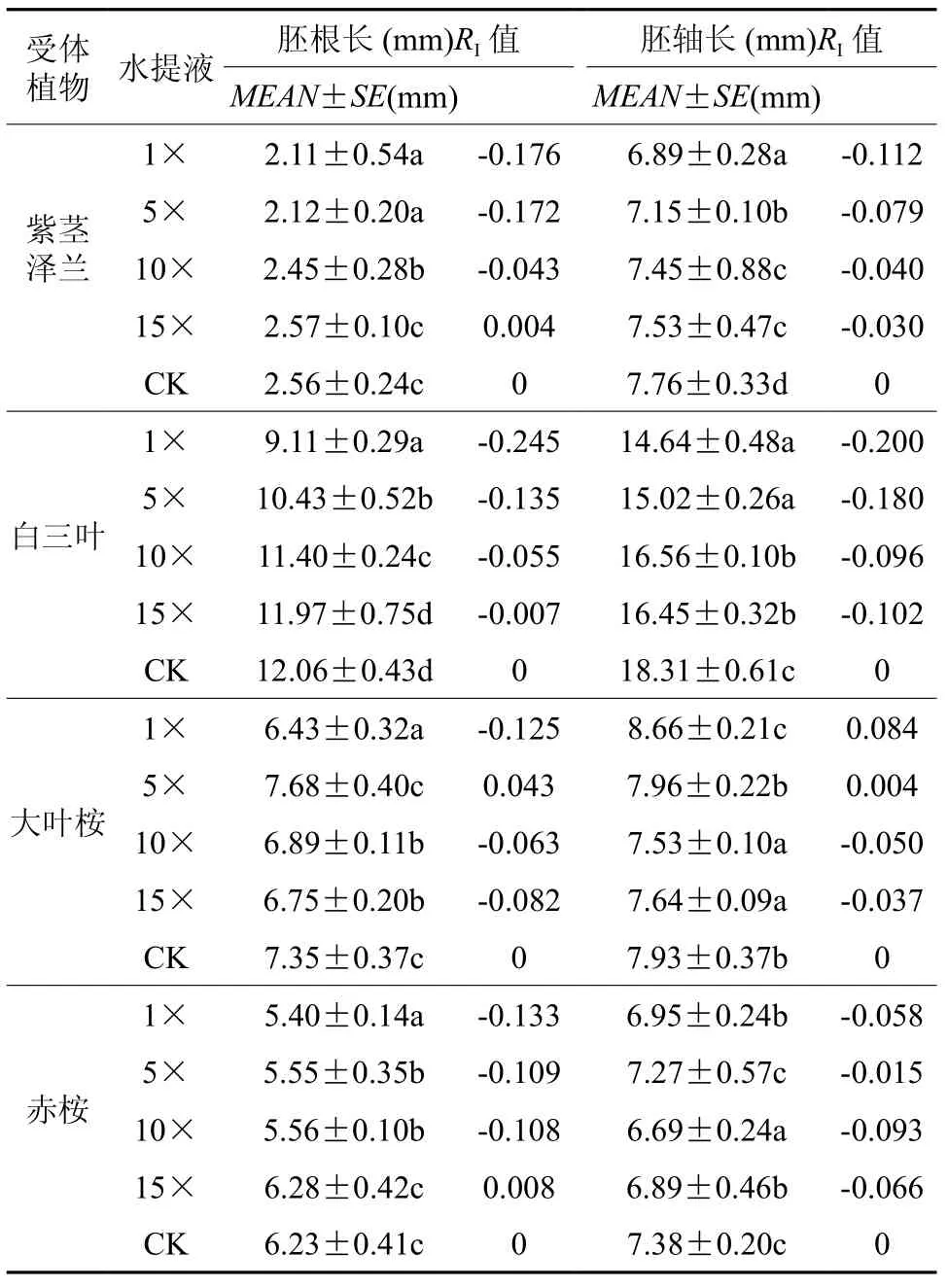
表 2 黑荆叶片水提液对四种植物种子生长的影响Table 2 Effects of leaf water extract from Acacia mearnsii on seeding growth of four plant species
4种水提液均显著抑制白三叶幼苗早期生长的胚根长(15×除外)及胚轴长,且其抑制作用强度大体随提取液稀释倍数增大而减弱,对胚根长的抑制作用,1×显著强于5×、10×、15×,15×与CK处理无显著差异,RI值介于-0.245到-0.007;对胚轴长的抑制作用,1×与5×显著强于10×与15×,但1×与5×之间,以及10×与15×之间无显著差异,RI值介于-0.200到-0.096。
4种水提液对大叶桉幼苗早期生长的胚根长与胚轴长的影响有促进也有抑制,对胚根长的影响,除5×处理表现出促进作用外,1×、10×、15×处理均表现出显著抑制作用,抑制作用强弱大小顺序为1×>15×>10×,但10×与15×之间,以及5×与CK之间无显著差异,RI值介于-0.125到0.043;对胚轴长的影响,1×和5×表现促进作用,10×与15×表现抑制作用,但5×与CK之间,以及10×与15×之间无显著差异,RI值介于-0.037到0.084。
对赤桉的作用规律与大叶桉类似,对胚根长的影响,除15×表现出轻微促进外,1×、5×、10×均表现出显著抑制作用,且抑制作用强度随稀释倍数的增大而逐渐减弱,5×和10×之间无显著差异,RI值介于-0.133到0.008;对胚轴长的影响,4种水提液处理均表现抑制作用,10×显著强于1×、5×、15×,但1×与15×之间,以及5×与CK之间无显著差异,RI值介于-0.093到-0.015。
2.3 黑荆叶片水提液对四种受体植物生长调节的综合作用
下图是黑荆叶片水提液对4种植物种子萌发和幼苗生长的综合作用评价结果。
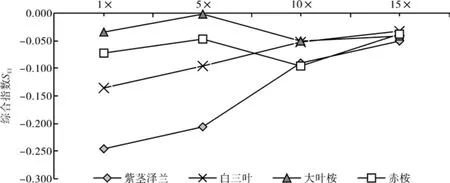
图1 黑荆叶片水提液对四种植物的综合化感效应指数Fig. 1 SEI of leaf water extract from Acacia mearnsii on four plant species
据图1分析,黑荆叶片不同水提液对4种受体植物种子萌发及幼苗生长均存在不同程度的化感作用影响,综合作用均表现为抑制作用。其中,4种提取液对紫茎泽兰综合化感作用强度大小顺序为1×>5×>10×>15×,但1×与5×之间,10×与15×之间无显著差异,SEI介于-0.246到-0.050;对白三叶综合化感作用强度大小顺序为1×>5×>10×>15×,但10×与15×之间无显著差异,SEI介于-0.135到-0.033;对大叶桉综合化感作用强度大小顺序为10×>15×>1×>5×,但1×与15×之间无显著差异,SEI介于-0.051到-0.002;对赤桉综合化感作用强度大小顺序为10×>1×>5×>15×,但5×与15×之间为显著差异,SEI介于-0.095到-0.038。当用黑荆叶片原液即1×处理4种受体植物种子和幼苗时,综合化感作用强度大小顺序为紫茎泽兰>白三叶>赤桉>大叶桉;5×处理综合化感作用强度大小顺序为紫茎泽兰>白三叶>赤桉>大叶桉;10×处理综合化感作用强度大小顺序为赤桉>紫茎泽兰>白三叶>大叶桉;15×处理综合化感作用强度大小顺序为紫茎泽兰>大叶桉>赤桉>白三叶,紫茎泽兰受黑荆叶片不同浓度的水提液的影响都最为显著。
3 结论与讨论
3.1 结 论
从实验数据分析可得,黑荆叶片四种水提液对4种受体植物的种子萌发及幼苗生长均存在不同程度的化感作用影响,综合效应指数介于-0.246到-0.002。其中,对紫茎泽兰及白三叶的抑制作用有较明显的规律性,抑制作用随着处理液稀释倍数增加而减弱,原液对紫茎泽兰的抑制作用的SEI达到-0.246,抑制作用最为显著;而对大叶桉、赤桉的抑制作用没有规律性,原液和10倍稀释液处理组的抑制作用较其他两组明显,5倍稀释液处理大叶桉的SEI值为-0.002,抑制作用十分微弱,4种受体植物中,紫茎泽兰种子萌发及幼苗生长受到的影响都最为显著,大叶桉种子萌发及幼苗生长受到的影响都较弱,由此可见,黑荆叶片中的水溶物能够抑制其他植物的生长,造成其林下植被稀少的原因可能是植株水溶物的化感作用。
3.2 讨 论
在过去,我国曾将黑荆遴选为桉树人工林的混交树种,并发现其在桉树人工林土壤改良方面具有一定的生态效益,如改善土壤容重、土壤孔隙度等。但针对黑荆林下生物多样性严重不足的生态学问题及其成因缺乏关注。本研究发现,黑荆叶片的水溶物对其它植物的种子萌发和幼苗生长普遍显示化感抑制作用。这可能是黑荆人工林下植被稀少的一个重要成因。为此,笔者建议在日后的相关科学研究与生产实践中,应综合评价黑荆人工林的生态效益,重新权衡黑荆种植的利与弊,以保障区域生物多样性和生态安全。
本实验发现黑荆叶片水提液对四种受体植物种子萌发及幼苗生长有不同程度的抑制作用,这与周伟佳等[15]的研究成果一致,作用强弱也符合低促高抑的特征。黑荆叶片水提液对紫茎泽兰和白三叶的化感抑制作用随着黑荆叶片水提液稀释倍数增大而减弱,而对赤桉和大叶桉的抑制作用没有规律性,1×和10×的抑制作用较5×和15×明显,可能是由于水提液中化感物质对两种乔木种子萌发及幼苗生长有多个作用区间,这一推断有待进一步的实验证实。从实验指标的测试结果发现,相同处理条件下,白三叶的胚轴长度和胚根长度都较其他3种受体植物大,且其发芽率和发芽指数受到的化感作用影响也相对较弱,预示白三叶对黑荆叶片水提液化感作用的耐受能力较强,可作为黑荆人工林生物多样性恢复的备选物种。
受体材料中选取紫茎泽兰是基于防治紫茎泽兰的考虑。紫茎泽兰是一种世界性的恶性杂草[16],已在我国西南地区广泛蔓延,对生态系统的组成、结构及生物多样性造成了严重影响,也给社会经济带来了重大损失[17]。遗憾的是,目前尚无有效可行的防除紫茎泽兰的技术途径[18]。生态学家和环保工作者正在积极研发生物防除技术[19],其中植物源除草剂的开发和应用深受关注。本研究选用的四种受体植物中,紫茎泽兰受黑荆叶片不同浓度的水提液的影响都最为显著,笔者推断水提液中存在对紫茎泽兰种子萌发及幼苗生长具有较强抑制作用的活性物质,基于活性物质开发的除草剂可用于新入侵地紫茎泽兰的防治。
当然,本研究也遗留一些问题,如:黑荆叶片水提液中存在哪些活性物质,其中哪些物质对植物生长产生化感抑制作用?在野外实验或盆栽实验条件下,黑荆叶片水提液对受体植物的影响是否与室内模拟实验测定结果相一致?黑荆是否在资源捕获方面具有较大优势?等等。这些问题均需进一步的探索,也是未来该领域科学研究的主攻方向。
[1] 王豁然,江泽平, 傅紫芰. 林木引种驯化与森林可持续经营[M]. 北京:中国环境科学出版社, 1998.
[2] 郑勇奇,张川红. 外来树种生物入侵研究现状与进展[J]. 林业科学, 2006, 42(11):114-122.
[3] 闫小玲,寿海洋,马金双.中国外来入侵植物研究现状及存在的问题[J].植物分类与资源学报, 2012, 34(3):287-313.
[4] Cronk Q C B, J L Fuller. Plant invaders: the threat to natural ecosystems [M]. Earthscan Publications, London, UK, 2001.
[5] 付增娟, 张川红, 郑勇奇, 等. 黑荆和银荆的繁殖扩散与入侵潜力[J]. 林业科学, 2006, 42(10): 48-53.
[6] 万方浩, 谢丙炎, 杨国庆, 等. 入侵生物学[M]. 科学出版社,2011. 232-258.
[7] 李建东, 殷萍萍, 孙 备, 等. 外来种豚草入侵的过程与机制[J]. 生态环境学报, 2009, (4): 1560-1564.
[8] 方 芳, 茅 玮, 郭水良. 入侵杂草一年蓬的化感作用研究[J]. 植物研究, 2005, 25(4): 449-452.
[9] 张 梅, 毕海红, 万方浩, 等. 紫茎泽兰一种潜在化感活性物质的分离鉴定[J], 生物安全学报, 2011, 20(3): 207-212.
[10] 梅玲笑, 陈 欣. 外来杂草加拿大一枝黄花对入侵地植物的化感效应[J]. 应用生态学报, 2005, 16(12): 2379-2382.
[11] 薛 立, 傅静丹. 影响植物竞争的因子[J]. 中南林业科技大学学报, 2012, 32(2): 6-15.
[12] 曾任森. 化感作用研究中的生物测定方法综述[J]. 应用生态学报, 1999, 10(1): 123-126.
[13] Williamson G B, Richardson D. Bioassays for allelopathy:measuring treatment responses with independent controls [J].Journal of chemical ecology, 1988, 14(1): 181-187.
[14] 孙运刚, 刘济明, 蒙 剑, 等. 几种植物对紫茎泽兰种子萌发抑制作用的研究[J]. 种子, 2009, 28(12): 31-34.
[15] 周伟佳, 郑思思, 吴颖胤, 等. 黑荆对几种林下植物种子萌发的化感作用[J]. 植物研究, 2011, 31(2): 235-240.
[16] 杨国庆, 万方浩, 刘万学. 入侵杂草紫茎泽兰的化感作用研究进展[J]. 植物保护学报, 2008, 35(5): 463-468.
[17] XU H G, DING H, LI M Y, et al. The distribution and economic losses of alien species invasion to China [J]. Biological Invasions,2006, 8(7): 1495–1500.
[18] 万方浩, 刘万学, 郭建英, 等. 外来植物紫茎泽兰的入侵机理与控制策略研究进展[J]. 中国科学: 生命科学, 2011, 41(1):13-21.
[19] 杨柳青, 赵 坤, 廖飞勇, 等. 生物除草剂对加拿大一枝黄花生理参数和死亡率的影响[J]. 中南林业科技大学学报, 2012,32(10): 121-129.
Formation causes of sparse vegetation under Acacia mearnsii plantation:A study based on plant allelopathy
HE Yong1, HUANG Xin-hui1, SHI Xiao-ying1, YU Fu-ke2, XIA Hong1
(1. Dept. of Environmental Science and Engineering, Southwest Forestry University, Kunming 650224, Yunnan, China; 2. Institute of Environmental Sciences and Ecological Restoration, School of Life Sciences, Yunnan University, Kunming 650091, Yunnan, China)
The formation causes of sparse vegetation under Acacia mearnsii plantation were studied from the perspective of plant allelopathy. The interference effects of water extract with different concentrations (1, 5, 10, 15 times) from Acacia mearnsii leaves on seed germination and seedling growth of four receptor plants was assayed through indoor biological simulation experiments, the four receptor plants are Ageratina adenophora, Trifolium repens, Eucalyptus robusta and Eucalyptus camaldulensis, respectively. The results show that different concentrations ( 1, 5, 10, 15 times) of water extract from Acacia mearnsii leaves all had inhibitory effects on seed germination and seedling growth of the four receptor plants, the synthesized effect index (SEI) ranged from -0.246 to -0.002; there existed an obvious regularity of inhibitory effects to Ageratina adenophora and Trifolium repens, and the inhibitory effect reduced with the increase of water extract dilution ratio, the SEIof inhibitory effect on Ageratina adenophora treated with 1 times was -0.246; however,there was no regularity in inhibitory effect on Eucalyptus robusta and Eucalyptus camaldulensis, the inhibitory effects of 1 times and 10 times were more obvious than the other two groups, the SEIof inhibitory effect on Eucalyptus robusta treated with 5 times was -0.002.The possible cause of sparse vegetation under Acacia mearnsii plantation is allelopathy of Acacia mearnsii hydrotrope.
Acacia mearnsii plantation; formation causes of sparse vegetation; plant allelopathy
S793.7
A
1673-923X(2013)10-0079-05
2013-06-02
国家自然科学基金项目(31160155、31270751);云南省应用基础研究计划面上项目(2007C022M); 西南林业大学科研基金项目(110714)
何 勇(1988-),男,江西樟树人,硕士研究生,主要从事森林生态学方面的研究;E-mail:heyong2008-1988@163.com
于福科(1976-),男,甘肃灵台人,博士,讲师,主要从事区域生态、入侵生态、化学生态方面的研究;
E-mail: ylyfk2005@aliyun.com
[本文编校:文凤鸣]
