不同人为干扰下纳帕海湖滨湿地植被及土壤退化特征
2013-12-21唐明艳杨永兴
唐明艳,杨永兴
(同济大学环境科学与工程学院污染控制与资源化国家重点实验室,长江水环境教育部重点实验室,上海 200092)
湿地是最具生产力的生态系统类型之一[1],但其水文依赖性也决定了其生态脆弱性[2]。近几十年来,随着人为干扰加剧,世界范围内湿地发生不同程度退化甚至消失,湿地退化已经成为全球性现象,湿地及其自然资源持续减少[3],开展人为干扰下湿地生态系统退化过程与退化机理研究,已成为当前国际湿地科学研究热点和前沿问题[4]。以往针对单一人为干扰方式下湿地结构与功能退化特征已有大量报道,其干扰方式涉及放牧[5]、围垦、生物入侵、环境污染[6]等方面,其研究范围涵盖湿地水文[7]、土壤[8]和生物类群[9-10]等结构特征以及蓄水调洪、碳循环、降解污染物[11]等功能特征,然而,针对多重人为干扰下湿地退化特征和过程的综合研究尚少有涉及。任何生态系统退化均是多种干扰因素综合作用的结果,不同干扰因素之间存在拮抗或协同作用[12],对比和辨识不同人为干扰的作用方式和作用强度,有助于深入理解湿地生态系统退化的关键驱动因素及其退化机理问题。
纳帕海湿地位于云南西北部高原区域,为喀斯特地貌上发育的高原湿地[13]。尽管与平原湿地和滨海湿地的显著退化相比,高原湿地保存相对完整。然而,在过去几年中,纳帕海湿地仍受到严重人为干扰,尤以家猪拱地、牛羊过度放牧以及人为建造土路引起的湿地水源补给隔断等干扰最为突出,引起湿地植被分布格局、土壤性质以及生物组成类群均发生显著变化[14]。为此,本文分析了家猪拱地、牛羊过度放牧和人为隔断水源补给3种干扰方式下纳帕海湿地植被和土壤退化特征、过程及机理,目的在于:1)对比分析3种人为干扰方式下纳帕海湖滨湿地植物群落特征、植物多样性及土壤理化性质;2)引入土壤退化指数,比较3种人为干扰下湿地土壤特征和退化程度;3)确定纳帕海湖滨湿地退化过程中的关键人为干扰方式和关键生态因子,为纳帕海湖滨退化湿地生态恢复和科学管理提供参考。
1 研究区域地理位置概况
纳帕海湿地地处滇西北横断山脉中段,香格里拉县城西北部8 km处(27°49'—27°55'N,99°37'—99°43'E),海拔1460 m,行政上隶属于云南省迪庆藏族自治州。2005年云南纳帕海湿地被列入《国际重要湿地名录》,是我国特有的国家Ⅰ级保护珍稀鸟类——黑颈鹤(Grus nigricollis)的保护区及其越冬生境。纳帕海湖盆南北长10 km,东西宽2.3—2.4 km,积水面积660 km2,湖面面积31.25 km2。本区地质构造上属滇西北槽褶皱系,古生界印支槽褶皱带,中甸剑川岩相带[15]。地貌为横断山系古夷平面的断陷盆地,发育典型高原喀斯特地貌,纳帕海湿地所处区域的气候属于亚热带西南季风气候,同时叠加了海拔高度与高原地貌作用,形成冷凉湿润的高原气候,该区年均温度5.4℃,最冷月平均温度为-3.8℃,最热月平均温度为13.2℃,极端低温-25.4℃,极端高温24.5℃。年平均降水量828 mm,径流量390 mm,年平均产水量2.5×108m3。纳帕海湿地具有复杂的生物地理成分和高寒植物杉叶藻(Hippuris vulgaris)等水生植物群落。该区主要土壤类型为沼泽土、泥炭土和沼泽化草甸土[15]。
近年来,受家猪拱地、牛羊过度放牧、人为隔断补给水源等人类活动干扰尤为突出,受人类不合理的社会经济活动影响,纳帕海湿地生态退化严重,引起政府部门关注,云南省于2007年将其列为湿地恢复工程(2007—2020年)优先项目[16]。在2011年7月纳帕海退化湖滨湿地植被和土壤样品采集过程中发现,湖滨湿地家猪放牧干扰尤为严重,随处可见牧民放养的藏香猪,在觅食过程中,常呈条状、带状或片状拱翻土壤,形成深浅、大小不一的土坑,致使草根裸露,下覆泥炭层出露,有机质矿化加强,泥炭分解强烈,养分含量下降。据野外初步估算,家猪拱地破坏的湿地面积约占全部面积的5%左右。
2 研究方法
2.1 研究样地设置
纳帕海湿地距香格里拉县城较近,周围土地利用类型主要为农田和居民区,受人为活动干扰相当严重。本研究中,选择3种对纳帕海湿地影响最为严重的人为干扰方式:隔断水源补给(人工在湖滨湿地区修建土路,切断补给湖滨沼泽的湖水)、牛羊过度放牧及家猪拱地作为共同研究对象,3种干扰方式互相叠加,共同影响本区湿地发育。每种干扰方式各设置一条研究样带,进行不同人为干扰下纳帕海湖滨湿地退化研究。3条样带具体描述如下:
3条样带均为沟谷湿地,其中样带A谷地长约750 m(沿沟谷中线方向),谷口较宽,地表稍有起伏,主要受人为隔断水源补给干扰,尽管部分样点存在家猪拱地和牛羊放牧干扰,但影响范围相当有限。本样带共设置6个样点,编号依次为A1、A2、A3、A4、A5、A6;样带B沟谷地势较缓,主要是牛羊过度放牧干扰,共设置5个样点,编号依次为B1、B2、B3、B4、B5,其中样点B1、B2位于典型的牛羊过度放牧区域;样带C沟谷宽广,集中连片分布家猪拱翻地,受家猪干扰最严重,共设置7个样点,编号依次为C1、C2、C3、C4、C5、C6、C7,其中样点C2、C4位于严重的家猪拱地破坏地区,为裸地,湿地退化最为严重。3条样带均按人为干扰程度递减方向设置采样点,最后采样点为原生湿地。样地环境特征及干扰方式见表1,其中样点C2,C4草根层与腐殖质层被家猪扰动形成扰动层,深约15cm,下层为腐殖质层-潜育层。
2.2 植被调查和土壤样品采集
于2011年7—8月植物生长旺盛期采用样方法对滇西北高原纳帕海湖滨湿地进行野外研究。每个样点内随机设置1个1 m×1 m样方和2个0.5 m×0.5 m小样方,记录植物物种组成,确定该梯度上植物群落的优势物种,测量植物的密度、盖度、高度等群落特征。在样方附近同步设置土壤探坑采集土壤样品,取样时根据土壤发育特征和人为干扰情况确定探坑深度和取样层次,即根据土壤发生层分层取样,每层各取1份样品用以室内分析化验。同时,分别用环刀和小铝盒取表层和亚表层原状土壤进行土壤物理性质的测定。带回的土壤样品在室内阴凉通风处风干,粉碎研磨,过直径0.15 mm尼龙筛,装入聚乙烯密封袋贮存待测。
2.3 土壤样品分析
在实验室进行土壤容重(BD)、含水率(WC)和毛管孔隙度(P)的测定,采用环刀法测定容重,采用烘箱法测定含水率,采用浸水法测定毛管孔隙度。按中国科学院南京土壤研究所的分析方法[17],采用半微量开氏法测定全氮(TN);采用扩散法测速效氮(AN);采用NaOH熔融-钼锑抗比色法测定全磷(TP);采用紫外分光光度法测速效磷(AP);采用NaOH熔融-火焰光度法测定全钾(TK);采用火焰光度法测速效钾(AK);采用灼烧法测有机质(OM);采用电位法测定土壤pH值。各类样品分析化验均采用平行样分析测试,平行样之间误差在标准允许范围内。

表1 纳帕海湖滨湿地样地特征Table 1 Characteristics of the plots in lakeside wetlands,Napahai
2.4 数据分析
2.4.1 植物群落退化特征分析
植物群落退化特征分析主要包括群落盖度、高度和密度等数量特征、植物群落水分类型结构特征以及物种多样性组成特征3方面。在数量特征分析中,群落盖度为各种分盖度之和。计算密度时,将0.25 m2小样方内植株密度扩大4倍,转换为1m2样方,然后再参与分析。群落高度未作处理,依据以上3个指标计算物种重要值(IV),IV=(相对密度+相对高度+相对盖度)/3;在分析群落水分类型组成特征时,按照金振洲在云南省湿地植物研究中定义的植物水分生态类型[18],将纳帕海湿地植物划分为水生植物(Ap)、沼生植物(He)、湿生植物(Hy)和中生植物(Mesophyte,Me)四大类群,分别计算各类群重要值,考察群落水分生态类型组成结构;物种多样性组成特征计算了样地内总物种数(St)、单位样方内物种丰富度(Sq)、Shannon-Wiener指数(H')和 Whittaker指数(βw)[19]。
依据种重要值数据,进行植物群落TWINSPAN聚类分析和植被-土壤的典范对应分析(CCA)。CCA分析中总计包括38种植物和11个土壤变量,以相关性最高的第一、二轴作物种-土壤因子和样地-土壤因子二维排序图,反映群落分布和物种组成沿土壤因子梯度变化情况。其中,样带C中样点C2和C4已退化为裸地,不存在地上植被,为极度退化湿地,未纳入以上分析。
2.4.2 土壤退化特征分析
由于人为干扰主要影响湿地表层土壤理化性质,导致土壤养分衰减,土质变劣,削弱土壤亚系统生态功能[15],因此,本文仅对不同人为干扰下退化湿地表层土壤理化性质进行了比较分析。依据野外调查和TWINSPAN聚类结果,分析各样带土壤退化特征,并采用Pearson相关性分析检验湿地退化过程中各土壤理化指标间的相关性,显著水平为P=0.05或P=0.01。
采用Adejuwon[20]提出的人为干扰下土壤退化指数定量刻画土壤退化程度,其公式为:

由于原式中变量xi不易解释,结合本研究实际情况,引用时对原式作等价转换,改写为:

式中,SDI为土壤退化指数,xij是第i个样地第j个土壤理化指标值,xcj是第j个土壤理化指标参照值,n为纳入计算的土壤指标数。本研究中样带A、C以样带A中样点A5的土壤理化指标值作为参照值,因样带C受猪拱干扰,未发现原生湿地,样点A5为常年淹水地段,发育典型水葱群落,受直接人为干扰最小,可视为原生湿地;样带B以B5为土壤理化指标值作为参照值。计算时土壤pH以及速效磷和速效钾含量由于受成土母岩性质影响较大,对人为干扰程度指示性差,未纳入分析,实际选取的有土壤含水率、容重、孔隙度、有机质、速效氮、全氮、全磷、全钾总计8个指标,其中土壤容重由于与土壤退化程度呈负相关[5,21],计算时对其作相反数转换处理,其他未作处理。据此,SDI值是8个土壤指标的综合计算结果,可较全面反映人为干扰下湿地土壤退化状况,SDI<0,代表土壤退化程度高于参照点,其值越小,退化越重,SDI>0则反之。
上述分析中,采用BioDiversity pro软件计算Shannon-Wiener多样性指数;采用Win TWINS 2.3软件进行TWINSPAN聚类分析;采用SPSS13.0软件进行Pearson相关性分析;利用Canoco 4.5进行植被-土壤CCA分析;采用Microsoft Excel 2007对数据进行基本统计分析及Whittaker多样性指数计算。
3 结果与分析
3.1 纳帕海湖滨湿地植被退化特征分析
3.1.1 纳帕海湖滨湿地研究样点TWINSPAN分类
纳帕海退化湿地18个样点可分为5个退化等级(表2)。从聚类结果看,样带A的退化梯度为:原生湿地→轻度退化→中度退化→重度退化;样带B的退化梯度为:原生湿地→轻度退化→重度退化,无中度退化,由轻度退化直接跳跃到重度退化;样带C的退化梯度为:重度退化→极度退化,这与野外调查结果相一致。总体上,3条样带退化程度为:样带C>样带B>样带A。

表2 纳帕海湖滨退化湿地分类与分级Table 2 Classification and grade of degraded lakeside wetlands in Napahai
3.1.2 不同人为干扰下纳帕海湖滨湿地植物群落组成结构特征变化
纳帕海湿地样带A包括6种群落类型,分别是水葱群落(Com.Scirpus validus)、刘氏荸荠群落(Com.Eleocharis liouana)、小花灯心草群落(Com.Juncus articulatus)、华扁穗草群落(Com.Blysmus sinocompressus)、云生毛茛群落(Com.Ranunculus longicaulis)和木里薹草群落(Com.Carex muliensis)。主要伴生种有三穗薹草(Carex tristachya)、稗草(Echinochloa crusgalli)、水蓼(Polygonum hydropiper)、睡菜(Menyanthes trifoliate)和竹叶眼子菜(Potamogeton malaianus)等29种植物,隶属于17科25属。样带B包括5种群落类型,分别是三穗薹草群落、车前群落(Com.Plantago asiatica)、华扁穗草群落、木里薹草群落和睡菜群落。主要伴生种有云生毛茛、鹅绒委陵菜(Potentilla anseriana)、细叶苦菜(Ixeris chinensis var.intemdia)、高原毛茛 (Ranunculus tanguticus)、小花灯心草、杉叶藻、黑三棱 (Rhizoma scirpi)、水葱和葱状灯心草(Juncus allioide s)等23种植物,隶属于14科19属。样带C包括4种群落类型,分别是木里薹草群落、鹅绒委陵菜群落、华扁穗草群落和水蓼群落。主要伴生种有白花碎米荠(Cardamine leucantha)、三穗薹草、发草 (Deschampsia caespitosa)、遏蓝菜(Thaspi arvense)、竹叶眼子菜和黑藻(Hydrilla verticillata)等16种植物,隶属于10科14属。可见,在不同人为干扰下,植物群落类型以及群落组成结构均发生相应改变,在群落类型多样性上,样带A>样带B>样带C,这与样带A常年淹水,受人为干扰程度相对最轻,样带B受过度放牧影响,草甸发育广泛,而样带C受家猪拱地干扰,地表干燥紧实,大面积表土裸露密切相关。
3条样带植物群落盖度差异不明显(图1),而植物群落高度差异明显,其中样带C群落高度明显低于样带A和样带B;植物群落密度以样带B最低,沿退化梯度(与采样顺序相反)群落密度整体上呈递增趋势(图1)。3条样带均以沼生植物最多,但样带C各水分类群重要值明显偏低,尤其水生植物发育明显较样带A和样带B差,而样带B中生植物明显较样带A和样带C多,比较而言,样带A水分生态类型组成最为合理。从物种多样性变化看,总物种数、物种丰富度和Shannon-Wiener指数以样带C最低,以样带A最高,Whittaker指数则以样带C最高。综合以上结果,纳帕海湖滨湿地植物群落退化程度为:样带C>样带B>样带A(表3)。

图1 纳帕海湖滨湿地植被退化数量特征Fig.1 Quantitative characteristics of vegetation degradation in lakeside wetlands,Napahai

表3 纳帕海湖滨湿地植物群落水分生态类型及物种多样性组成特征Table 3 Composition characteristics of water ecological types and plant species diversity in plant communities in lakeside wetlands,Napahai
3.2 不同人为干扰下纳帕海湖滨湿地土壤理化性质变化特征
整体而言,样带A和样带B土壤含水率随采样顺序均呈增加趋势(图2),样带A和样带B含水率均明显高于样带C,而土壤容重变化趋势与含水率完全相反,以样带C最高,在1.0—1.3 g/cm3之间波动;3条样带土壤毛管孔隙度变化总体上均略呈增加趋势;土壤pH值受人为干扰影响明显,3条样带土壤pH总体上均呈增加趋势,但变化格局略有不同,其中样带A土壤pH在样点A1、A2、A3、A4走势平缓,而在样点A5、A6处明显增加,这与样点A5、A6土壤存在大量小螺壳有关,样带B则表现为在样点B3、B4、B5处明显增加,样带C表现为在样点C6、C7处明显增加,这与该5处样点大量牲畜排泄物带入的氨氮有关;土壤表层有机质及全氮含量变化规律一致,3条样带间分布规律为样带A>样带B>样带C,而土壤全钾含量在3条样带间变化趋势与全氮变化趋势完全相反;土壤全磷含量在样带A中呈单调降低变化格局,在样带B中呈U型变化格局,而在样带C中波动性较大,变化趋势不明显;土壤速效性养分在3条样带中均呈较大波动性,其中土壤速效氮含量在3条样带间总体表现为样带A>样带B>样带C,而速效磷和速效钾波动相当大,且在3条样带间亦无明显差异,暗示可能存在其他关键生态变量影响土壤速效性养分含量(图2)。
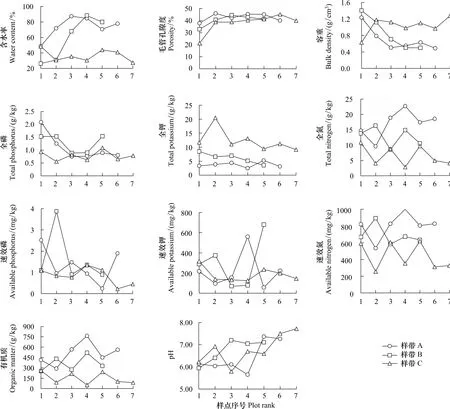
图2 纳帕海湖滨湿地土壤理化性质动态Fig.2 Dynamics of the soil physical and chemical characteristics of lakeside wetlands,Napahai
3.3 不同人为干扰下纳帕海湖滨湿地土壤理化指标相关性变化
Pearson相关性分析表明,3条样带各土壤指标之间的相关性质及相关强度差异较大,这种相关性变化与人为干扰方式有关。如土壤含水率和容重在样带A和样带B中均呈极显著负相关(P<0.01),而在样带C中无显著相关性(P>0.05),表明家猪拱地对土壤物理性质影响较大,又如土壤全氮与有机质在样带A和样带C中均呈极显著正相关(P<0.01),而在样带B中无显著相关性(P>0.05),表明牛羊放牧对土壤氮含量和有机质含量影响较大;在相关性质变化上,在样带A和样带B土壤孔隙度与含水率表现为正相关,与容重为负相关,而在样带C中相关性质完全相反,该结果同样表明家猪拱地对土壤物理性质的影响。因此,土壤指标间相关性质和相关强度的变化,体现出不同干扰方式对湿地土壤的作用特点(表4)。

表4 不同人为干扰下纳帕海湖滨退化湿地土壤指标相关性分析Table 4 Pearson correlation analysis for soil indices under different human disturbance in lakeside wetlands,Napahai
3.4 纳帕海湖滨湿地植物群落与土壤理化性质的关系
物种与土壤环境的CCA排序统计结果表明,第一、二排序轴特征值分别是0.811和0.613;物种与土壤环境因子显著正相关,且相关系数均在0.950以上,表明环境变量能很好地解释植物群落结构变化(表5)。

表5 纳帕海湖滨湿地植物群落CCA排序统计结果Table 5 Summary statistics results for the four CCA ordinations in lakeside wetlands plant communities,Napahai
物种排序图主要反映不同植物种类对土壤条件的相似适应性以及植物群落在土壤理化因子梯度上的分布,通过土壤因子与排序轴的相关分析可以找出与排序轴显著相关的因子,这些因子就是影响群落分布格局的主要因素。从排序结果看,土壤含水率和容重与第一轴相关性最大,其中含水率与之呈正相关,容重与之呈负相关,土壤全磷含量与第二轴相关性最大,表明土壤含水率和全磷含量是影响纳帕海湖滨湿地植物群落种类组成和分布的关键因素(图3)。
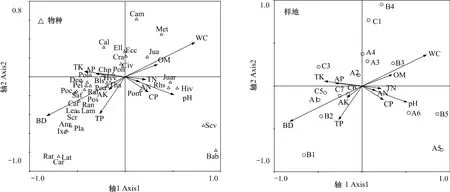
图3 纳帕海湖滨湿地物种、样地与土壤因子的CCA排序图Fig.3 CCA biplots between plant species and plots and soil factors in lakeside wetlands,Napahai
环境梯度和人为干扰可以显著影响植物生态分布[22],排序图中各植物物种的空间聚集性反映其在土壤环境梯度上的分布情况。沿排序图逆时针方向,植物水分生态类型呈明显旱化趋势,水毛茛(Batrachium bungei)、水葱、睡菜、黑三棱等水生植物分布在第一象限和第四象限,说明这些种类更适应含水率高的土壤;鹅绒委陵菜、云生毛茛、高原毛茛等中生植物分布在第三象限,说明它们更适应土壤含水率低,全磷、全钾含量高的区域(图3)。在群落分布上,原生湿地样点主要分布在第四象限,轻度退化湿地样点主要分布在第一、四象限,中度退化样点主要分布在第二轴附近,重度退化湿地样点主要分布在第二、三象限,即沿逆时针方向,湿地退化程度逐渐增加,该结果与TWINSPAN分类结果一致(图3)。
3.5 不同人为干扰下纳帕海湖滨湿地土壤退化程度定量分析
土壤退化指数较好地定量反映出3条样带土壤退化状况。在每条样带内,随退化程度增加,土壤退化指数均表现为增加趋势;不同样带间比较表明,样带C土壤退化程度最重,总土壤退化指数达-45.01%,样带A最轻,总土壤退化指数为-7.40%,二者相差6倍之多,反映出家猪拱地导致纳帕海湖滨湿地土壤发生严重退化(表6)。

表6 纳帕海湖滨湿地不同退化阶段土壤退化指数变化Table 6 Changes of soil degradation index in different degradation stage in lakeside wetlands,Napahai
4 讨论
4.1 不同人为干扰下纳帕海湖滨湿地植被退化特征
湿地植物群落是湿地健康良性发展的基础,也是湿地监测应用最广泛的生物指标[23]。湿地退化结果之一是加速水生植物群落向陆生植物群落演替过程。在此过程中,中生植物侵入,增加群落密度和物种组成多样性,在本研究和其他湿地区的相关研究已证实该结果[24-27]。然而,在不同人为干扰下,这一过程发生程度会有所不同。本研究发现,在3种人为干扰方式中,隔断水源补给干扰样带水分生态类型组成以水生和沼生种类重要值最高,中生植物重要值最低,牛羊放牧干扰样带也具有较多的水生和沼生种类,但比较而言,中生植物明显增加。而家猪拱地干扰样带各类群重要值均明显降低,尤其水生植物降低明显,受影响最大,这有以下几个原因:隔断水源补给干扰样带和牛羊放牧干扰样带均存在一定比例的积水区,生长水葱、竹叶眼子菜、睡菜等植物,因此,两个样带的水生、沼生植物均较多,但在沼泽化草甸区,样带A受干扰程度小,仍以沼生、湿生植物为主,而样带B在过度放牧干扰下,沼泽化草甸的旱生化过程加快[5],极大增加中生植物的多度和分布。家猪拱地主要发生在沼泽化草甸和草甸区域,取食植物地下根茎,尤其残留的水生、沼生植物根茎,含水量大,质地鲜嫩,尤其喜食,其结果之一就是影响水生、沼生植物种群的更新能力,使得原来有可能自然恢复的水生、沼生植被彻底丧失。因此,纳帕海湖滨湿地植物群落退化特征既遵循一般性退化规律,又在具体人为干扰下有其自身退化特征。
纳帕海湿地退化是在自然因素和人为因素共同作用的结果,岩溶地貌发育的落水洞与溶洞使湖水外泄,构成沼泽疏干退化自然背景,人为排水、家猪拱地、牛羊过度放牧和无序旅游等人类活动的强烈干预使得自然因素提供的可能性成为现实。在不同人为干扰下,湿地植物群落物种组成、结构向旱生化方向演替,导致群落功能发生退化[28]。根据3种人为干扰下群落高度、密度、盖度、植物组成多样性以及群落水分生态类型结构变化。本文初步认为:对纳帕海湿地植物群落结构和功能影响最大的是家猪拱地干扰,但是植物分布格局、多度和丰富度与不同时空尺度上的竞争、环境因素、干扰(天然的或人为的)诸因素有关,如何定量刻画诸因素是未来深入揭示湿地植被退化机理的关键[26],有待深入研究。
4.2 不同人为干扰下纳帕海湖滨湿地土壤退化特征
湿地土壤理化特征能较好反映人为干扰情况[29],研究不同干扰方式下退化湿地土壤的理化性质变化,不仅有助于我们了解纳帕海湖滨湿地退化的真正原因,还为进一步保护湿地生态系统提供了理论依据。
纳帕海湖滨湿地土壤在不同人为干扰下其退化特征不同。土壤含水率和毛管孔隙度在3种干扰方式间退化规律为样带C<样带B<样带A,土壤容重为样带C>样带B>样带A,因此,3个指标均受家猪拱地干扰影响最大而受人为隔断水源补给影响最小。这与样带A地表积水面积大、土壤受家畜直接干扰程度小,样带B受大型家畜采食践踏干扰,而样带C大面积土壤被拱翻,植被覆盖率低甚至形成裸地,土壤结构变紧实的干扰特征相一致。其变化机理为:随着人为干扰强度增加,土壤压实,土壤颗粒紧密,单位体积内的土壤固相组分增加,而土壤总孔隙度减少,土壤间隙中的毛管孔隙也随之减少。同时由于容重的增大,导致土壤渗透性能减弱,水分渗入率变小,从而自然含水率也随之减少。
土壤有机质和全氮含量在3种干扰方式间退化规律均为样带C<样带B<样带A。自然厌氧条件下,土壤有机质矿化率低,有利于有机质积累和保存。在人为干扰下,土壤淹水状态下的厌氧条件发生改变,通气性改善,加快原生沼泽积累的有机质分解过程,人为干扰程度越重,有机质分解程度越大。土壤中的氮素很大部分储藏在土壤有机质的有机态含氮化合物中,全氮含量主要取决于有机质的积累和分解作用的相对强度,因此土壤全氮含量的消长规律与土壤有机质含量的变化相一致。在人为干扰下,土壤全氮含量同样表现出随土壤通气性增加而衰减的变化规律。因此,土壤有机质和全氮含量的变化直接反映出人为干扰下湿地土壤退化过程[15]。土壤全磷含量退化规律为样带C<样带A<样带B。这是由于样带A淹水程度重,土壤还原作用较强,加之石灰岩母质导致的较高pH值,使原来固定的磷得以释放,致使土壤全磷下降,从而略低于过度放牧干扰的样带B。但土壤全钾含量变化规律与全氮完全相反,这是由于土壤中的氮磷主要是以有机态存在,而钾是以无机态存于矿物中,极难被植物吸收利用,从而土壤中积累较高的浓度。综合土壤有机质、全氮、全磷和全钾含量在3条样带间的退化规律看,家猪拱地干扰对纳帕海湿地土壤影响最大,这从土壤退化指数的定量分析中也可以得到佐证。但本研究中,土壤速效性养分含量无论在样带内还是样带间均无明显变化趋势,由于土壤速效性养分含量与全量养分含量、植物群落类型、土壤微生物组成、环境因子等因素密切相关,推测可能存在本研究未涉及的其他关键生态变量,关于其变化机制有待于专门设计土壤学控制实验进行更严谨的解释。
4.3 湿地植物群落与土壤因子之间的关系
植物群落种类组成和分布受植物区系和地貌、气候、水文等环境因子的影响,而在小尺度上,土壤性质是植物群落类型的最终决定因子[30]。CCA分析结果表明,纳帕海退化湖滨湿地群落物种组成和分布主要受土壤含水率和全磷含量影响。湿生植物主要分布在水分条件好、有机质丰富和全磷含量较低的生境,而中生植物分布在土壤全磷含量高的生境,表明土壤磷含量增加会提高中生杂类草的竞争能力[31]。土壤含水率、容重、有机质、全磷含量差异是形成纳帕海湖滨湿地植物分布格局的主要因素,这与若尔盖高原的研究结果一致[5]。
4.4 人为干扰下纳帕海湖滨湿地退化机制
人为干扰导致湿地生态系统退化是当前湿地科学热点研究领域。纳帕海湿地作为《国际重要湿地名录》收录的国际湿地,其严重的退化现状已引起各界关注。湿地区牛羊过度放牧、放养野香猪、人为建造土路等人为干扰无不对湿地发育产生深刻影响[32]。本研究也证实家猪拱地是本区最严重的干扰方式之一,但生态系统退化绝非单一因素作用的结果,在当前3种干扰方式中,人为隔断水源补给对湿地发育的影响是渐变、长远的,其结果加速湿地旱生化过程,向沼泽化草甸方向演替,牛羊过度放牧的践踏、采食作用下,表层土壤有机质分解加速,耐牧种类得以保留,湿地生境进一步向草甸化演替,而在草甸化湿地,家猪的拱土采食破坏植物根系以及根茎、块茎等繁殖体,导致亚表层土壤裸露,影响水生和沼生植物群落的自然恢复。因此,3种干扰方式中,人为隔断水源补给影响面积大,作用强度缓和,而牛羊放牧和家猪拱地作用面积小,但强度大,在3种干扰协同作用下,原生湿地彻底退化为中生草甸甚至次生裸地。因此,在湿地恢复过程中,应依据不同干扰方式制定相应对策,但应首先加强牛羊、猪等大型家畜的科学管理,减缓对湿地的进一步破坏,是当务之急,而对于人为隔断水源补给需要系统规划,从长远着手,深入研究沼泽补水技术和水资源管理技术体系,既满足农业灌溉、水利工程用水需要,又满足沼泽发育所需的水文条件,是实现纳帕海湿地资源可持续利用的途径之一。
5 结论
(1)经过比较分析,3种干扰方式下纳帕海湖滨湿地植物群落类型组成、物种丰富度、沼生植物重要值、物种数、Shannon-Wiener多样性指数和土壤有机质、全氮、含水率、速效氮、孔隙度变化规律为:人为隔断水源>牛羊过度放牧>家猪拱地,而土壤全钾、容重变化规律则完全相反,但土壤速效磷、速效钾含量变化规律不明显。
(2)3条样带的各土壤指标间相关强度在不同干扰样带间波动较大,甚至相关性质改变,体现出不同干扰方式对湿地土壤的作用特点。
(3)应用CCA分析对土壤理化因子和植被重要值数据进行排序,初步揭示了植物群落、植物物种对土壤理化性质梯度变化的响应情况,纳帕海湖滨湿地植被特征与土壤理化性质表现出显著的相关性,退化湿地植被群落主要受到土壤含水率、全磷含量的影响。
(4)本研究选取的3种干扰方式,通过TWINSPAN分类法、植物群落特征变化分析、土壤理化性质变化分析和土壤退化指数,揭示人为干扰类型与强度的差异对湿地植物群落特征、土壤理化性质特征及其相互关系具有不同的生态作用,当前对纳帕海湖滨湿地退化是3种干扰方式协同作用的结果,其影响程度顺序为:家猪拱地>牛羊过度放牧>人为隔断水源补给。
[1]Spohn M,Babka B,Giani,L.Changes in soil organic matter quality during sea-influenced marsh soil development at the North Sea coast.Catena,2013,107:110-117.
[2]Amores M J,Verones F,Raptis C,Juraske R,Pfister S,Stoessel F,Anton A,Castells F,Hellweg S.Biodiversity Impacts from Salinity Increase in a Coastal Wetland.Environmental science & technology,2013,47(12):6384-6392.
[3]Keddy PA,Fraser L H,Solomeshch A I,Junk W J,Campbell D R,Arroyo M T K,Alho CJR.Wetland wonderful:the world's largest wetlands are conservation priorities.Bioscience,2009,59(1):39-51.
[4]Hang D Y,Yang Y X,Yang Y,Li K.Recent advances in wetland degradation research.Acta Ecologica Sinica,2012,32(4):1293-1307.
[5]Li K,Yang Y X,Yang Y,Hang D Y.Characteristics and influence factors of the swamp degradation under the stress of grazing in the Zoige Plateau.Acta Ecologica Sinica,2011,31(20):5956-5969.
[6]Yang Y X.Ecological environment deterioration,mire degeneration and their formation mechanism in the Zoige Plateau.Journal of Mountain Science,1999,17(4):318-323.
[7]Woo M K,Young K L.Hydrogen morphology of patchy wetlands in the high Arctic,polar desert environment.Wetlands,2003,23(2):291-309.
[8]Sigua G C,Griffin J,Kang W J,Coleman S W.Wetland conversion to beef cattle pasture:changes in soil properties.Journal of Soils and Sediments,2004,4(1):4-10.
[9]Lehtinen R M,Galatowitsch SM,Tester JR.Consequences of habitat loss and fragmentation for wetland amphibian assemblages.Wetlands,1999,19(1):1-12.
[10]Seilheimer T S,Wei A H,Chow-Fraser P,Eyles N.Impact of urbanization on the water quality,fish habitat,and fish community of a Lake Ontario marsh,Frenchman's Bay.Urban Ecosystem,2007,10(3):299-319.
[11]Brito E M S,Duran R,Guyoneaud R.A case study of in situ contamination in a mangrove swamp(Rio De Janeiro,Brazil).Marine Pollution Bulletin,2009,58:418-423.
[12]Chen L D,Fu B J.Ecological signif icance,characteristics and types of disturbance.Acta Ecologica Sinica,2000,20(4):581-586.
[13]Tian K,Mo J F,Lu M,Chang FL,Yang Y X.Human disturbances on the ecological environment degradation of Napahai Wetland in the upstream of Yangtze River.Resources and Environment in the Yangtze Basin,2004,13(3):292-295.
[14]Xiao D R,Tian K,Zhang L Q.Relationship between plant diversity and soil fertility in Napahai wetland of Northwestern Yunnan Plateau.Acta Ecologica Sinica,2008,28(7):3116-3124.
[15]Tian K.Mechanism and process of soil degradation in Napahai wetland on Yunnan Plateau[D].Changchun:Northeast Institute of Geography and Agroecology,Chinese Academy of Sciences,2004.
[16]Hu JM,Dong Y X,Yuan H,Li J,Ma B B.Variation of soil nitrogen componentsunder different degradation condition in Napahai wetland reserve.Chinese Journal of Soil Science,2012,43(3):690-695.
[17]The Institute of Soil Science,CAS.Analysis of soil physical and chemical characteristics.Shanghai:Shanghai scientific & Technical Publishers,1978.
[18]Jin Z Z.Complication on systematic,geographical and ecological features of wetland plants in Yunnan Plateau.Beijing:Science Press,2009.
[19]Hang D Y,Yang Y X,Yang Y.Changes of plant species diversity and interspecific correlation in a degraded swamp community along drainage gradients on the ZoigêPlateau of China.Chinese Journal of Plant Ecology,2012,36(5):411-419.
[20]Adejuwon JO,Ekanade O.A comparison of soil properties under different land use types in a part of the Nigerian Cocoa Belt.Catena,1988,15(3/4):319-331.
[21]Shang W,Yang Y X.Degradation characteristics,patterns,and processes of lakeside wetland in Napahai of northwest Yunnan Plateau,Southwest China.Chinese Journal of Applied Ecology,2012,23(12):3257-3265.
[22]Sharpe P J,Baldwin A H.Wetland plant species richness across estuarine gradients:The role of environmental factors and the mid-domain effect.Aquatic Botany,2013,107:23-32.
[23]Wilson M J,Bayley SE.Use of single versus multiple biotic communities as indicators of biological integrity in northern prairie wetlands.Ecological Indicators,2012,20:187-195.
[24]Moran J,Skeffington SM,Gormally M.The influence of hydrological regime and grazing management on the plant communities of a karst wetland(Skealoghan turlough)in Ireland.Applied Vegetation Science,2008,11(1):13-24.
[25]Capon SJ.Flood variability and spatial variation in plant community composition and structure on a large arid floodplain.Journal of Arid Environ,2005,60(2):283-302.
[26]Tousignant M E,Pellerin S,Brisson J.The relative impact of human disturbances on the vegetation of a large wetland complex.Wetlands,2010,30(2):333-344.
[27]Syrbe R U,Michel E,Walz U.Structural indicators for the assessment of biodiversity and their connection to the richness of avifauna.Ecological Indicators,2013,31(S1):89-98.
[28]Lu X G,Liu X H.Wetland research progresses in China.Scientia geographica sinica,2008,28(3):301-308.
[29]San-JoséJ,Montes R,Buendía C.Response of terrestrial-aquatic palm ecotone(morichal)to anthropogenic disturbance in the Orinoco Lowlands.Folia Geobot,2012,47(2):153-178.
[30]Burnside N G,Joyce CB,Puurmann E,Scott D M.Use of vegetation classification and plant indicators to assess grazing abandonment in Estonian coastal wetlands.Journal of Vegetation Science,2007,18(5):645-654.
[31]King R S,Richardson CJ,Urban D L,Romanowicz E A.Spatial dependency of vegetation environment linkages in an anthropogenically influenced wetland ecosystem.Ecosystems,2004,7(1):75-97.
[32]Reiss K C,Brown M T,Lane C R.Characteristic community structure of Florida's subtropical wetlands:the Florida wetland condition index for depressional marshes,depressional forested and flowing water forested wetlands.Wetlands Ecology and Management,2010,18(5):543-556.
参考文献:
[4]韩大勇,杨永兴,杨杨,李珂.湿地退化研究进展.生态学报,2012,32(4):1293-1307.
[5]李珂,杨永兴,杨杨,韩大勇.放牧胁迫下若尔盖高原沼泽退化特征及其影响因子.生态学报,2011,31(20):5956-5969.
[6]杨永兴.若尔盖高原生态环境恶化与沼泽退化及其形成机制.山地学报,1999,17(4):318-323.
[12]陈利顶,傅伯杰.干扰的类型、特征及其生态学意义.生态学报,2000,20(4):581-586.
[13]田昆,莫剑锋,陆梅,常凤来,杨永兴.人为活动干扰对纳帕海湿地环境影响的研究.长江流域资源与环境,2004,13(3):292-295.
[14]肖德荣,田昆,张利权.滇西北高原纳帕海湿地植物多样性与土壤肥力的关系.生态学报,2008,28(7):3116-3124.
[15]田昆.云南纳帕海高原湿地土壤退化过程及驱动机制[D].长春:中国科学院东北地理与农业生态研究所,2004.
[16]胡金明,董云霞,袁寒,李杰,马彬斌.纳帕海湿地不同退化状态下土壤氮素的分异特征.土壤通报,2012,43(3):690-695.
[17]中国科学院南京土壤研究所.土壤理化分析.上海:上海科学技术出版社,1978.
[18]金振洲.云南高原湿地植物的分类与地理生态特征汇编.北京:科学出版社,2009.
[19]韩大勇,杨永兴,杨杨.若尔盖高原退化沼泽群落植物多样性及种间相关性沿排水梯度的变化.植物生态学报,2012,36(5):411-419.
[21]尚文,杨永兴.滇西北高原纳帕海湖滨湿地退化特征、规律与过程.应用生态学报,2012,23(12):3257-3265.
[28]吕宪国,刘晓辉.中国湿地研究进展.地理科学,2008,28(3):301-308.
